炎症因子和血管内皮生长因子在骨搬移治疗大鼠感染性骨缺损中的变化情况
2020-05-08韦寿锋张传阳张琼郭彦德白亦光曾高峰宗少晖
韦寿锋 张传阳 张琼 郭彦德 白亦光 曾高峰 宗少晖
大量临床研究[1-3]表明,骨搬移在治疗糖尿病足中可以促进血管再生,但其作用机制未明。糖尿病足是一种严重的骨科疾病,常因处理不当而引起感染性骨缺损,是骨科治疗的难题之一[4]。感染性骨缺损临床上的不易愈合,不仅给患者带来了肢体上的疼痛而且造成了生存质量的下降,因此采取合适的治疗技术来缩短感染性骨缺损的愈合时间、减轻患者的痛苦十分关键[5-6]。目前治疗骨缺损的技术包括骨搬移技术、骨移植技术、髓内钉系统骨延长技术和组织工程技术等,而骨搬移技术是临床上治疗感染性骨缺损的有效手段之一[7-8]。炎症因子是在炎症反应中起激活、承接以及直接损伤作用的一类化学因子。有研究[9-10]表明,骨搬移不仅有助于畸形矫正、组织缺损的修复,还可以抑制炎症因子控制感染。血管内皮生长因子是一种起着血管再生作用,特异性很高的促血管内皮细胞生长因子。应用胫骨横向骨搬移建立兔子模型证实:骨搬移后7 d 发现在创面肉芽组织有较多的血管再生[11]。但到目前为止,骨搬移技术如何促进血管再生的机制仍不明确。本文通过建立大鼠感染性骨缺损模型,探讨炎症因子和血管内皮生长因子在骨搬移治疗感染性骨缺损中的变化情况,为进一步研究感染性骨缺损愈合的机制及临床治疗提供帮助。
1 材料与方法
1.1 材料36 只体质量200 ~250 g 的SPF 级成年SD 雄性大鼠,由广西医科大学动物实验中心提供。白细胞介素-10(IL-10)、干扰素-α(IFN-α)、核因子-κB(NF-κB)、血管内皮细胞生长因子(VEGF)的ELISA kits 购自基因美生物科技有限公司。
1.2 方法
1.2.1 制备实验动物模型SD 大鼠在SPF 级环境适应性饲养一周,术前8 h 禁食禁水。称重后腹腔注射3%戊巴比妥钠(30 mg/kg)。待完全麻醉后,仰卧位固定四肢,手术区备皮消毒,铺无菌洞巾,依次切开皮肤和皮下组织,仔细分离肌肉,用骨膜剥离器仔细剥离骨膜后在胫骨远端用骨钻制成约4 mm 大小的骨缺损[12],在缺损部位注射1 × 104CFU/mL 金黄色葡萄球菌[13],术后不使用抗生素。两周后将感染性骨缺损造模成功的36 只大鼠随机分为骨搬移组和对照组,每组18 只。对照组用生理盐水、双氧水反复清洗创面,刮除炎性肉芽及坏死组织并在胫骨近端安装支架后离断胫骨[14],安装后不进行搬移。骨搬移组用生理盐水、双氧水反复清洗创面,刮除炎性肉芽及坏死组织并在胫骨近端安装支架后离断胫骨,待静息期7 d 后进行搬移,每次搬移约0.5 mm,每天分2 次进行,1 d内先延胫骨纵轴往外侧搬移约0.5 mm,再延胫骨纵轴往内侧搬移约0.5 mm,共搬移14 d。两组大鼠在安装支架后以40 kU/(kg·d)青霉素剂量行同侧大腿肌肉注射,连用3 d 预防感染[15]。对于术中术后死亡的动物给予及时补充。
1.2.2 大体观察观察大鼠感染性骨缺损模型建立及骨搬移手术后的精神、进食、活动情况、手术切口分类及伤口愈合分级。
1.2.3 Micro-CT 观察于手术后第4 周拍摄各组大鼠胫骨Micro-CT 片,观察骨愈合情况。
1.2.4 组织病理学观察于第2、3 和4 周处死每组6 只大鼠,取骨缺损断端为中心的骨组织行苏木精-伊红染色,于低倍镜下(× 100)观察骨小梁、成骨细胞、板层骨生成情况。
1.2.5 ELISA 检测于第2、3 和4 周处死每组6 只大鼠,腹腔取血用酶联免疫吸附法检测IL-10、TNF-α、NF-κB、VEGF 的表达水平。
1.3 统计学方法采用SPSS 24.0 统计软件进行分析,计量资料以均数±标准差表示,采用单因素方差分析来比较不同组间的差异,并用LSD-t法进行两两比较,P<0.05 为差异有统计学意义。
2 结果
2.1 造模情况两组大鼠在感染性骨缺损造模后的切口为污染切口,之后的第1 天出现精神差,进食减少,活动明显受限。造模一周内有3 只老鼠死亡,笔者及时进行了补充。一周后两组大鼠的精神尚可,进食正常,活动稍受限,伤口为丙级愈合。两组大鼠在清创并安装支架后的切口为可能污染切口,安装支架后第4 周,骨搬移组大鼠的伤口为甲级愈合,而对照组大鼠的伤口为乙级愈合。骨搬移术后大鼠第1 天精神食欲欠佳,活动稍受限,术后第3 天搬移组逐渐恢复正常饮食及活动。术后两组大鼠支架固定在位。
2.2 术后第4 周Micro-CT 扫描结果骨搬移组在骨搬移处两断端有大量的骨小梁生成,两断端间隙变小,出现大量完整的骨小梁连接结构;对照组胫骨的两断端有少量的骨小梁形成,两断端间隙仍存在,未见明显的骨小梁连接结构。骨搬移组骨缺损处的骨微结构趋于改善,表现为骨小梁增多变厚,骨缺损间隙变小,出现大量完整的骨小梁连接结构;对照组骨缺损处的骨微结构未明显改善,骨小梁少量增加,骨缺损间隙仍存在,有少量完整的骨小梁连接结构。见图1。
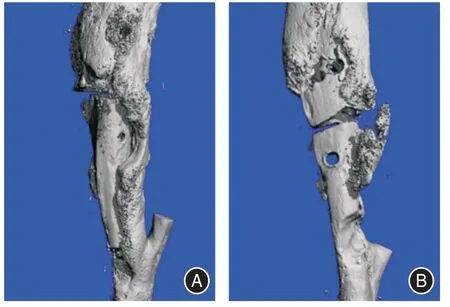
图1 两组大鼠第4 周Micro-CT 片Fig.1 Micro-CT images of rats in both groups at 4th week
2.3 苏木精-伊红(HE)染色结果第2 周骨搬移组可见有大量新生网状骨小梁,骨小梁边缘可见大量成骨细胞附着,骨小梁骨陷窝内充盈骨细胞,成骨活跃;对照组可见有少量网状骨小梁,骨小梁边缘有少量成骨细胞附着。两组第3 周情况介于同组第2 周和第4 周之间。第4 周骨搬移组可见骨小梁粗大,骨小梁间隙缩小并形成板层骨;对照组可见骨小梁增粗不明显,骨小梁间隙较多,有少量板层骨形成,见图2。
2.4 ELISA结果统计分析在第2、3和4周两组大鼠的IL-10、TNF-α、NF-κB 因子表达量随时间均逐渐降低,其中骨搬移组在同一时段的表达量均低于对照组,与对照组相比,差异有统计学意义(P<0.05),见表1-3。两组大鼠的VEGF 因子表达量随时间均逐渐升高,骨搬移组在同一时段的表达量高于对照组,与对照组相比,差异有统计学意义(P<0.05),见表4。
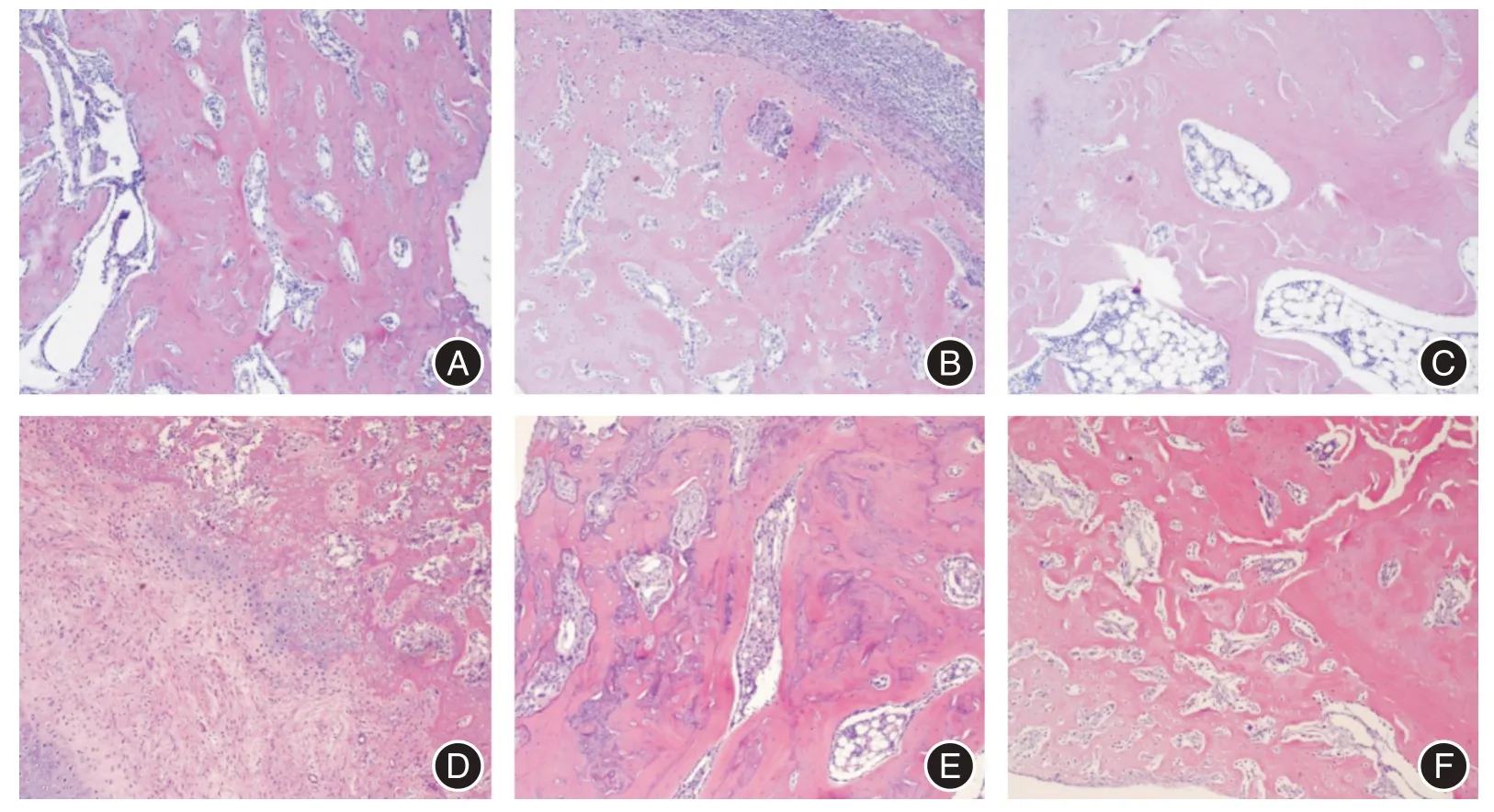
图2 各组术后骨组织苏木精-伊红染色情况(×100)Fig.2 Hematoxylin-eosin staining of bone tissues in each group after surgery(×100)
表1 IL-10 因子表达情况Tab.1 Expression of IL-10 factors in each group±s

表1 IL-10 因子表达情况Tab.1 Expression of IL-10 factors in each group±s
注:骨搬移组与对照组相比,*P <0.05
例数IL-10(ng/L)组别骨搬移组对照组6 6 2周11.219±0.327*15.022±0.113 3周8.892±0.281*14.244±0.286 4周7.130±0.274*13.415±0.266
表2 TNF-α因子表达情况Tab.2 Expression of TNF-α factors in each group±s
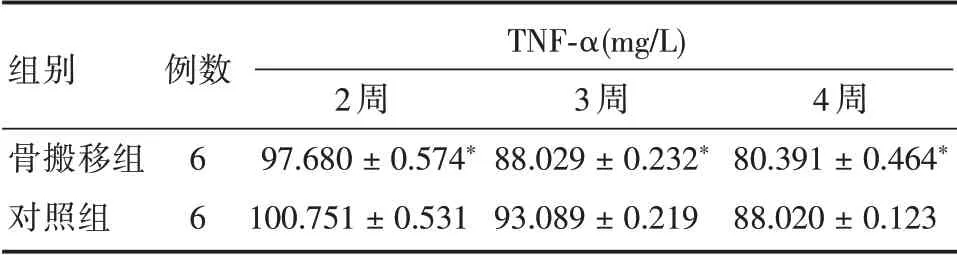
表2 TNF-α因子表达情况Tab.2 Expression of TNF-α factors in each group±s
注:骨搬移组与对照组相比,*P <0.05
例数TNF-α(mg/L)组别骨搬移组对照组6 6 2 周97.680±0.574*100.751±0.531 3 周88.029±0.232*93.089±0.219 4 周80.391±0.464*88.020±0.123
表3 NF-κB 因子表达情况Tab.3 Expression of NF-κB factors in each group±s

表3 NF-κB 因子表达情况Tab.3 Expression of NF-κB factors in each group±s
注:骨搬移组与对照组相比,*P <0.05
例数NF-κB(pg/L)组别骨搬移组对照组6 6 2周135.636±0.046*142.584±0.019 3周130.845±0.043*140.290±0.233 4周126.459±0.053*138.510±0.023
表4 VEGF 因子表达情况Tab.4 Expression of VEGF factors in each group±s

表4 VEGF 因子表达情况Tab.4 Expression of VEGF factors in each group±s
注:骨搬移组与对照组相比,*P <0.05
?
3 讨论
骨搬移手术是由ILIZAROV 等发明,是以张力-应力学说为基础的技术,该学说在骨科领域具有里程碑式的意义[16]。骨搬移在糖尿病足治疗中的创新性应用,取得了良好的疗效,这也为治疗感染性骨缺损提供了新的思路[17]。因此,建立一种经济、简便的动物模型,来明确骨搬移促进感染性骨缺损愈合的机制具有重要意义。但是,目前国内关于骨搬移治疗大鼠感染性骨缺损模型的报道相对较少,对于骨搬移治疗大鼠感染性骨缺损术后何时搬移、每天搬移的次数和距离、搬移的天数的问题,有待进一步的研究。
有研究表明感染性骨缺损的愈合需要多种生化因子和微循环的参与[18-19],其中炎症因子和VEGF 起到了重要的作用。IL-10 是一种重要的免疫调节因子,其抗炎作用强大,可以抑制活化的单核-巨噬细胞产生白细胞介素-1α(IL-1α)、白细胞介素-1β(IL-1β)、单核细胞趋化蛋白等炎症介质[20]。IL-10 体外能够直接刺激大鼠主动脉血管平滑肌细胞发生成骨样分化和钙化,促进了成骨分化标志Runx2 的表达,抑制了促进破骨细胞分化的关键分子NFATc1 的表达[21]。TNF-α是一种最早参与炎症反应的细胞因子,增加血管内皮细胞的通透性使血管得到扩张,进而参与了骨缺损的愈合[22-23]。NF-κB 是一种关键的炎症转录因子,与细胞存活与增殖有关[24]。TNF-α激活NF-κB 通路,抑制骨髓间充质细胞向软骨细胞分化,增加破骨细胞活性,加重炎症反应,延缓骨的愈合[25-26]。当炎症因子高表达量时,可以使血管内皮功能受损,激活血小板,导致血液处于高凝状态,进而促进微血栓的形成,影响骨缺损端的血供,从而导致骨缺损延迟愈合[27-28]。VEGF 是一种具有强大功能的血管调节因子,通过调节血管再生,促进破骨细胞、成骨细胞的增殖和分化[29]。有研究发现,在抑制血管内皮生长因子的表达后,小鼠胫骨骨缺损愈合受到抑制[30]。本实验通过Micro-CT 扫描、HE 染色可知,同时段的骨搬移组感染性骨缺损愈合好于对照组,ELISA 统计表明,骨搬移组的炎症因子表达量低于同期对照组、而骨搬移组的血管内皮生长因子表达量却高于同期对照组,因此笔者推测,骨搬移治疗感染性骨缺损,可能是骨搬移施予的持续、稳定、缓慢的牵引力抑制了炎症因子表达,促进血管内皮生长因子表达,改变了感染性骨缺损的血液动力学或流变学状态,使感染性骨缺损处的血管再生和微循环重建,进而促进感染性骨缺损的愈合。但是本研究只探讨了IL-10、TNF-α、NF-κB 和VEGF 在骨搬移治疗大鼠感染性骨缺损中的变化情况,各细胞因子之间的相互作用和影响极其复杂,需要从细胞、分子水平去进一步探讨。
总之,骨搬移促进大鼠感染性骨缺损愈合,抑制了其炎症反应。进一步探究发现骨搬移治疗术后大鼠体内血清炎症因子表达水平下调、血管内皮生长因子表达水平上调,提示骨搬移可能通过影响炎症因子和血管内皮生长因子的表达量,进而影响感染性骨缺损的修复。
