DPYD、GSTP1、MTHFR基因多态性对5-FU类基础化疗结直肠癌患者疗效的影响
2020-05-08张杰李昌海李林子王琴方功谢雄伟韦智丹张勇廖秋霞
张杰,李昌海,李林子,王琴,方功,谢雄伟,韦智丹,张勇,廖秋霞
荆门市第一人民医院,湖北荆门 448000
结直肠癌(CRC)是最常见的恶性肿瘤之一,目前我国CRC的发病率正以年均4.2%的速度增长。据2015年中国癌症统计数据显示,我国CRC发病率分别位居男、女恶性肿瘤发病率的第三位和第二位[1],严重威胁人民群众的健康。化疗仍是治疗CRC主要手段,以5-FU类(氟尿嘧啶、卡培他滨和替加氟等)为基础的化疗方案是治疗晚期CRC常用方案。但在临床治疗中发现CRC患者在接受以5-FU类为基础的化疗方案时,其化疗疗效及导致的腹泻、口腔黏膜炎、骨髓抑制和心脏毒性等存在个体化差异[2]。5-FU类是一种抗代谢药物,它对很多实体肿瘤有较好活性,其抗肿瘤活性是通过干扰DNA合成和mRNA翻译来实现的。5-FU类药物进入机体后,80%以上经肝脏和外周血单核细胞(PBMCs)中的二氢嘧啶脱氢酶(DPD)还原为二氢氟尿嘧啶,进而代谢生成尿素、氨和二氧化碳等终产物排出体外。仅1%~5%进入肿瘤细胞内,在磷酸激酶的催化下进一步转化为活性代谢物氟脱氧尿苷-磷酸(FdUMP)、氟脱氧尿苷三磷酸(FdUTP)和氟尿苷三磷酸(FUTP)。FdUMP与胸苷酸合成酶(TS)及亚甲基四氢叶酸(CH2FH4)以共价结合形成三元复合物(FdUMP-dTMP-TS酶),从而抑制TS活性,进而干扰DNA的合成。FdUTP和FUTP通过掺入DNA和RNA链中,破坏其结构和功能的完整性[3]。5-FU类药物代谢过程中的各种关键酶的相应基因[如DPD基因(DPYD)、谷胱甘肽S转移酶P1(GSTP1)和亚甲基四氢叶酸还原酶(MTHFR)等]多态性可能导致5-FU类药物抗肿瘤作用和(或)不良反应的个体间差异[4]。因此,本研究将探讨DPYD、MTHFR和GSTP1单核苷酸多态性是否可作为预测5-FU药物化疗疗效评估、预后判断的指标,为晚期CRC的个体化化疗提供依据。
1 资料与方法
1.1 临床资料 选取荆门市第一人民医院2017年11月~2019年4月收治的90例接受化疗的CRC患者。入选标准:经病理组织学证实的Ⅲ期、Ⅳ期(TNM分期)CRC;具有可测量的实体病灶;先前未进行过姑息性治疗或既往使用新辅助或辅助化疗(不含5-FU类)的结束时间距本次疾病复发时间≥6个月;KPS评分≥60分;预计生存时间≥3个月;化疗前血常规、肝功能、肾功能正常;年龄≥18岁。 本研究经医院伦理委员会批准,所有患者知情同意。
1.2 化疗方法 所有患者接受以5-FU类药物(氟尿嘧啶、卡培他滨和替加氟等)为基础的化疗方案(FOLFOX、CapeOX化疗方案)进行化疗,其中FOLFOX方案(FOLFOX4方案26例、mFOLFOX6方案8例)34例、CapeOX方案56例。FOLFOX4:奥沙利铂85 mg/m2第1天静脉滴注2 h;亚叶酸钙200 mg/m2第1天、第2天静脉滴注;氟尿嘧啶400 mg/m2第1天、第2天静脉推注,氟尿嘧啶600 mg/m2第1天、第2天22 h持续静脉滴注,每2周重复。mFOLFOX6:奥沙利铂85 mg/m2第1天静脉滴注;亚叶酸钙400 mg/m2第1天静脉滴注;氟尿嘧啶400 mg/m2第1天静脉推注,氟尿嘧啶1 200 mg/m2第1天、第2天22 h持续静脉滴注,每2周重复。CapeOX:奥沙利铂130 mg/m2第1天静脉滴注大于2 h;卡培他滨:每次1 000 mg/m2,口服,每日2次,第1~14天,每3周重复。所有病例在化疗3个周期后评价疗效[5]。
1.3 疗效评价 收集临床资料并随访,评价化疗疗效及不良反应。至少完成3个周期化疗评价疗效(肿瘤进展除外),行体格检查、实验室检查和影像学检查。按实体瘤疗效标准(RECIST)分为完全缓解(CR)、部分缓解(PR)、稳定(SD)和进展(PD),以CR+PR为有效计算疾病控制率。不良反应评价参照WHO(1981年)标准。
1.4 DPYD、MTHFR和GSTP1基因分型检测 所有荧光染色原位杂交测序检测试剂均由北京华夏时代基因科技发展有限公司购买。应用TL998A型荧光染色原位杂交测序检测系统(微测序基因分析系统,西安天隆科技有限公司),直接读取血液白细胞中的目标单核苷酸多态性位点。抽取2 mL静脉血,置于EDTA抗凝管,上下颠倒混匀,再取100 μL加入事先配置好的NH4Cl预处理液离心管中,3 000 r/min离心5 min。吸走残余液体,加入1 mL生理盐水彻底重悬白细胞,然后室温3 000 r/min离心5 min。将残余液体吸干净,向富集有白细胞的离心管中加入100 μL PHARM-GENE 01 SNP分析保存液,用移液器反复吹打混匀直至成透明无团块状,室温静置20~30 min。各取1 μL经上述流程处理后的白细胞样本,分别加入到DPYD(rs3918290、rs55886062)、GSTP1(rs1695)、MTHFR(rs1801133、rs1801131) PHARM-GENE 200 SNP分析样品处理试剂,震荡混匀,短暂离心。将待检测的样品处理试剂按照相应序号位置,置于实时荧光检测仪(TL998A型荧光染色原位杂交测序检测仪)中,选择检测基因类型,开始检测。
1.5 统计学方法 采用SPSS13.0统计软件。基因型分布由χ2检验分析是否符合Hardy-Weinberg遗传平衡定律,以P>0.05视为符合Hardy-Weinberg平衡。患者的一般资料和CRC化疗方案疗效的关系采用χ2检验;DPYD(rs3918290、rs55886062)、GSTP1(rs1695)、MTHFR(rs1801133、rs1801131)基因多态性与CRC化疗方案疗效的关系采用二元Logistic回归分析。P<0.05为差异有统计学意义。
2 结果
2.1 CRC患者DPYD、MTHFR和GSTP1基因多态性分布 入选的90例晚期CRC患者纳入检测,共检测了DPYD(rs3918290、rs55886062)、GSTP1(rs1695)、MTHFR(rs1801133、rs1801131)3个基因共5个位点。其中DPYD(rs3918290、rs55886062)2个位点均为野生型,该样本不符合Hardy-Weinberg遗传平衡检验。GSTP1 rs1695基因型中AA型57例(63.3%)、AG型27例(30.0%),GG型6例(6.7%),等位基因A、G占比分别为78.3%、21.7%。MTHFR rs1801133基因型中CC型30例(33.3%)、TC型46例(51.1%)、TT型14例(15.6%),等位基因C、T占比分别为58.9%、41.1%。MTHFR rs1801131基因型中AA型58例(64.4%)、AC型28例(31.1%)、CC型4例(4.4%),等位基因A、C占比分别为80.0%、20.0%。经Hardy-Weinberg遗传平衡定律检验,基因型GSTP1 rs1695(χ2=1.22,P>0.05)、MTHFR rs1801133(χ2=0.28,P>0.05)、MTHFR rs1801131(χ2=0.07,P>0.05)在这些人群中的分布符合遗传平衡,没有明显偏离的分布,说明该研究资料具有群体代表性。
2.2 DPYD、GSTP1、MTHFR基因多态性与CRC患者近期疗效的关系 90例晚期CRC患者治疗后CR、PR、SD、PD分别为4、32、31、24例,总有效36例,总有效率为40.0%。患者性别、年龄、TNM分期、肿块部位、化疗方案(FOLFOX4、mFOLFOX6、CapeOX)和化疗疗效均无明显相关性(P均>0.05),详见表1。90例CRC患者中,GSTP1 rs1695 AG+GG基因型患者化疗失败的可能性是AA基因型的3.193倍(OR=3.193,95%CI:1.307~7.804,P<0.05),MTHFR rs1801133 TC+TT基因型患者化疗失败的可能性是CC基因型的4.000倍(OR=4.000,95%CI:1.431~11.180,P<0.05);携带MTHFR rs1801131 AA、AC+CC基因型患者化疗后有效率比较差异无统计学意义,详见表2。
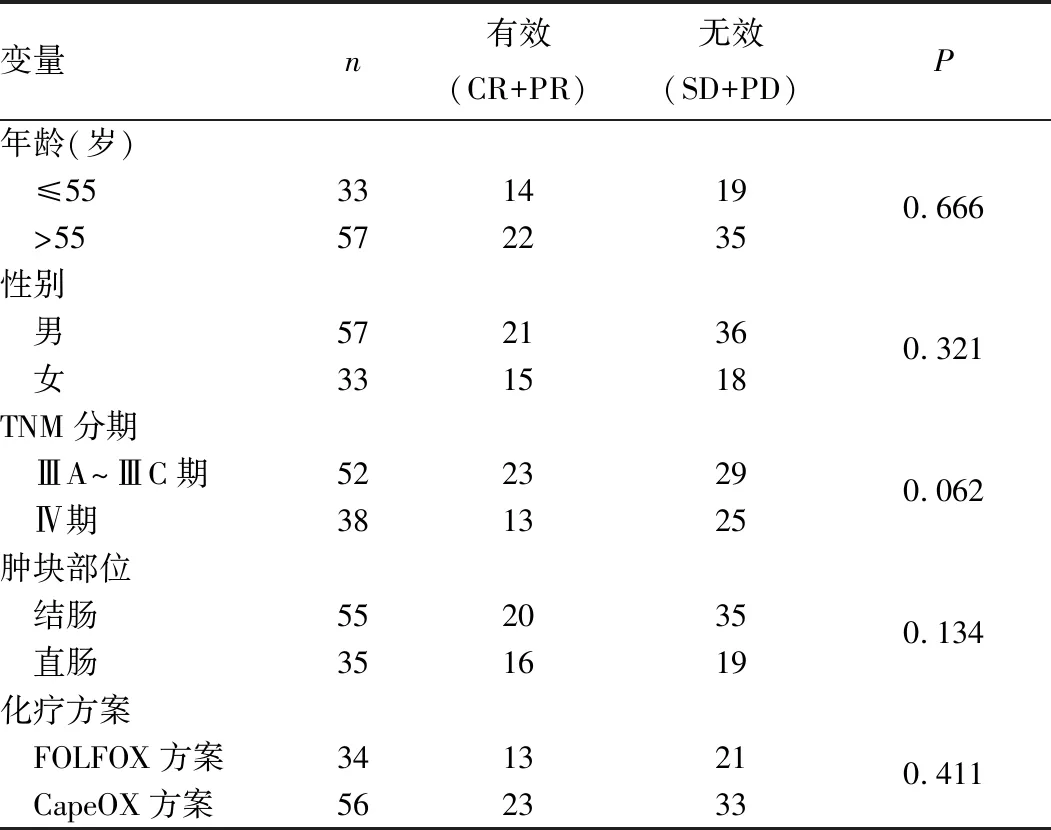
表1 以5-FU类为基础化疗晚期CRC 患者临床病理特征与疗效的关系(例)

表2 以5-FU类为基础化疗晚期CRC 患者GSTP1、MTHFR基因型与疗效的关系[例(%)]
3 讨论
5-FU类药物是治疗消化道肿瘤的基础药物,5-FU类药物治疗疗效和耐受性方面存在个体差异的原因与其代谢相关的酶密切相关。研究发现,约80%的5-FU类药物进入人体后在肝脏经由DPD降解失活,DPD是5-FU类药物代谢的限速酶。因此,DPD活性高低直接决定了5-FU类药物进入合成代谢和产生核苷酸类似物的量,进而影响5-FU类药物治疗疗效[6]。DPYD作为DPD的编码基因,其基因的多态性可导致DPD的结构及活性的变化,目前已证实的突变位点超过100个[7],其中较为明确的与DPD缺陷相关的突变为以下几个单核苷酸多态性:DPYD*2A(rs3918290)和DPYD*13(rs55886062)[8,9]。但本研究入选的90例晚期CRC患者,DPYD(rs3918290、rs55886062)2个位点均为野生型,不符合Hardy-Weinberg遗传平衡检验,故未纳入后续研究。DPYD*2A(rs3918290)的变异较多,而中国台湾和日本的研究[10,11]与我们结果一致,表明国内或亚洲人DPYD基因型的多态性极低,后期可扩大样本进一步研究。
MTHFR是叶酸代谢的关键酶,能将5,10-亚甲基四氢叶酸还原为5-甲基四氢叶酸(5-MTHF)并产生一个甲基基团。甲基基团是dTMP合成过程中的必需原料,同时参与5-FU类药物在体内代谢的活性代谢物FdUMP和TS形成“FdUMP-dTMP-TS酶”三聚体复合物过程,进而抑制TS的生物活性,最终增强5-FU类药物化疗效果[12,13]。故MTHFR基因多态性与5-FU类药物化疗效果敏感性引起密切关注,其中研究最多也最常见的与MTHFR酶活性有关的基因多态性位点为MTHFR C677T(rs1801133)和A1298C(rs1801131)。本研究结果显示MTHFR rs1801133基因多态性与CRC患者以5-FU类为基础的化疗疗效有显著相关性,此结果与国内外相关研究报道一致[14,15]。但本研究发现MTHFR rs1801131基因多态性和疗效无显著相关性,这与部分报道[16]不一致,可能和本次样本数量偏少以及患者的不同种族有关。
谷胱甘肽S转移酶是一种可溶性的二聚体同工酶,具有强有力的催化效应,是体内生物转化最重要的Ⅱ相代谢酶之一。它的主要功能是催化Ⅰ相酶代谢的亲电子基团(包括多种化疗药物)与谷胱甘肽结合,使其成为水溶性物质而排出体外,消除它的细胞毒性。其同工酶家族中GSTP1广泛存在于人体肿瘤组织中,在人体上皮来源的恶性肿瘤细胞中表达率较高,其活性变化与恶性肿瘤对化疗药物的敏感性相关[17,18]。研究表明,GSTP1参与5-Fu类和奥沙利铂等多种化疗药物的解毒过程,故导致GSTP1活性下降的基因突变会增强肿瘤细胞对化疗药物的敏感性[19]。本研究结果显示,90例晚期CRC患者中,携带GSTP1 rs1695 AG+GG基因型患者化疗失败的可能性是AA型的3.193倍,提示GSTP1 rs1695基因多态性与CRC患者以5-FU类为基础的化疗疗效有显著相关性,此结果与相关研究报道一致[20,21]。
综上所述,晚期CRC患者中与5-FU类药物(氟尿嘧啶、卡培他滨和替加氟等)代谢途径相关的关键酶基因(MTHFR、GSTP1)多态性与以5-FU类为基础的化疗疗效有显著相关性。结合本研究结果及既往的文献报道,MTHFR rs1801133、GSTP1 rs1695基因多态性与CRC患者接受以5-FU类为基础药物化疗的临床疗效具有显著相关性。因此通过检测MTHFR rs1801133、GSTP1 rs1695单核苷酸多态性有利于指导和预测CRC患者接受以5-FU类为基础药物化疗的化疗疗效,为CRC患者的个体化治疗提供依据。
