高产monacolin K或色素红曲菌发酵米糠及碎米的研究
2020-05-07吴双双冯艳丽
吴双双,冯艳丽~4
(1.湖北师范大学 生命科学学院,湖北 黄石 435002;2.湖北师范大学 生物学国家级实验教学示范中心,湖北 黄石 435002;3.特色野菜良种繁育与综合利用技术湖北省工程研究中心,湖北 黄石 435002;4.湖北师范大学 食用野生植物保育与利用湖北省重点实验室,湖北 黄石 435002)
0 前言
红曲菌(Monascusspp.),又称红曲霉,是一类小型丝状真菌,是中国重要的可食用微生物资源[1,2]。红曲菌的发酵产物——红曲最早在中国发现,其生产及应用历史长达近2000年[3]。以大米等富含淀粉的原料为培养基,接种红曲菌后可发酵制成红曲,它既可食用也可作药用[4,5]。红曲菌可产生多种有益次生代谢产物,主要包括莫纳可林K(monacoin K,MK),红曲色素(Monascuspigments,MPs)、麦角固醇及γ-氨基丁酸等。但是,部分红曲菌株还可产生肾毒素——桔霉素[6,7]。目前,对红曲菌代谢产物研究和应用最为广泛的是MPs和MK。
MPs不仅热稳定性及蛋白着色力强、对pH稳定,它还因安全无毒被用作天然食品着色剂[6,7]。MK可有效减少或阻断人体胆固醇的合成,从而调节人体血压和血脂[8~10]。桔霉素是部分种属的红曲菌在代谢过程中产生的真菌毒素,具有肾毒性,还可能致畸、诱发肿瘤、致突变等[11~13]。众所周知,发酵基质对微生物生长及代谢具有重要意义。在红曲发酵过程中,若采用价格低廉的农业副产物作为基质进行发酵,从而获取高附加值的MPs或MK,可在大幅降低生产成本的同时,强化农副产物的综合利用[14]。
米糠是稻谷加工过程中的重要副产物,它依附在糙米的表层,主要由外果皮、中果皮、交联层、种皮和糊粉层组成[15]。虽然米糠的重量约为稻谷总重的6%,但稻米60%的营养成分存在于米糠中,且含有90%以上人体必需的微量元素[16]。米糠中的常规营养成分主要包括脂肪、蛋白质、糖类、维生素和矿物元素等。另外,米糠还含有角鲨烯、必需脂肪酸和神经酰胺等近百种功能因子,具有预防心血管疾病、肿瘤及调节血糖等功能[17,18]。我国米糠年产量约1 200万吨,但其利用率极低,还不足20%.目前,米糠主要用于饲料加工,还有部分用于植酸、肌醇、米糠油等的开发,利用率及利用范围有待提高和扩展[19]。
我国是世界上第一稻米生产大国,世界上34%的稻米产自我国[20]。在稻米的加工过程中,占稻米产量10%~15%的副产物为碎米,每年可产生约3 000万吨碎米。碎米的主要成分与大米十分相似,主要包括约75%的淀粉和约8%的蛋白质及少量生理活性物质和脂类物质。此外,碎米中还含有大量矿物元素和维生素B族[21],但碎米价格却比大米便宜一半甚至更多[20]。然而,我国的碎米资源利用率较低。目前主要利用碎米制作新脂肪替代物、多孔淀粉、抗性淀粉等[20],获取碎米蛋白[22],研制米面包、米饮料、米粉、人造米等[23]。
鉴于已有的文献和现有的研究基础,以前期实验过程中诱变得到的可高产MK的红曲菌ZWN2及可高产MPs的红曲菌ZWS5为实验菌株,以米糠或碎米为基础培养基,对上述两株红曲菌发酵米糠或碎米产MK或MPs的工艺条件进行优化。以期通过该研究,为后续进一步拓宽米糠和碎米的综合利用途径提供借鉴。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株 可高产MK的红曲菌ZWN2及可高产MPs红曲菌ZWS5,是以丛毛红曲菌(Monascuspilosus)MS-1(CCTCC M 2013295,中国典型培养物保藏中心,武汉)为出发菌株诱变获得。
1.1.2 培养基 马铃薯葡萄糖琼脂(Potato dextrose agar,PDA)培养基[24]:称取200 g去皮马铃薯,切块至大小约为边长为2 cm的正方体,添加1 000 mL的蒸馏水并煮沸20 min,经8层纱布过滤,加入20 g琼脂粉并加热搅拌至完全溶解,后加入20 g葡萄糖并搅拌至溶解,冷却后以蒸馏水定容至1 000 mL.
种子液培养基[24,25]:葡萄糖80 g,蛋白胨10 g,NH4H2PO42 g,MgSO4·7H2O 0.5 g,CaCl20.1 g,土豆汁(PDA培养基不添加葡萄糖及琼脂粉)1 000 mL.
固态培养基组分及发酵参数[26]:优化培养基中的基础培养基为米粉和豆粉,其比例为3∶2,原始培养基的基础培养基为纯米粉。每个250 mL三角瓶中加入上述基础培养基50 g,培养基中水分、冰乙酸及MgSO4·7H2O含量分别调整为35%(w/w),0.6%(v/w)和0.004 mol/kg,混匀后灭菌并趁热打散。
上述培养基均在121 ℃条件下灭菌20 min.
1.1.3 试剂 葡萄糖:重庆和平制药有限公司;无水氯化钙、冰乙酸、磷酸二氢铵、七水硫酸镁、无水氯化锂及无水乙醇均为分析纯试剂,蛋白胨及琼脂粉均为生物试剂,乙腈及磷酸均为色谱纯试剂,上述试剂均购于国药集团化学试剂有限公司;MK标准品(纯度≥98%):购于阿拉丁公司;大豆分离蛋白及大豆异黄酮(纯度80%),购于河南千志商贸有限公司,纯净水、土豆:市售。
1.2 仪器与设备
紫外分光光度计:UV-5 100 B,上海元析仪器有限公司;高效液相色谱仪:Agilent 1 260,安捷伦科技有限公司;其它均为实验室常规仪器。
1.3 方法
1.3.1 种子液的培养及固态发酵 取15 mL无菌水,加入在30 ℃培养10 d的红曲菌茄形瓶中,用接种铲将茄形瓶中的红曲菌孢子洗入装有玻璃珠的无菌三角瓶中打散。将上述红曲菌孢子悬液接入种子液培养基,控制接种量为10%(v/v).将种子液置于30 ℃、130 r/min培养36 h.在进行红曲固态发酵时,控制种子液的接种量为13%(v/w),在30 ℃培养3 d后调整温度至25 ℃,继续培养至14 d(该发酵条件主要用于红曲菌产MK,若用于红曲菌产MPs则将培养基置于30 ℃培养14 d).将发酵产物置于55 ℃烘干12 h后粉碎并过80目筛备用[26]。
1.3.2 红曲菌发酵产物的色价检测 采用分光光度法测定红曲菌发酵产物的色价[24]。在50 mL离心管中加入0.3 g粉碎后的红曲菌发酵产物和10 mL 75%乙醇,充分振荡、匀混后超声提取1 h.在室温静置15 min后取上清液,于8 000 r/min离心10 min,取上清液待用。将上述所得上清液用75%乙醇稀释至适宜的浓度,以确保其OD505nm值在0.2~0.8之间,用75%的乙醇作为空白对照,调整分光光度计波长至505 nm,测定吸光度值。红曲菌发酵产物的色价计算公式为:

1.3.3 红曲菌发酵产物中MK的检测 以优化后的高效液相色谱(High performance liquid chromatography,HPLC)法分析红曲菌发酵产物中的MK含量及MK和MPs同系物的种类[26,27]。MK的提取同1.3.2中MPs的提取。取离心后的红曲菌发酵产物提取液,用75%乙醇稀释至适宜浓度,使样品中MK的浓度与标样中MK的浓度尽量接近。采用微孔有机滤膜(0.22 μm)过滤样液后备用。采用Agilent 1 260的HPLC系统,Inertsil ODS-3的色谱柱,乙腈∶水∶0.5%磷酸=60∶37∶3作为流动相,控制流速、柱温和检测波长分别为1.0 mL/min、25 ℃及238 nm,进样量设置为20 μL(若进行MPs同系物的监测,则主要观察505 nm,460 nm和390 nm,分别代表红色素、橙色素和黄色素)。红曲菌发酵产物中MK含量的计算公式如下:
1.3.4 发酵基质对红曲菌ZWN2产MK及MPs的影响 分别采用大米、米粉:豆粉(3∶2)、米糠和碎米粉为基础发酵基质,分别调整培养基中水分、冰乙酸及MgSO4·7H2O含量为35%(w/w),0.6%(v/w)和0.004 mol/kg.接种量控制在13%(v/w),接种后的培养物在30 ℃培养3 d,再调整温度至25 ℃并培养至14 d[26].采用1.3.2和1.3.3中所述的方法分析发酵产物中的MK及MPs.分别以MK及MPs的产量作为考察指标,选取适合红曲菌产MK或MPs的基础培养基。
1.3.5 刺激物对红曲菌产MK及MPs的影响
1.3.5.1 刺激物对红曲菌ZWN2在米糠中产MK及MPs的影响
课题组已有的研究结果(数据未列出)指出,大豆异黄酮、葡萄糖及大豆分离蛋白对红曲菌产MK及MPs均影响显著。在1.3.4中筛选所得适合产MK的基础培养基中分别添加不同的刺激因子,主要包括:大豆分离蛋白(5%)、大豆异黄酮(3%)、葡萄糖(3%),大豆分离蛋白+大豆异黄酮(5%+3%)、大豆分离蛋白+葡萄糖(5%+3%)、大豆异黄酮+葡萄糖(3%+3%)和大豆分离蛋白+大豆异黄酮+葡萄糖(5%+3%+3%)(w/w),调整培养基中水分、冰乙酸及MgSO4·7H2O含量同1.3.4,红曲菌的接种及固态发酵参数同1.3.1.红曲菌发酵产物中MK及MPs的分析方法同1.3.2和1.3.3该实验的目的是筛选促进红曲菌ZWN2产MK的刺激物。
1.3.5.2 刺激物对红曲菌ZWS5在碎米中产MPs的影响
在1.3.4筛选所得的MPs基础培养基中分别添加刺激因子,主要包括:大豆分离蛋白(5%)、大豆异黄酮(3%)、葡萄糖(3%),大豆分离蛋白+大豆异黄酮(5%+3%)、大豆分离蛋白+葡萄糖(5%+3%)、大豆异黄酮+葡萄糖(3%+3%)和大豆分离蛋白+大豆异黄酮+葡萄糖(5%+3%+3%)(w/w),调整培养基中水分、冰乙酸、MgSO4·7H2O含量及接种量同1.3.4,在30 ℃培养至14 d,发酵产物处理方法同1.3.1.红曲菌发酵产物中MPs的分析方法同1.3.2和1.3.3.该实验的目的是筛选促进红曲菌ZWS5产MPs的刺激物。
1.3.6 刺激物添加量对红曲菌产MK及MPs的影响
1.3.6.1 刺激物添加量对红曲菌ZWN2产MK及MPs的影响
在1.3.4筛选出的适合红曲菌产MK基础培养基中添加不同量的由1.3.5.1筛选所得的刺激物,调整培养基中水分、冰乙酸及MgSO4·7H2O含量同1.3.4,红曲菌的接种及固态发酵参数同1.3.1.红曲菌发酵产物中MK及MPs的分析方法同1.3.2和1.3.3.该实验的目的是筛选促进红曲菌ZWN2产MK刺激物的适宜添加量。
1.3.6.2 刺激物添加量对红曲菌ZWS5产MPs的影响
在1.3.4筛选出的适合红曲菌产MPs基础培养基中添加不同量的由1.3.5.2筛选所得的刺激物,调整培养基中水分、冰乙酸及MgSO4·7H2O含量同1.3.4,红曲菌的接种及固态发酵参数同1.3.5.2.红曲菌发酵产物中MPs的分析方法同1.3.2.该实验的目的是筛选促进红曲菌ZWS5产MPs刺激物的适宜添加量。
1.3.7 优化后米糠及碎米培养基与优化培养基产MK及MPs对比分析
1.3.7.1 红曲菌ZWN2在优化后米糠培养基与优化培养基中产MK对比分析
将红曲菌ZWN2分别接种于1.3.6.1筛选所得的培养基和优化培养基进行固态发酵[26],调整培养基中水分、冰乙酸及MgSO4·7H2O含量同1.3.4,红曲菌的接种及固态发酵参数同1.3.1.红曲菌发酵产物中MK及MPs的分析方法同1.3.2和1.3.3.该实验的目的是分析ZWN2在不同培养基中产MK能力。
1.3.7.2 红曲菌ZWS5在优化后碎米培养基与纯大米培养基中产MPs对比分析
将ZWS5分别接种于1.3.6.2实验筛选所得的培养基和纯大米培养基进行固态发酵,调整培养基中水分、冰乙酸及MgSO4·7H2O含量同1.3.4,红曲菌的接种及固态发酵参数同1.3.5.2.红曲菌发酵产物中MPs的分析方法同1.3.2.该实验主要是分析红曲菌ZWS5在不同培养基中产MPs的能力。
2 结果与讨论
2.1 发酵基质对红曲菌ZWN2产MK及MPs的影响
将红曲菌ZWN2分别接种于以大米、米粉∶豆粉(3∶2)、米糠和碎米粉为基础培养基的培养基中固态发酵,分析红曲菌发酵产物中的MPs及MK,结果如图1所示。
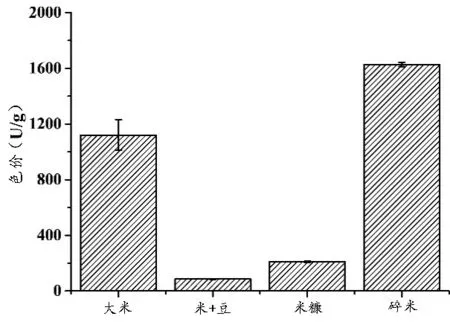
图1 培养基对红曲菌ZWN2菌株产MPs和MK的影响
由图1可知,对4种培养基产MPs和MK的情况进行对比分析。结果表明,4种培养基产MPs和MK的组间差异均呈极显著差异(p值分别为0.000026和0.000015).证明基础培养基的类型对红曲菌产MPs和MK均呈极显著影响(p<0.001).同等条件下,碎米更适于红曲菌产MPs而米糠更适宜红曲菌产MK.究其原因,可能是由于米糠中含有大量的生理活性物质和微量元素,与前期优化的米加豆的混合基础培养基相比,更适宜红曲菌的生长和MK的产生[28]。在MPs的产生方面,碎米的组分虽与大米非常相似,但碎米中含有的丰富矿物元素和维生素B族更利于红曲菌产MPs[21].在后续实验中,以米糠作为红曲菌产MK的基础培养基,以碎米作为红曲菌产MPs的基础培养基。
2.2 刺激物对红曲菌产MK及MPs的影响
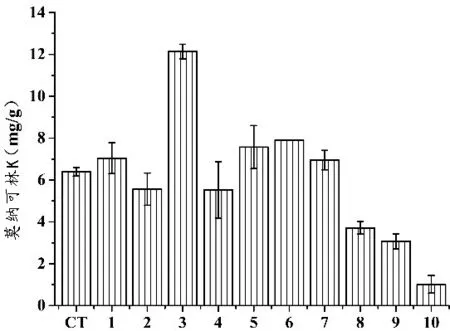
2.2.1 刺激物对红曲菌ZWN2在米糠中产MK及MPs的影响 将不同组合和比例的大豆分离蛋白、葡萄糖及大豆异黄酮添加至由2.1筛选所得的米糠培养基中,考察刺激物对红曲菌ZWN2在米糠培养基中产MPs和MK的影响,结果如图2所示。
由图2可知,所添加的3种刺激物对红曲菌ZWN2产MPs均有一定程度的抑制作用。在对红曲菌产MK的影响方面,当添加5%大豆分离蛋白或3%大豆异黄酮时,对红曲菌ZWN2产MK具有一定的促进作用,但效果不显著,这与前期研究结果并非完全相符(数据未列出)。造成该现象的原因可能是该刺激物的添加量并不适于红曲菌ZWN2产MPs或MK.后续实验中,采用大豆异黄酮和大豆分离蛋白继续探讨它们促进红曲菌ZWN2产MK的最适添加量。
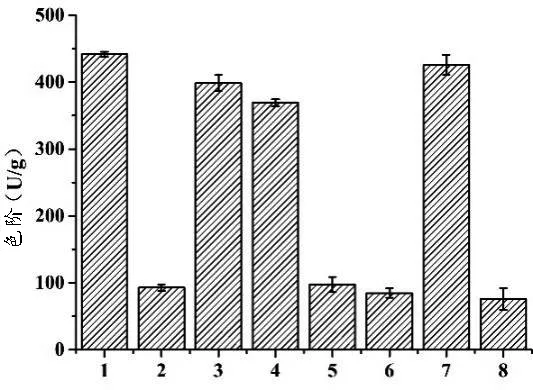
1:米糠空白对照;2∶5%大豆分离蛋白;3∶3%大豆异黄酮;4∶3%葡萄糖;5∶5%大豆分离蛋白+3%大豆异黄酮;6∶5%大豆分离蛋白+3%葡萄糖;7∶3%大豆异黄酮+3%葡萄糖;8∶5%大豆分离蛋白+3%大豆异黄酮+3%葡萄糖。
2.2.2 刺激物对红曲菌ZWS5在碎米中产MPs的影响 根据2.1的实验结果,碎米作为基础培养基适宜红曲菌产MPs.在碎米培养基中添加不同刺激物,考察刺激物对红曲菌ZWS5产MPs的影响,结果如图3和表1所示。
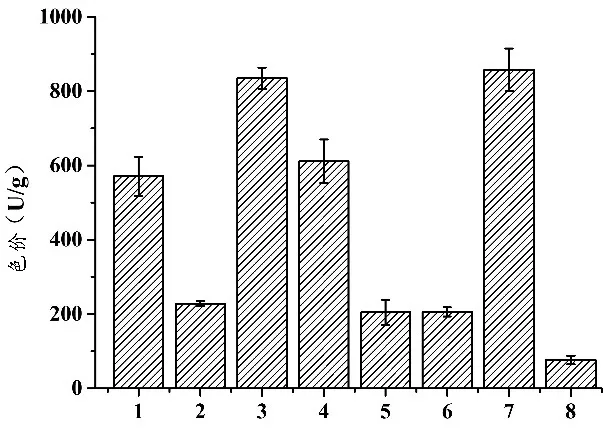
图3 刺激物对红曲菌ZWS5在碎米中产MPs的影响
1:碎米空白对照;2∶5%大豆分离蛋白;3∶3%大豆异黄酮;4∶3%葡萄糖;5∶5%大豆分离蛋白+3%大豆异黄酮;6∶5%大豆分离蛋白+3%葡萄糖;7∶3%大豆异黄酮+3%葡萄糖;8∶5%大豆分离蛋白+3%大豆异黄酮+3%葡萄糖。

表1 刺激物对红曲菌ZWS5在碎米中产MPs同系物的影响
由图3可知,在碎米培养基中添加3%大豆异黄酮或者3%大豆异黄酮+3%葡萄糖均可显著促进对红曲菌ZWS5产MPs(p3=0.024831,p7=0.034962,p<0.05),但二者之间无显著性差异(p=0.670057>0.05),选择3%大豆异黄酮作为促进红曲菌ZWS5产MPs的适宜刺激物。由表1可知,刺激物不仅可影响红曲菌产MPs的产量,还可影响MPs的同系物种类。添加大豆分离蛋白的红曲发酵产物中红色素的同系物种类的数量少于对照,橙色素同系物种类有所增加,黄色素同系物种类基本没有变化。葡萄糖或大豆异黄酮对红曲菌发酵产物中红、橙、黄色素同系物种类影响不明显。上述现象可能是刺激物的添加影响了MPs的合成途径造成的,这与已有文献报道类似[29]。
2.3 刺激物的添加量对红曲菌产MK及MPs的影响
2.3.1 刺激物添加量对红曲菌ZWN2产MK及MPs的影响 结合2.2.1的结果,筛选获得大豆分离蛋白和大豆异黄酮作为促进红曲菌ZWN2产MK的刺激物,在米糠培养基中分别添加不同量的大豆分离蛋白和大豆异黄酮,考察其对红曲菌ZWN2产MK的影响,结果如图4和图5所示。
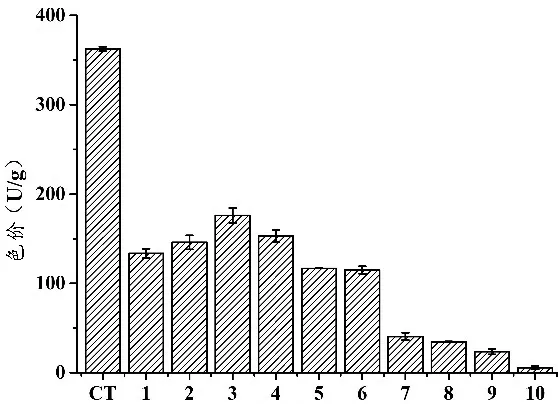
大豆分离蛋白添加量(%)
大豆分离蛋白添加量(%)
图4 大豆分离蛋白添加量对红曲菌ZWN2在米糠中产MPs及MK的影响

大豆异黄酮添加量(%)

大豆异黄酮添加量(%)
图5 大豆异黄酮添加量对红曲菌ZWN2在米糠中产MPs及MK的影响
由图4可知,大豆分离蛋白对红曲菌ZWN2产MPs具有显著抑制作用(p<0.05),该结果与课题组前期研究结果相符(数据未列出)。当培养基中大豆分离蛋白添加量为3%时,红曲菌ZWN2发酵米糠所得产物中MK的量最高,达12.14 mg/g.与对照组(6.39 mg/g)相比,MK的产量提高了89.98%.由图5可知,当大豆异黄酮的添加量较小(<4%)时,对红曲菌ZWN2 产MPs呈抑制作用。当大豆异黄酮的添加量达到4%或5%时,ZWN2发酵产物中MPs产量有所提高,且大豆异黄酮添加量为5%时,其发酵产物的色价显著高于大豆异黄酮添加量为4%时的色价(0.01
2.3.2 刺激物添加量对红曲菌ZWS5产MPs的影响 根据2.2.2的实验结果,筛选获得大豆异黄酮用作促进红曲菌ZWS5产MPs的刺激物。以碎米为基础培养基,分别调整其中大豆异黄酮的添加量呈浓度梯度,考察大豆异黄酮的添加量对红曲菌ZWS5产MPs的影响,结果如图6所示。

大豆异黄酮添加量(%)
由图6可知,当大豆异黄酮的添加量为1%和3%时,均可显著促进红曲菌ZWS5在碎米中产MPs(p1=0.029462<0.05和p3=0.045869<0.05),所得发酵产物的色价可达918.4 U/g和886.4 U/g.与对照组纯碎米发酵产物的色价675.2 U/g相比,分别提高36.02%和31.28%.但大豆异黄酮的添加量为1%或3%时,两者所得发酵产物的色价之间无显著差异(p=0.656778>0.05).故选择添加1%的大豆异黄酮作为红曲菌ZWS5发酵碎米产MPs的适宜添加量。
2.4 优化后米糠及碎米培养基与优化培养基产MK及MPs对比分析
结合2.3.1的实验结果,筛选出3%大豆分离蛋白作为红曲菌ZWN2产MK的适宜添加量。在优化培养基即米豆混合培养基、米糠培养基和优化后的米糠培养基即添加3%的大豆分离蛋白中分别接入红曲菌ZWN2,对比分析不同培养基对红曲菌ZWN2产MK能力的影响,结果如图7所示。
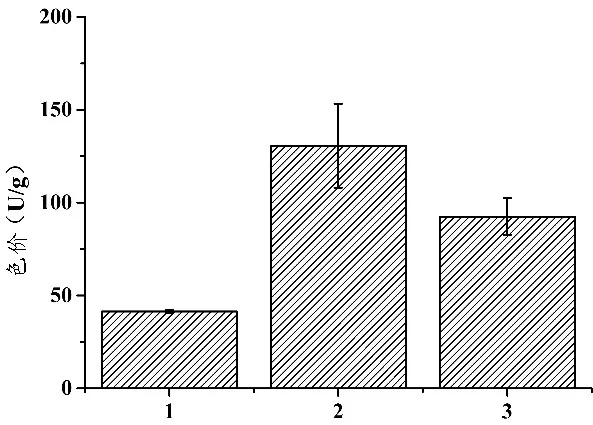
由图7可知,红曲菌ZWN2分别在3种培养基即优化培养基即米豆混合培养基、米糠培养基和优化后的米糠培养基即米糠+3%大豆分离蛋白中均发酵14 d,红曲菌ZWN2发酵优化后的米糠培养基所得发酵产物中MK产量最高,为11.68 mg/g.该MK产量与优化培养基的发酵产物中MK产量5.86 mg/g相比提高99.32%.
结合2.3.2的实验结果,筛选后以1%大豆异黄酮作为红曲菌ZWS5产MPs的适宜添加量。在纯大米、碎米和优化后的碎米等培养基中分别接种红曲菌ZWS5,探究培养基对红曲菌ZWS5产MPs能力的影响,结果如图8所示。
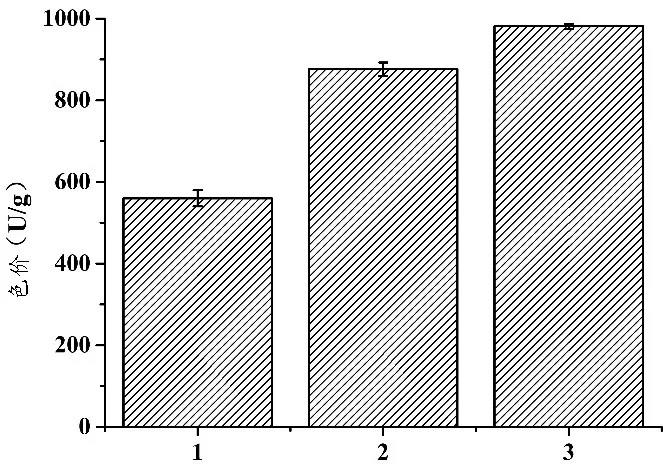
图8 培养基对红曲菌ZWS5产MPs的影响
由图8可知,红曲菌ZWS5在3种培养基中发酵14 d,红曲菌ZWS5发酵碎米优化培养基所得发酵产物中MPs产量最高,达到981.33 U/g.与红曲菌ZWS5发酵纯大米培养基所得发酵产物的色价560 U/g相比,提高75.24%.
以HPLC法分析MK含量时,采用酸式和内酯式MK标准溶液作为对照,计算红曲菌发酵产物中MK的含量。酸式及内酯式MK和红曲发酵产物提取液样品的色谱图如图9所示。

由图9可知,酸式MK和内酯式MK的出峰时间分别在11 min和21 min左右,红曲菌发酵产物中的MK主要以酸式和内酯式存在,且以酸式结构为主。但根据行业标准QB/T2847-2007,目前对红曲发酵产物中MK的定量,是以内酯式MK作为计算依据。对MK的检测过程中,应根据不同批次样品中MK的含量对样品进行适当的稀释或调整标准品的浓度,确保MK标准品的浓度与样品中MK的浓度尽量接近。
3 结论
将红曲菌ZWN2和ZWS5用于米糠及碎米的固态发酵产生MK或MPs,对其发酵工艺参数进行优化。1)红曲菌ZWN2发酵米糠产MK的适宜条件为:在米糠基础培养基中添加大豆分离蛋白,添加量为3%.调整培养基中水分、乙酸及MgSO4·7H2O含量分别为35%,0.6%(v/w)和0.004 mol/kg,控制种子液的接种量为13%(v/w).在30 ℃培养3 d,调整温度至25 ℃并继续培养至14 d.此时,红曲菌ZWN2发酵产物中MK含量达11.68 mg/g.2)ZWS5发酵碎米产MPs的适宜条件为:在碎米基础培养基中添加大豆异黄酮,添加量为1%.调整培养基中水分、乙酸、MgSO4·7H2O含量及接种量与米糠红曲相同。在30 ℃培养14 d,红曲菌ZWS5发酵产物的色价可达981.33 U/g.该研究结果可为后续进一步拓宽米糠和碎米的综合利用途径提供借鉴。
