基于MRI多参数联合对T3期直肠癌亚分期的诊断价值
2020-05-07许蕾邵瑞李红蕾王椋
许蕾, 邵瑞, 李红蕾, 王椋
结直肠癌的发病率在恶性肿瘤中位居第三位,约1/3起源于直肠[1]。美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)指南中,对T3期直肠癌推荐术前行新辅助放化疗(neoadjuvant chemoradiotherapy,NCRT),认为可以提高手术切除率和患者的无瘤生存率(disease free survival,DFS)。但在临床工作中,部分患者对NCRT不耐受,可发生骨髓抑制或神经、消化等诸多系统的严重不良反应。部分研究者认为当T3期直肠癌病变浸润深度超过固有肌层<5 mm,CRM阴性或无淋巴结转移时,行全直肠系膜切除术(total mesorectal excision,TME)后5年无病生存率可达85%,局部复发率仅为3%[2-3];特别是T3期直肠癌浸润深度<1 mm的患者与T2期患者预后一致[4-5]。因此,对T3期直肠癌患者尤其是NCRT不耐受患者,术前行精准影像预测肿瘤的亚分期具有重要的临床意义。直肠高分辨MRI及对比增强扫描可很好地显示病变的形态学特征,已常规应用于直肠肿瘤的术前诊断和分期。DWI反映的是组织细胞内水分子扩散功能,并通过ADC值的定量分析来反映组织内水分子扩散受限的程度。但是上述方法单独应用时,无论从病变的形态、MRI半定量或定量参数方面的研究均有一定局限性,本研究旨在通过优化组合MRI多序列获得多参数信息,探讨多参数MRI提高T3期直肠癌术前精准亚分期的诊断效能。
材料与方法
1.一般资料
将2015年01月-2018年06月在本院经手术病理证实为T3期直肠癌的52例患者纳入本次研究。其中男34例,女18例,年龄34~79岁,中位数58.1岁。纳入标准:①MRI扫描序列规范,包括直肠高分辨成像、动态增强T1WI及DWI;②TME术后经病理证实为T3期且有精准亚分期结果的直肠癌患者。排除标准:①MRI扫描序列不完整或图像伪影重,不能满足诊断要求;②术前进行了抗肿瘤的相关治疗;③有幽闭恐惧症者;④有碘对比剂过敏者;⑤肝肾功能不全患者。
2.检查方法
使用Siemens Trio TIM 3.0T超导MR扫描仪和体部相控阵专用线圈。患者取头先进、仰卧位,检查前未行肠道准备。扫描序列及参数如下。横轴面高分辨T2WI:TR 3800 ms,TE 95 ms,层厚3 mm,视野220 mm×100 mm,激励次数2;横轴面T1WI:TR 550 ms,TE 11 ms,层厚3 mm,激励次数2,视野220 mm×100 mm;横轴面单次激发EPI序列DWI:TR 3400 ms,TE 81 ms,层厚4 mm,视野234 mm×100 mm,激励次数10,扩散敏感系数b值50~1000 s/mm2;直肠DCE-MRI采用横轴面三维扰相快速梯度回波序列:TR 3.87 ms,TE 1.41 ms,层厚3 mm,视野250 mm×100 mm,翻转角10°,激励次数1。注射对比剂之前先行第1期扫描,随后应用高压注射器以2.0 mL/s的流率团注15 mL对比剂GD-DTPA,注射完毕后以相同流率注射等量生理盐水冲管;注入对比剂20 s后连续采集15期图像。
3.图像分析
所有数据传入Simense Syngo工作站,使用Mean-Curve软件进行图像后处理。在DCE-MR图像上,选择病灶最大层面,于瘤体内实性区域勾画ROI,避开坏死、囊变及血管区,即可生成时间-信号强度曲线(time-intensity curve,TIC),并进行半定量参数的测量;在横轴面高分辨T2WI上测量病灶的长径及周径;在DWI上选择病灶最大层面,观察病灶内扩散受限区域的累及范围。
由2位具有5年以上盆腔影像诊断经验的放射科医师共同阅片,测量分析并记录肿瘤的以下各项数据:①病变整体形态学指标(长径、周径);②壁外索条影的形态学特点(粗短型、细长型);③DWI病变扩散受限分布位置(壁内、壁外);④TIC曲线类型及半定量参数值,包括达峰时间(maximum enhancement time,Tmax)和早期强化率(early enhancement ratio,EER)。Tmax为TIC曲线上最大信号强度所对应的时间;EER的计算公式如下:
(1)
其中SIpost是动态增强第3期图像上病灶的信号强度,SIpre是平扫图像上病灶的信号强度。
4.统计学分析
使用SPSS 17.0软件进行统计分析。以病理结果为金标准,按照肿瘤浸润超出固有肌层的深度分为T3Ⅰ组(<5 mm)和T3Ⅱ组(≥5 mm)。采用χ2检验比较两组病变的瘤体形态特征、壁外索条影的形态特征、TIC曲线类型、DWI上扩散受限区的分布等指标的差异。采用两独立样本t检验比较两组病变的DCE半定量参数间(Tmax和EER)的差异。建立Logisitc回归模型,以病理结果为应变量,自变量采用组间差异具有统计学意义的指标,构建联合参数模型并评价其诊断效能。以P<0.05为差异具有统计学意义。
结 果
1.MRI各参数比较
不同亚分期T3期直肠癌的各项MRI参数/征象的比较见表1。T3Ⅰ组中壁外索条影以细长型多见,DWI上扩散受限区主要累及直肠壁内(图1);T3Ⅱ组中壁外索条影以粗短型多见,DWI上扩散受限区多累及至直肠壁外(图2)。两组间病变周径、壁外索条形态学、DWI扩散受限区的分布这3项特征的差异具有统计学意义(P<0.05);而两组间病变长径和TIC曲线类型的差异无统计学意义(P>0.05)。
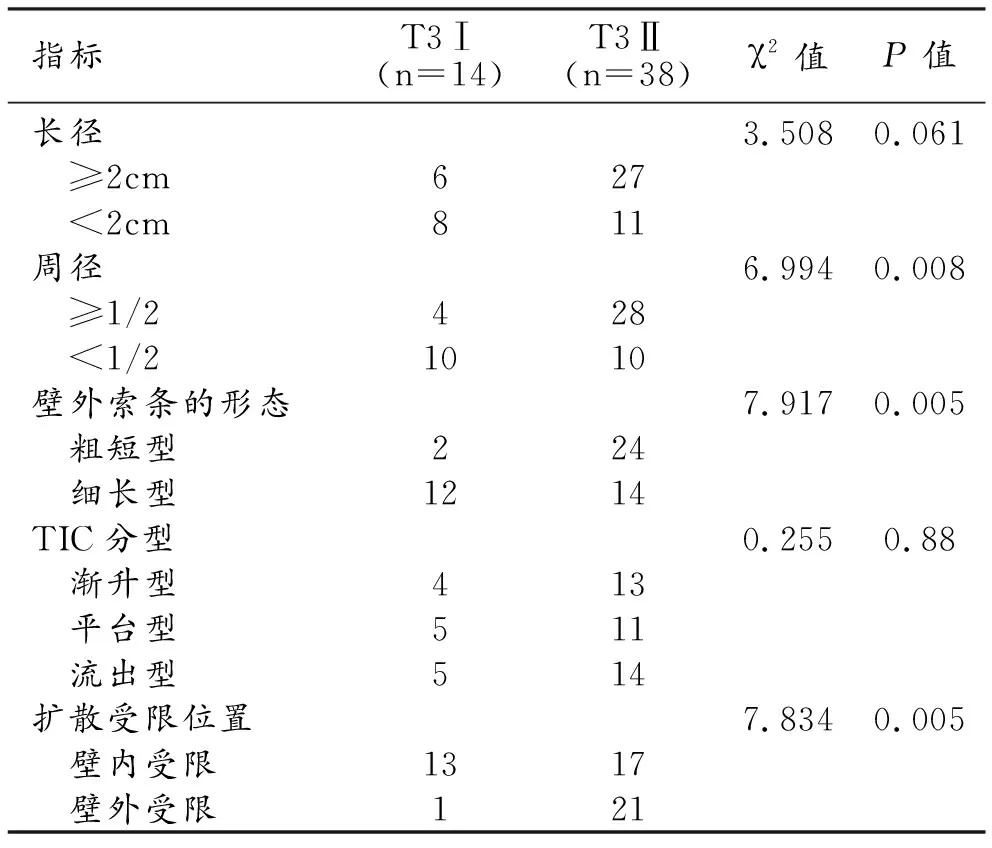
表1 两组中各项MRI参数/特征的比较 (例)
两组病变的半定量参数测量结果及组间比较见表2。两组间EER值的差异具有统计学意义(P<0.05),Tmax值的差异无统计学意义(P>0.05)。

表2 直肠癌T3亚分期半定量参数比较
2.各项MRI参数联合诊断效能
将组间差异有统计学意义的参数逐步构建联合诊断方程,其诊断效能指标见表3。其中,以病变周径+壁外索条形态+DWI上扩散受限区的分布+EER四项参数联合诊断的约登指数最高,达0.732,ROC曲线下面积(Az)为0.887(95% CI:0.847~0.912),相应的诊断敏感度及特异度分别为85.24%和87.34%。

表3 各参数联合对T3期直肠癌亚分期的诊断效能指标
讨 论
1.MRI各项参数对T3期直肠癌亚分期的诊断效能
MRI是目前结直肠癌术前分期的重要检查方法,在肿瘤的定位诊断、判断肿瘤浸润深度、决定切除范围等方面准确性较高。NCCN指南中推荐对T3期直肠癌患者行NCRT,认为该方法可有效控制局部复发及转移。但临床工作中发现部分患者对NCRT不能耐受,是否所有T3期直肠癌患者都适于行NCRT尚存在争议。部分研究者认为T3期直肠癌浸润深度对患者的预后和术前治疗方案选择存在较大的差异,浸润深度超过固有肌层<5 mm、环周切缘(circumferential resection margin,CRM)阴性或无淋巴结转移时,TME术后5年无病生存率及局部复发率分别为85%及3%[2-3]。因此,对T3期直肠癌患者尤其是不能耐受NCRT的患者进行精准的亚分期评估具有十分重要的临床意义。根据肿瘤浸润深度,RSNA将T3期直肠癌分为3个亚分期:<5 mm为T3a,5~10 mm为T3b,>10 mm为T3c。本研究中重点关注浸润深度<5 mm的肿瘤,因此仅将患者分为T3Ⅰ(T3a)和T3Ⅱ(T3b+T3c)两组。
T3期的诊断标准为肿瘤穿透固有肌层达周围直肠系膜,测量肿瘤在直肠系膜内的浸润深度是亚分期的诊断标准。正确判断直肠系膜内的MRI表现是肿瘤浸润还是炎性纤维化增生、炎性扩张血管等非肿瘤浸润性表现也是亚分期诊断中的难点及关键所在。高分辨T2WI上有可能将T3Ⅰ组肿瘤周围直肠系膜内的炎性纤维化增生、炎性扩张血管误认为是肿瘤浸润而导致分期过度。谢伟等[6]通过研究直肠系膜内壁外索条的边缘及强化方式来进行两者的鉴别,癌性索条边缘欠光滑且无或仅为轻度强化,非癌性索条影边缘多比较光滑且通常有明显强化。本研究在既往研究的基础上,进一步将壁外索条的形态进行分类,结果显示粗短型索条且边缘毛糙时提示肿瘤浸润的可能性更大;细长型索条且边缘光滑、向远端移行似“鼠尾状”时,则多提示为炎性纤维化或扩张血管影。笔者分析造成两者形态学差异的病理基础是肿瘤细胞生长速度快慢不一,周围直肠系膜以疏松脂肪结缔组织为主,肿瘤细胞更容易向周围组织扩散浸润生长,部分成“土豆芽”状;而炎性纤维化则是纤维组织细胞过度增生并伴有炎性细胞的沉积,走行相对规则、细长。T3Ⅰ组由于肿瘤浸润深度仅在5mm之内,部分患者显示欠清或不确切时,可通过分析肿瘤的整体形态学指标来进行亚分期的判断。既往有研者究认为肿瘤侵犯直肠周径的程度与病理T分期之间呈正相关[7-8],但目前尚未见对肿瘤亚分期进行评估的相关研究。本研究结果显示,以侵犯直肠周径1/2为界,T3Ⅰ组与T3Ⅱ组间的差异具有显著统计学意义,提示肿瘤侵犯直肠周径的范围对判定T3期直肠癌亚分期有一定价值。
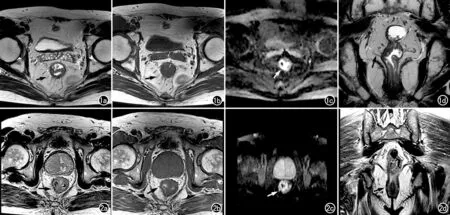
图1 患者,男,57岁,直肠中分化腺癌T3a期。a)横轴面T2WI示直肠癌邻近的直肠壁外可见索条影,边缘光滑,呈细长型(箭); b)横轴面T1WI示壁外索条呈“鼠尾状”向远端移行(箭); c)横轴面DWI示病变扩散受限区仅累及直肠壁内(箭);d)冠状面T2WI示病变右侧直肠系膜内壁外索条形态影呈细长型(箭)。图2 患者,男,74岁,直肠中分化腺癌T3b 期。a)横轴面T2WI示直肠癌邻近直肠壁外可见索条影,边缘毛糙,呈粗短型(箭);b)横轴面T1WI示壁外索条呈“土豆芽状”(箭); c)横轴面DWI示病变扩散受限区已经累及至直肠壁外(箭);d)冠状面T2WI示病变邻近的右侧直肠系膜内可见壁外索条影呈粗短型(箭)。
DWI通过检测水分子的微观运动来反映病理状态下各组织成分中水分子的功能变化,直肠癌病灶内肿瘤细胞增殖活跃、核浆比例高和细胞外间隙水分减少等特点,使得其在DWI上表现为扩散受限,ADC值下降。既往有研究结果显示,高分辨力DWI-读出方向分段采样平面回波成像(readout segmentation of long variable echo-trains,RESOLVE)序列对于术前判断直肠癌是否突破固有肌层即T2期和T3期的鉴别具有较高的参考价值[9]。本研究中则进一步分析DWI上扩散受限的位置分布,结果显示扩散受限的位置分布与肿瘤浸润范围密切相关,当DWI上扩散受限区域仅位于直肠壁内时,高度提示亚分期为T3Ⅰ。唯一不足的是DWI图像容易受磁场不均匀性的影响,图像上出现变形的比例较高,因此测量病变的ADC值得到定量结果来进行分析的效果并不确定,因此未纳入本次研究中。
DCE-MRI可以通过TIC曲线及EER、Tmax等参数来评价肿瘤的血管生成情况,从而有利于良恶性直肠肿瘤的鉴别[9-10]。本研究结果显示,针对T3亚分期TIC曲线类型的鉴别诊断价值不大。DCE-MRI半定量参数与肿瘤浸润范围之间密切相关,EER和Tmax主要反映了对比剂在注射后在病变区的渗透速度、微血管密度和血管通透性的情况,肿瘤的组织学分级与半定量参数间呈正相关[11-13]。反映肿瘤血管生成情况的微血管计数(microvessel calculation,MVC)与EER具有显著相关性,而微血管面积(microvessle area,MVA)与Tmax之间具有显著相关性。本研究结果显示,EER在两组间的差异具有统计学意义,而Tmax的组间差异则无统计学意义。笔者认为两组中肿瘤血管异常增殖速度均明显增加,故EER值均表现为明显升高,但随着亚分期的递增,肿瘤存在大量动静脉瘘且MVA逐渐增高,能反映肿瘤MVA指标的EER显示出两者的差异性。
2.多参数优化组合的诊断效能
直肠高分辨MRI及DCE-MRI检查作为直肠癌术前分期的主要影像检查方法已广泛应用于临床,但其对直肠癌术前分期的准确性仍有不足[14-15]。DWI通过测量ADC值可区分肿瘤和非肿瘤病灶,但ADC值测量受诸多因素的影响,故单独应用DWI仍具有局限性。为了避免单一指标的局限性,有必要合理利用、整合多项参数对病变进行诊断。Logistic回归分析可以在某一敏感度下获得最大的特异度,也能在某一特异度下获得最大的敏感度,从而可获得最大ROC曲线下面积。本研究结果显示新构建的联合诊断方程中,以病变周径+壁外索条的形态+DWI扩散受限分布位置+EER四项参数联合诊断的约登指数最高,为0.73,ROC曲线下面积为0.887(95% CI:0.847~0.912),诊断敏感度及特异度分别为85.24%和87.34%。
3.本研究的局限性
本研究的局限性:样本量偏少,有待于今后扩大样本量进一步对MRI在T3期直肠癌亚分期诊断中的效能指标进行深入探讨;在今后的研究中可考虑引入定量参数如容量转运常数(Ktrans)、速率常数(Kep)、血管外细胞外间隙容积百分比(Ve)等定量参数。
综上所述,MRI多参数联合诊断可提高对T3期直肠癌亚分期的诊断价值。
