外源生长素对杜梨组培不定芽生根及相关氧化酶的影响
2020-05-06罗嘉亮郝瑞杰李六林
罗嘉亮,李 凡,郝瑞杰,李六林
(山西农业大学 园艺学院,山西 晋中 030801)
杜梨Pyrus betulaefoliaBunge适应性强,因其与梨树嫁接亲和力强,已成为我国北方梨产区梨树的主要砧木。目前杜梨繁育以种子繁殖为主,但由于后代变异多,易造成嫁接品种树势、抗逆性等方面的差异较大,给梨园的统一管理带来了难度。组织培养是快速获得基因型一致的梨砧木繁育关键方法之一[1]。而提高组培砧木的移栽成活率,获得健壮根系是杜梨组培工作中的重要一步,因此,展开组培杜梨根系的相关研究尤其重要。
生长素是植物不定根诱导与发育过程中的关键影响因素[2]。已有研究结果表明,吲哚乙酸(IAA)、吲哚丁酸(IBA)、萘乙酸(NAA)等对根系发育都有调节作用[3],但生长素的种类和浓度对不同品种树种的作用效果存在较大差异。周新华等[4]研究发现,诱导多花黄精生根的能力,NAA强于IBA和IAA,且在一定的浓度范围内,随着NAA浓度的增加,其诱导能力也不断加强。杨光等[5]在对2种无性系柚木的扦插试验中发现,IAA处理的生根诱导效果最佳,其生根率、根生物量、叶面积和株高均高(大)于IBA和NAA处理的。卜祥潘等[6]则认为,IBA更适用于火焰卫矛不定芽的生根诱导。
以生长素诱导植物体不定根的发生,与氧化酶活性的变化密切相关。姜宗庆等人[7]的研究结果表明,过氧化物酶(POD)活性在生根前期快速上升则有利于插穗基部愈伤组织的形成,而超氧化物歧化酶(SOD)活性在整个生根过程中均处于较高状态,这对植株能起到保护作用。扈红军等[8]研究发现,在以IBA诱导桑树不定根的形成过程中,多酚氧化酶(PPO)活性在诱导期和表达期均升高,而吲哚乙酸氧化酶(IAAO)仅在表达期具有较高的活性因而更利于不定根的形成。目前,有关不同生长素对杜梨生根及根系形成过程中酶活性变化情况的研究还未见系统报道。因此,本研究以杜梨不定芽为试验材料,通过测定相关生根指标筛选外源生长素的种类,并通过观察生根过程中茎段基部组织内外形态结构的变化,以明确不定根发生的类型与部位,进一步了解该生长素诱导不定根形成过程中酶活性的变化规律,以期为杜梨等难生根植物的生根研究提供理论指导和技术借鉴。
1 材料与方法
1.1 试验材料
供试树种为杜梨,于2017年5月采自山西省农业科学院果树研究所梨资源圃,并在山西农业大学梨原种保存与扩繁基地进行了10代的连续继代培养。
1.2 试验设计
选取生长一致、健壮的杜梨不定芽,将其接种于1/2MS+生长素+6 g·L-1的琼脂+20 g·L-1的蔗糖培养基上,分别选用IAA、IBA、NAA这3种外源生长素,每种生长素设4个浓度(0.1、0.5、1.0、2.0 mg·L-1)处理,以清水为对照(CK),每个处理接种30株,重复3次。在光照培养室内进行培养,培养30 d后统计生根指标。培养条件:温度控制在25 ℃左右,光照16 h、黑暗8 h,光强为 2 000~3 000 lx。
1.3 生根指标的测定
杜梨不定芽生根培养30 d后测定各处理的生根率、平均根数、平均根长和生根指数、愈伤组织级数(参考刘永富的分级标准[9]进行分级),其计算公式分别如下:
生根率(%)=生根苗数/接种时总苗数×100%;
平均根数(条·株-1)=生根总数/接种时总苗数;
平均根长(cm)=生根总根长(cm)/生根总条数;
生根指数=生根率×平均生根数×平均根长。
在0.5 mg·L-1的IBA处理组开始进行生根培养后,每隔4 d随机取样,观察茎段基部形态,制作石蜡切片,并将部分茎段基部剪碎后充分混匀,称取样品0.5 g,置于液氮中速冻,保存于-80 ℃的冰箱中以备后续相关酶活性测定之用。
IAAO、PPO、SOD、POD活性的测定,分别参照高俊凤[10]、卢绪娟等[11]、王学奎[12]、李合生[13]的方法(略作修改)进行。
使用Nikon SMZ18正置体视显微镜拍照,记录不同时期茎段基部外部形态变化情况,参照侯福林[14]的方法制作石蜡切片,使用Nikon NI-U正置显微镜观察和拍照。
1.4 数据处理
使用Microsoft Excel 2013软件进行数据处理和作图,使用SAS 9.0软件进行数据统计和分析。
2 结果与分析
2.1 外源生长素对杜梨不定芽不定根发生的影响
外源生长素对杜梨不定芽不定根发生的影响情况见表1,杜梨不定芽生根诱导愈伤组织的观察结果如图1所示。由表1可知,杜梨不定芽不定根经不同浓度的NAA、IBA和IAA诱导,其生根率、平均根数、平均根长、生根指数和愈伤组织级数均存在显著差异。在同一种生长素处理下,浓度分别为0.1和2.0 mg·L-1的处理组的各项生根指标均显著低于其余2个浓度处理组;对照组不定芽的生根率为0。同在NAA和IBA的处理下,质量浓度分别为0.5和1.0 mg·L-1的生根率无显著性差异,但都显著高于质量浓度分别为0.1和2.0 mg·L-1的处理组。在1.0 mg·L-1的NAA 处理下,其生根率为45.23%,低于0.5 mg·L-1的NAA处理的47.73%,除此之外,其平均根数、平均根长、生根指数分别为2.47条·株-1、2.4 cm、2.66,均高于其他处理,但其愈伤组织的级数为3~4级,其愈伤组织松软易脱落,故不利于后期移栽成活。在不同浓度的IBA处理下,浓度分别为0.5和 1.0 mg·L-1的处理组的生根率分别高达66.70%和67.20%,其平均生根数皆为2.37条·株-1,其平均根长分别为1.83和1.80 cm,其生根指数分别为2.88和2.86,其愈伤组织级数分别为1和2级。当IAA的浓度分别为0.5、1.0和2.0 mg·L-1时,其生根率、平均根数、平均根长和生根指数的差异均不显著,其愈伤组织级数分别为1、1~2和3级。

表1 外源生长素对杜梨不定芽不定根发生的影响†Table 1 Effects of exogenous auxins on adventitious root formation in P.betulifolia adventitious buds
2.2 杜梨不定芽在生根过程中的外部形态与组织学观察结果
在IBA诱导杜梨不定芽生根的过程中其外部形态与组织学的观察结果如图2所示。从图2a和e中可以看出,在不定芽生根诱导0 d时,未经诱导的不定芽基部颜色为绿色,观察其组织学切片可知,其内部由外到内可分为表皮、皮层、韧皮部、维管束形成层和髓,茎段基部未发现有潜伏根原基,不定根原基属于诱生根原基类型。经外源 0.5 mg·L-1的IBA诱导4 d后,茎基部颜色变红,局部膨大,图2b和f显示,形成层与韧皮部的细胞分裂旺盛,开始诱导球状根原基细胞。当不定芽生根诱导8 d时,其基部出现愈伤组织,图2c和g显示,“个”状根原基基本形成,并向外生长。当不定芽生根诱导12 d后,图2d和h显示,其不定根突破表皮或愈伤组织而露出茎外。
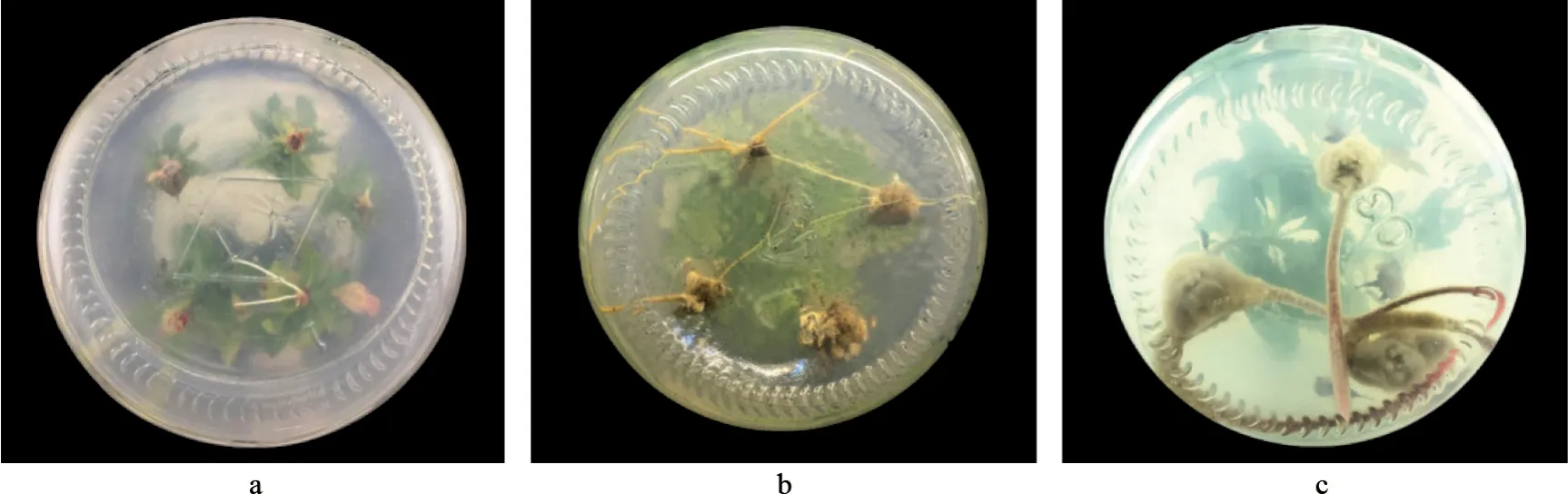
图1 杜梨不定芽生根诱导愈伤组织的观察结果Fig.1 Observation results of induced calli during adventitious bud rooting of P.betulifolia.
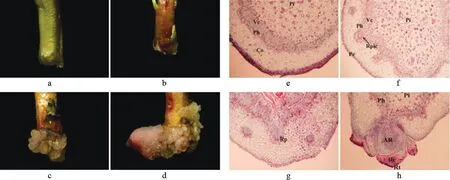
图2 以IBA诱导杜梨不定芽生根过程中其外部形态与组织学的观察结果Fig.2 External morphology and histological observation results of induced rooting process from P.betulifolia adventitious buds by IBA
2.3 外源生长素对杜梨不定芽生根过程中相关酶活性的影响
2.3.1 PPO活性的变化
杜梨不定芽生根过程中相关酶活性的变化情况如图3所示。由图3可知,杜梨不定芽的PPO活性随IBA生根剂诱导时间的推移呈现上升→下降→上升的变化趋势。处理组不定芽的PPO活性在生根诱导开始即迅速上升,诱导4 d后达到峰值,在诱导4~12 d中持续下降直至最低值,随后缓慢上升;对照组不定芽的PPO活性在生根诱导开始便缓慢上升,诱导8 d后达到峰值,在随后的8~16 d中持续降低。总的来看,添加外源IBA有利于提高生根诱导4 d时不定芽的PPO活性,诱导后期(8~16 d)PPO的活性,处理组均低于对照组。
2.3.2 IAAO活性的变化
处理组不定芽的IAAO活性随着不定根诱导时间的推移呈现先下降后上升的变化趋势。在杜梨生根过程中,不定芽的IAAO活性,处理组始终低于同期对照组。处理组不定芽的IAAO活性,在诱导0~8 d时迅速下降,尤其在诱导0~4 d时其下降幅度最大,在随后的8~12 d中持续上升,并在12~16 d时保持相对稳定的水平。对照组不定芽的IAAO活性呈现出先升后降的趋势,在诱导8 d时达到峰值。
2.3.3 POD活性的变化
杜梨不定芽生根过程中,处理组不定芽的POD活性随诱导天数的增加而呈现出上升→下 降→上升→下降的变化趋势,在诱导4和12 d时分别出现第1个和第2个峰值。而对照组不定芽的POD活性只在生根诱导8 d时出现了1个峰值。与对照组的相比,IBA处理组不定芽的POD活性在生根诱导前期(0~8 d)有所提高。
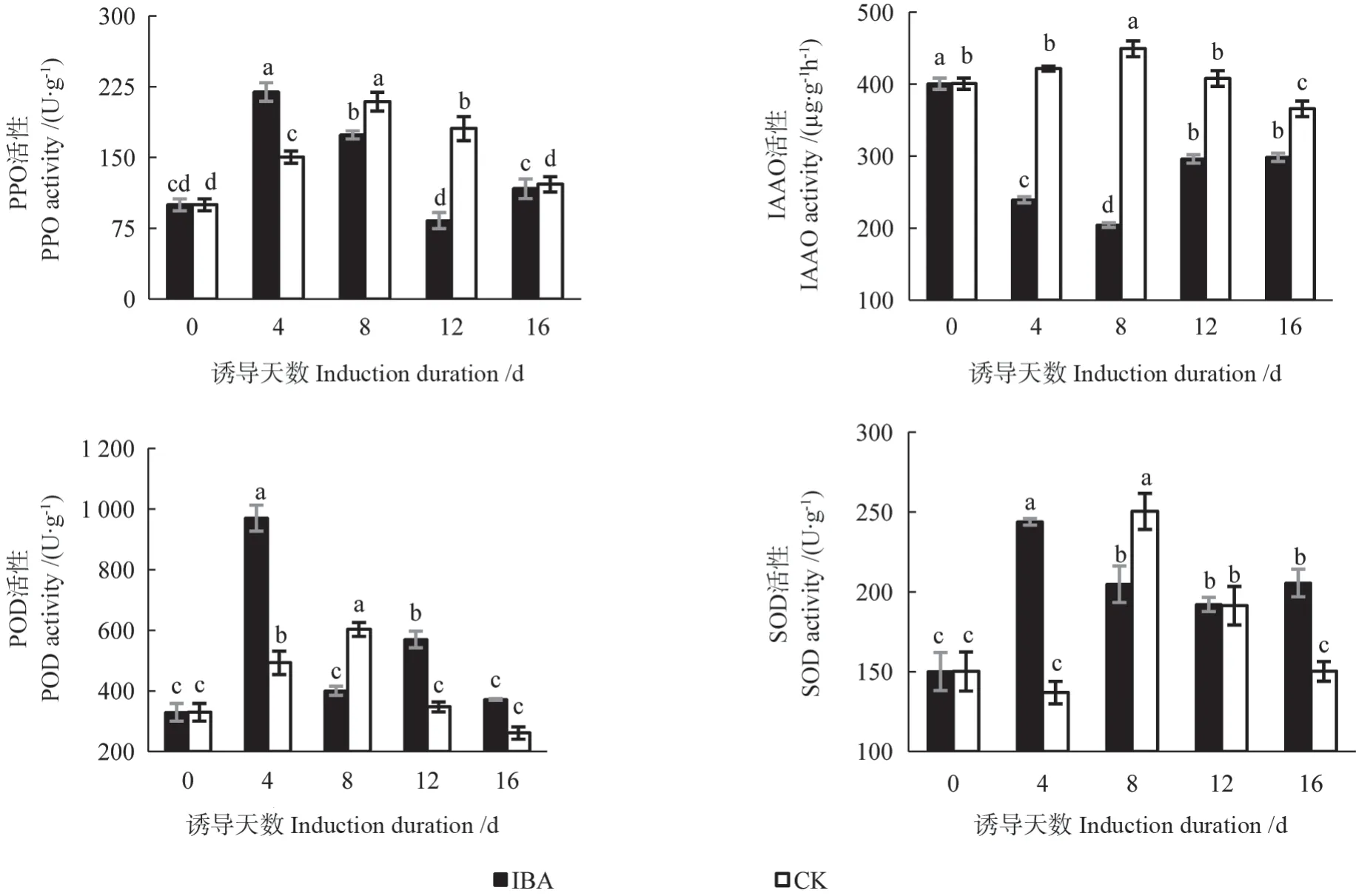
图3 杜梨不定芽生根过程中相关酶活性的变化情况Fig.3 Changes of related enzyme activities in rooting process of P.betulifolia adventitious buds
2.3.4 SOD活性的变化
处理组不定芽的SOD活性随着生根诱导天数的增加总体呈现先升高后降低的变化趋势,在生根诱导后迅速上升,诱导4 d后即达到峰值,随后缓慢下降。对照组不定芽的SOD活性则呈现出下降→上升→下降的变化趋势,在诱导0~4 d内缓慢下降,随后迅速上升,在诱导8 d时达到峰值,诱导8~16 d内持续下降。
3 结论与讨论
外源生长素处理可以通过调节内源生长素水平来调节植物体细胞分裂与生长速度,从而促进不定根原基的形成[15]。在组培快繁中,多采用NAA、IBA和IAA进行不定根的诱导。在火焰卫矛不定芽生根培养基中只添加IBA时,其生根数和平均根长均达到最大值[6]。本研究采用3种生长素诱导杜梨不定芽生根的试验结果表明,IBA的生根诱导效果最佳,这与有关研究者对火焰卫矛、巴西梨品种Pyrus betulaefolia[16]的研究结果均类似。杨超臣等[17]研究发现,在生根培养基中添加0.1或0.5 mg·L-1的NAA时,植株基部产生大量的愈伤组织。刘永富[9]研究发现,NAA可使植株茎基部产生较大的愈伤组织,但不利于其移栽成活。以相同浓度的NAA与IBA处理的生根指数无显著性差异,但以NAA诱导的生根率较低,愈伤组织较大,阻碍了不定根的生长,这与上述的研究结果也都一致;但胡勐鸿[18]认为,NAA可抑制愈伤组织的形成,低浓度的NAA可促进欧洲云杉的生根。前人的研究结果都表明,IAA被基部吸收后性质不稳定,释放较多游离的IAA,易被氧化酶氧化,其作用持续的时间短[19],这可能是IAA在上述3种生长素处理中诱导效果最差的主要原因。研究中发现,不同植物对IBA诱导生根所需最适浓度不尽相同[20],本研究结果表明,质量浓度为0.5 mg·L-1的IBA更利于杜梨不定根的诱导。不同激素配比可能更利于植株生根,后续研究应使用IBA与NAA或IAA进行不同浓度的配比试验,以全面提高杜梨不定芽的生根率。
根原基可划分为潜伏根原基和诱导根原基两种,诱导根原基的植物多为难生根树种,需要一定的外源激素诱导才能形成不定根[21]。核桃属于难生根植物,当其受到激素诱导后,插穗形成层和韧皮部的交叉区域的细胞分裂旺盛,逐渐形成不定根原基[22]。马俊红等[23]研究发现,苹果生根类型属于诱生原基,其不定根形成过程可分为3个时期。本研究切片观察杜梨茎基部后未发现潜伏根原基,因此杜梨不定根发生属于诱导根原基,据此可以解释清水处理下未能诱导出不定根的原因。杜梨不定根起源于韧皮部与形成层的交界处,其发育过程可分为根原基的诱导、根原基的形成和不定根的伸长,这与刘昊[22]和马俊红等[23]的研究结果均类似。
酚氧化酶(PPO)是一种含铜的酚类氧化酶,将酚类物质和IAA的混合液在PPO作用下,酚类物质完全消失,IAA含量降低,在高效液相色谱上检查出3个新物质色谱峰[24]。这类新物质为“IAA-酚酸”化合物,是一种有助于促进不定根发生的辅助因子,对植物生根具有重要调节作用[25]。本研究发现,在生根诱导前期,IBA处理有利于不定芽PPO活性持续快速上升,合成更多的生根辅助因子,从而促进不定根原基的诱导。本研究与葡萄[26]扦插生根同样发现,在生根后期PPO活性呈现下降的趋势,推测随着时间的推进,不定芽体内酚类物质含量降低,PPO活性随之降低。
吲哚乙酸氧化酶(IAAO)是一种能够降解IAA的氧化酶,能够调节植物体内IAA的含量,从而影响不定根的启动与形成[21]。本研究结果表明,杜梨不定芽生根过程中IAAO活性在诱导0~8 d时下降至较低水平,有利于提高植物内源IAA浓度,从而促进不定根的诱导与形成,而在生根后期(诱导8~16 d),IAAO活性上升有利于降低内源IAA含量,从而促进不定根的表达与伸长,这与牡丹[27]和樱桃矮化砧[28]的试验结果一致。但在欧榛[8]和国槐[29]的扦插生根试验中发现,在生根诱导前期,IAAO活性升高,降低内源IAA浓度,有利于不定根的诱导,而在生根诱导后期,IAAO活性降低,提高内源IAA的含量则有利于不定根的生长。这可能是由不同植物体之间生根所需生长素含量差异造成的。
前人研究发现,在桉树Eucalyptus[30]和沙生柽柳[31]生根过程中POD活性会出现两个峰值,本试验研究中同样发现,在生根诱导过程中,POD分别在诱导4和12 d时出现峰值,且其活性均显著高于对照组,这可能与不定根原基诱导和不定根伸长均有关。但也有研究者发现,在桑树[32]扦插生根过程中,POD活性只出现了单峰变化趋势。杜梨组织中富含多酚等次生代谢物质[33],在酚类物质存在的条件下,POD参与生长素的代谢和细胞壁的木质化[34],这可能是IBA处理提高POD活性从而促进生根的原因。
SOD与植物抗逆密切相关,反映了植物抗氧化与自身修复能力。有关研究结果表明,高活性SOD可以减少自由基对植株的伤害[35],本试验结果显示,外源IBA处理显著提升生根诱导前期(诱导4 d)SOD活性,这可能是提高不定根诱导的成活率关键因素。SOD活性在整个生根诱导过程中呈现先升后降的趋势。在生根诱导0~4 d时,不定芽脱离母株,植株处于逆境胁迫中,SOD活性迅速上升,不定芽基部得以保护,有利于细胞分裂,不定根原基的诱导;而在诱导8 d时,愈伤组织出现并对茎基部起到保护作用;诱导12 d后,不定根开始向表皮外伸长,不定芽长成完整植株,其抗逆能力增强。因此,诱导8~16 d时,SOD活性处于下降水平,这与柃木[36]和薄壳山核桃[7]的研究结果一致。上述4种氧化酶主要通过调节内源激素水平,从而影响不定根的发生,后续研究应测定内源激素含量,分析酶如何调节激素来影响生根,并结合不定根发育过程的转录组学,深入揭示杜梨不定根发生的分子机理。
综上所述,外源IBA对杜梨不定芽不定根发生效果最好,当其浓度为0.5 mg·L-1时,各项生根指标均较理想,且愈伤组织较小,有利于后期的移栽成活。不定根发生属于诱生根原基,起源于韧皮部和维管束形成层的交界处,其发生过程包含三个时期。IBA处理改变了不定根诱导过程中PPO、IAAO、POD、SOD的活性,其共同作用影响着不定根的诱导与生长。
