还原型谷胱甘肽在AG129小鼠生物净化及快速繁殖中的应用
2020-05-06张帆安学芳赵赫李丽肖宇宙
张帆,安学芳,赵赫,李丽,肖宇宙
(中国科学院武汉病毒研究所, 武汉 430071)
还原型谷胱甘肽(GSH)是一种具有重要生理功能的三肽硫醇,在哺乳动物细胞中发挥十分重要的生物活性作用[1]。这种化合物是许多酶反应的辅基,是机体内重要的抗氧化剂和自由基清除剂,保护细胞膜中含巯基的蛋白质和含巯基酶不被破坏[2]。目前普遍认为,雄性动物的精清中的氧自由基过多会导致不育,削弱精子谷胱甘肽转移酶活性,可直接导致精子质膜损伤,使精子运动能力、顶体反应及受精能力降低甚至消失[3]。
研究表明,在小鼠卵母细胞玻璃化冷冻过程中,在培养液中加入一定量的GSH,可以一定程度改善卵母细胞活性[4],同时,在精子复苏液中加入一定量GSH可以明显提高牛、羊等家畜冻存精子的活力、形态及遗传物质的完整性[5]。
AG129小鼠是I型和II型干扰素受体缺失基因敲除动物品系,对寨卡病毒、登革病毒、肠道病毒等多种病毒易感[6-8],是较为理想的病毒易感动物模型。但是,该品系小鼠在饲养过程中,表现出较明显的繁殖障碍,每胎产仔数量低,无法快速获得足够数量动物,成为相关科学研究的瓶颈。在体外受精实验中,使用常规试剂获得可移植的两细胞胚胎效率极低。笔者通过在精子获能液和受精液中加入GSH,并探索调整GSH的最佳浓度,成功对AG129小鼠完成体外受精并胚胎移植,为相关体外受精困难品系小鼠的生物净化、快速扩繁提供思路。
1 材料与方法
1.1 材料
1.1.1 实验动物
SPF级AG129小鼠(雌性4周龄80只、雄性12周龄12只)由中国科学院武汉病毒研究所实验动物中心保存,品系引自中国科学院上海药物研究所【SCXK(沪)2015-0004】,SPF级ICR小鼠(雌性8周龄9只)购自北京维通利华实验动物技术有限公司【SCXK(京)2016-0006】。所有动物均饲养在SPF级屏障环境IVC笼盒中【SYXK(鄂)2019-0034】,所有动物自由采食和饮水。所有操作均符合中国科学院武汉病毒研究所动物实验伦理要求,满足3R原则(IACUC审批号:WIVA30201902)。
1.1.2 主要试剂与仪器
PMSG、HCG购自宁波三生生物科技有限公司;HTF(Cosmobio CSR-R-B070)、KSOM(Cosmobio CSR-R-B074)购自日本Cosmo Bio公司;2,2,2-三溴乙醇(Sigma T48402)、叔戊醇(Sigma 152463)、GSH(Sigma BD8612)、M2培养基(Sigma M7167)、矿物油(Sigma M5310)购自西格玛奥德里奇贸易有限公司。
体视显微镜(Motic)、二氧化碳培养箱(Thermo)、小动物体温维持仪(瑞沃德)、超净工作台(苏净安泰)。
1.2 方法
1.2.1 麻醉剂的配置与使用
在超净工作台中将5 g 2,2,2-三溴乙醇用3.1 mL叔戊醇溶解,待充分溶解后取0.5 mL溶液加入39.5 mL生理盐水中,充分混合后过滤待用,配置完成的麻醉剂需避光保存,小鼠麻醉时按照20 μL/g腹腔注射使用,实验中所有对活体小鼠的手术操作均在动物麻醉状态下开展。
1.2.2 GSH溶液的配置
在超净工作台中使用HTF将GSH粉末溶解,分别配置终浓度为0、0.5、1、2 mmol/L的GSH溶液。
1.2.3 雌鼠超排及取卵
将每只AG129雌鼠腹腔注射PMSG 10IU,48 h后腹腔注射HCG 10 IU,每个GSH浓度组超排5只AG129小鼠,3次平行。注射HCG 15 h后处死超排小鼠,手术取雌鼠输卵管,将输卵管在无菌滤纸上短暂放置去除表面血液后,放入提前在37℃ 5% CO2中平衡好的HTF受精滴油相中。用显微镊固定输卵管,用解剖针将输卵管膨大部刺破后,被卵丘细胞包裹的卵细胞溢出,用显微镊将其拖入HTF培养液中,放入二氧化碳培养箱内。
1.2.4 雄鼠精子采集
将AG129雄鼠处死后,手术取附睾尾,将附睾尾在无菌滤纸上短暂放置去除表面血液,用显微镊将附着的脂肪组织去除后,放入提前在37℃ 5% CO2中平衡好的HTF获能滴油相中。用显微镊固定附睾尾,用显微剪切开尾部中央的附睾管,显微镊轻压附睾尾,使精子从切口处流出。迅速用显微镊将流出的精子拖入HTF获能滴中,放入二氧化碳培养箱培养30 min,使精子获能。
1.2.5 体外受精
在体视显微镜下观察精子浓度,使用移液器轻柔沿边缘吸取4 ~ 6 μL精子悬浊液注射入含有卵子的HTF受精滴中进行受精,将受精滴放入二氧化碳培养箱中进行培养。受精6 h后,将卵子移入提前在37℃ 5% CO2中平衡好的KSOM液滴中继续培养。
1.2.6 移植受体准备
将受体ICR雌鼠与ICR结扎雄鼠1∶1合笼,第2日检查阴道栓,有阴道栓的可作为胚胎移植的受体动物。
1.2.7 早期胚胎形态学观察及统计
受精24 ~ 28 h后,对受精卵进行镜检,对2细胞胚胎、未受精卵、异常卵进行统计。
1.2.8 2细胞胚胎收集
使用移卵针将形态完好的2细胞胚胎移入提前准备好的M2培养基中,反复清洗3次后放入二氧化碳培养箱内待移植。
1.2.9 胚胎移植
将受体ICR小鼠麻醉后剃除背部左右两侧被毛,并用75%酒精消毒。在卵巢脂肪垫部位皮肤纵向剪开一切口,分离皮肤与肌肉,再将相应部位肌肉剪开,拉出脂肪垫,卵巢、输卵管及子宫可一并牵引出。用脂肪夹夹住脂肪垫,在体视显微镜下调整输卵管位置,找到输卵管膨大部,用滤纸在待移植部位做好标记。用维纳斯剪刀在输卵管伞口与膨大部间剪一小口,将移植针沿开口朝膨大部方向插入,小心将15枚每胎移入输卵管内,以输卵管中可见指示气泡作为移植成功标志。移植后将脂肪垫、卵巢及输卵管小心还纳回腹腔,缝合肌肉层和皮肤层,完成单侧移植操作,使用相同方法将15枚胚胎移入另外一侧输卵管中。移植完成小鼠放在小动物体温维持仪上30 min,待苏醒后转入IVC笼盒内单独饲养。
1.3 统计学分析
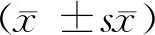
2 结果
2.1 AG129小鼠体外受精添加GSH试验结果
由表1可见,不同GSH浓度组平均受精率差异具有显著性(P< 0.05)。在精子获能及受精过程中,HTF中不添加GSH时,AG129小鼠体外受精率为(2.30 ± 0.73)%。添加0.5 mmol/L GSH时,两细胞胚胎数量有所增加,受精率为(20.44 ± 0.15)%。添加1 mmol/L GSH时,两细胞数量进一步增加,受精率达到(43.35 ± 1.76)%。添加2 mmol/L GSH时,两细胞数量有所下降,受精率为(31.77 ± 1.42)%,同时,异常卵数明显增加,主要表现为多个精子头部钻入卵细胞透明带,胚胎呈“毛球”状(见图1),使卵细胞无法正常完成受精,最终发育为未受精卵、畸形卵或者死亡(见图2)。

表1 AG129小鼠体外受精结果Table 1 In vitro fertilization results of AG129 mice
注:同一列中数字后字母不同者,差异具有显著性。
Note. Pairwise comparison, the differences are significant.
2.2 移植产仔率分析
由表2可见,将相同数量的胚胎移植受体,均获得了较理想的产仔量,不同GSH浓度组间平均产仔率差异无显著性(P> 0.05),1 mmol/L组略高。0.5 mmol/L组与和1 mmol/L组出生的仔鼠均离乳成活,2 mmol/L组仔鼠离乳前死亡1只,平均成活率为(96.30 ± 6.41)%,不同GSH浓度组间平均成活率差异无显著性(P> 0.05)。
3 讨论
目前,AG129小鼠作为干扰素受体缺失最严重动物,是病毒感染性动物模型的建立、病毒致病机制研究及抗病毒疫苗与药物研究等方面科研工作中重要的实验材料。干扰素受体缺失,可能是导致该品系小鼠繁殖能力下降的原因,采用常规雌雄同笼交配方式,很难快速获得周龄、性别均一足量的动物,成为限制相关科研活动顺利开展的瓶颈。使用激素对AG129小鼠进行超排,采用常规体外受精方法很难获得足够数量的胚胎进行后续移植。
精子质膜中含有大量不饱和脂肪酸,为精子与卵子结合提供必要的条件。活性氧(ROS)能够使精子质膜过氧化,从而使精子质膜不可逆的丧失流动性,造成精子损伤,失去受精能力[9]。GSH作为清除氧自由基的清道夫,在细胞抗氧化系统中发挥着重要的作用[10]。在体外受精试剂中加入一定浓度的GSH,有利于体外受精的完成。GSH固体较稳定,但在溶液中极易受外界环境中的温度、光照等条件影响而被氧化为不具生理活性的氧化型谷胱甘肽[11]。因此,为防止含GSH的精子获能液氧化,必须在使用前现用现配,不可使用前期配置或使用剩余的试剂。
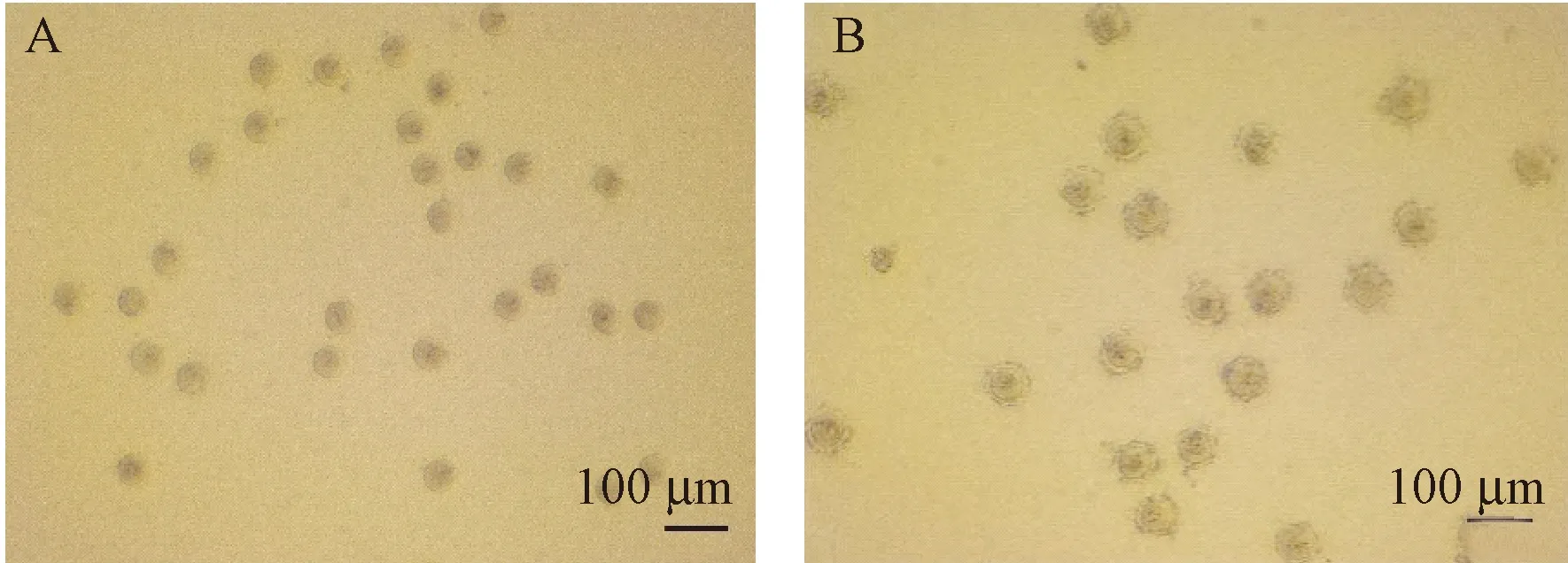
注:A: 正常体外受精6 h后胚胎。 B: 异常体外受精6 h后“毛球”状胚胎。图1 AG129小鼠体外受精6 h后胚胎Note. A, Normal embryos after 6 h of ivf. B, Abnormal “hairball” embryos after 6 hours of ivf.Figure 1 Embryos after 6 h of ivf of AG129 mice

注:A:正常体外受精24 h后胚胎。 B: 异常体外受精24 h后发育情况。图2 AG129小鼠体外受精24 h后胚胎Note. A, Normal embryos after 24 h of ivf. B, Growth of abnormal embryos after 24 h of ivf.Figure 2 Embryos after 24 h of ivf of AG129 mice
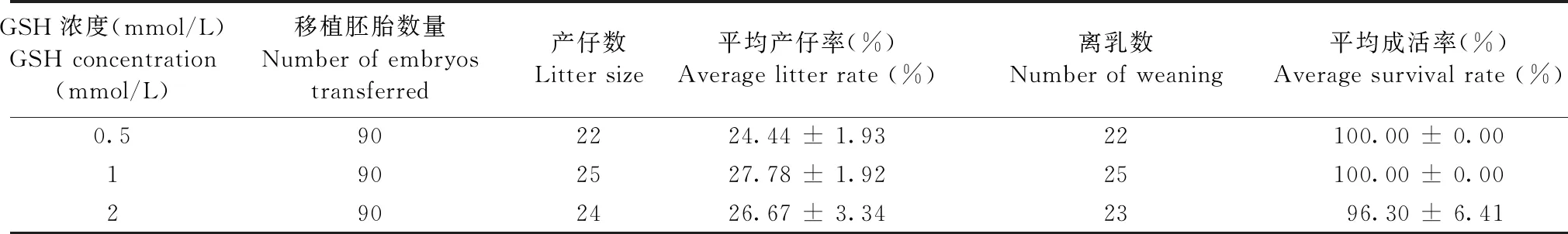
表2 移植产仔率与成活率情况Table 2 Transplant birth rate and survival rate
本实验以Toru等[12]前期研究为依据,设计了3个含不同浓度GSH的精子获能及受精液的实验组,1个不含GSH的精子获能液及受精液的对照组,通过实验发现精子获能液及受精液中加入GSH能够显著提高体外受精率,当GSH浓度为0.5 mmol/L时,受精率有所提高,当GSH浓度为2 mmol/L时,由于精子活力过强,导致异常受精卵数量明显增多,平均受精率下降,当GSH浓度为1 mmol/L时,受精率最高,受精效果最好。将不同GSH浓度组获得的2细胞胚胎分别移植受体动物,均获得了数量较为稳定的仔鼠。
因此,使用还原型谷胱甘肽(GSH)调节小鼠体外受精液成分,显著提高了AG129小鼠体外受精率,良好的完成对AG129小鼠体外受精,为该品系小鼠生物净化及快速繁殖提供了可靠的技术保障,并为后续类似问题的顺利解决提供了技术思路。
