低氧训练对肥胖小鼠Ghrelin-GHSR通路的影响
2020-05-06龚丽景付鹏宇朱镕鑫张一民许春艳
龚丽景,付鹏宇,朱镕鑫,张一民,4,许春艳*
(1. 北京体育大学中国运动与健康研究院,北京 100084; 2. 北京体育大学运动人体科学学院,北京 100084;3. 上海体育科学研究所,上海 200030; 4. 运动与体质健康教育部重点实验室,北京 100084)
低氧训练是指持续或间歇在低于正常氧气浓度的环境下(高原地区或人工模拟低氧舱)进行训练,利用低氧和训练的双重缺氧刺激以更多地调动机体潜能,是提高运动能力的有效训练方法[1]。随着全民健身观念的普及,低氧训练也逐步被引入大众健康领域。多项研究证明低氧训练具有较好的糖脂代谢的调控功能,低氧环境会减弱食欲,降低消耗吸收功能,从而减少摄食量[2],这些认知使低氧训练被认为是减肥的有效手段。
生长激素(growth hormone,GH)促分泌受体的内源性配体——胃促生长素/胃饥饿素(Ghrelin)发挥作用依赖于下丘脑分泌的生长激素促分泌素受体(growth hormone secretagogue receptor,GHSR)[3]。Ghrelin在Ghrelin-O乙酰基转移酶(ghrelin O-acyltransferase,GOAT)的作用下酰基化是其与受体GHSR结合产生生物学效应的前提[4]。Ghrelin及相关通路不仅可通过调节神经肽Y(neuropeptide Y,NPY)发挥促食欲功效[5],还调控能量平衡并参与调控中枢和外周的脂质代谢[6]。低氧环境下低氧诱导因子(hypoxia inducible factor,HIF)被激活参与机体的适应性应答,其中HIF-2α与脂代谢密切相关[7]。那么低氧训练发挥减脂控重的作用是否通过调控胃组织Ghrelin-GHSR通路发挥作用尚无研究,因此本研究拟通过对肥胖小鼠施加低氧运动干预,观察胃组织Ghrelin-GHSR通路相关基因改变,以探究低氧训练发挥减肥作用的机制。
1 材料与方法
1.1 材料
1.1.1 实验动物
60只SPF级雄性C57BL/6J小鼠,3周龄,体重为(8.2 ± 0.1)g,购自北京维通利华实验动物技术有限公司,【SCXK(京)2015-0004】,饲养期间各组小鼠均自由摄食饮水;普通维持饲料由中国军事医学科学院实验动物中心【SCXK(军)2012-0004】提供;高脂饲料购于美国Research Diet(D12109C,含40% kcal脂肪)。小鼠于北京体育大学动物实验室【SYXK(京)2016-0033】饲养:昼夜12/12 h,湿度恒定,温度控制在22 ~ 25℃。本研究经北京体育大学运动科学实验伦理委员会批准(批准号:IACUC 2015021)。
1.1.2 实验试剂
Anti-GHSR(Abcam ab95250)、Anti-Ghrelin(Abcam ab129383)、Anti-GOAT(Abcam ab170690)、Anti-NPY(Santa Cruz,sc-14728-R)、HIF-2α(Abcam ab109616)、anti-Tubulin(博奥森 bs-4511R),HRP标记的山羊抗兔IgG(Goat Anti-rabbit IgG/HRP,博奥森 bs-0295G-HRP),SuperSignalTMWest Femto Maximum Sensitivity Substrate(Thermo Scientific, 34095),Rat/mouse Ghrelin(Total) ELISA Kits(Merck EZRGRT-91 K),MiniBEST Universal RNA Extraction Kit(TaKaRa 9767),PrimeScriptTMMaster Mix(TaKaRa RR036A),SYBR Premix Ex Taq II(TaKaRa RR820A)。
1.1.3 仪器
实时荧光定量PCR仪(ABI 7500,美国),动物跑台(杭州段氏DSPT-215,中国),制氮机(北京创文,中国),空气压缩机(英格索兰,美国),全自动生化分析仪(日立7020,日本),酶标仪(Bio-Rad 680,美国), 超微量分光光度仪(NanoDrop 2000,美国),蛋白转印仪(Thermo Scientific iBlot 2,美国),ChemiDocTMXRS+成像系统(Bio-Rad,美国)。
1.2 方法
1.2.1 动物分组及实验干预
小鼠随机分为普通膳食对照组(C,n=8,饲喂普通维持饲料)和高脂膳食组(H,n=52,饲喂高脂饲料)。8周后,选择H组大于C组平均体重的20%作为肥胖模型,随机分为:肥胖对照组(HC,n=8)、肥胖常氧运动组(HE,n=8)、肥胖低氧暴露组(HH,n=8)和肥胖低氧运动组(HHE,n=8),继续饲喂高脂饲料。HE和HHE组进行跑台训练,速度12 m/min,1 h/d。HH和HHE组暴露在11.2%的低氧房中,8 h/d;其中HHE组每天固定时间在低氧环境中运动1 h,6次/周。干预共4周。
1.2.2 形态指标测试及取材
每周记录体重和摄食量。完成训练后禁食12 h,腹腔麻醉(1%的戊巴比妥钠,40 mg/kg体重),心脏取血,收集血清,-20℃保存。开腹取胃底部和开颅取下丘脑组织,分别置于RNA保存液和-80℃保存,分别用于RNA和蛋白含量的测试。
1.2.3 血液生化指标和总Ghrelin水平测试
采用全自动生化分析仪测试血液甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)和血糖(glucose,GLU)水平。酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)测试血清总Ghrelin水平。
1.2.4 下丘脑GHSR和胃组织Ghrelin mRNA相对含量测定
使用试剂盒提取胃和下丘脑总RNA,检测总RNA浓度,逆转录获取cDNA后,按说明书进行PCR反应。Ghrelin和GHSR引物参考付鹏宇等[8],由生工生物工程(上海)有限公司合成。18S为内参基因(德国QIAGEN QT01036875)。采用比较阈值法(△△Ct法)对目的基因的相对表达进行分析。
1.2.5 下丘脑GHSR、NPY和胃组织Ghrelin、Goat、HIF-2α蛋白水平测定
提取下丘脑和胃组织总蛋白质,BCA法定量总蛋白质浓度,用蛋白免疫印迹法(Western Blot,WB)检测各蛋白的表达情况。电泳分离蛋白,转至NC膜,BSA封闭1 h,分别4℃孵育一抗过夜,洗去未结合的一抗,室温孵育二抗1 h,洗去未结合的二抗,滴加化学发光HRP底物,立即用ChemiDocTMXRS+成像系统(Bio-Rad)曝光条带,使用Image Lab软件进行相对定量分析。
1.3 统计学分析
2 结果
2.1 干预期间小鼠体重和摄食量变化
各组小鼠初始体重平均值为(8.2 ± 0.1)g,饲喂8周高脂饲料后,将H组体重大于C组平均体重20%的小鼠随机分成HC组、HE组、HH组和HHE组,未达标小鼠弃去。此时,HC组、HE组、HH组和HHE组小鼠体重极显著高于C组(P< 0.01);干预4周(饲喂12周),HC组显著高于C组,HH、HE和HHE组较HC组显著下降(P< 0.05)。适应性喂养结束后,C组饲喂普通维持饲料,H组持续饲喂高脂饲料。建立肥胖模型期间(8周前),C组小鼠摄食总量较H组少;饲喂第10周时(干预2周),C组摄食量仍低于高脂膳食各组,HE、HH和HHE组较HC组降低;饲喂第12周时(干预4周),C组摄食量高于高脂膳食各组,HE、HH和HHE组与HC组摄食量接近,见图1。
2.2 各组小鼠血清TG、TC、GLU和总Ghrelin水平
4周干预完成后,HC组各项血液指标均显著高于C组(P< 0.05);与HC组相比,HE组血清TG、TC水平无显著性差异,但GLU水平显著性降低(P< 0.05);HH组血清TC和GLU水平显著低于HC组,且TC水平显著低于HE组(P< 0.05);HHE组血清TG水平较HC组无显著性差异,TC水平显著低于HE组,GLU水平显著低于HC和HE组(P<0.05)。HH组和HHE组小鼠的各项指标无显著差异。4周干预后,HC组血清总Ghrelin水平较C组无显著性差异;HE组较HC组无显著性差异;HH和HHE组小鼠血清总Ghrelin含量较HC组均出现显著性上升,且HHE组较HE组显著性上升(P< 0.05),见表1。

注:C,普通膳食对照组;HC,肥胖对照组;HE,肥胖常氧运动组;HH,肥胖低氧暴露组;HHE,肥胖低氧运动组。下表/图同。与C组相比,*P< 0.05,**P< 0.01;与HC组相比,#P < 0.05。图1 小鼠体重和摄食量变化Note. C, the control group. HC, obese control group.HE, obese exercise group.HH, obese hypoxic exposure group. HHE, obese hypoxic exercise group. The same in the following table and figures. Compared with C group,*P < 0.05,**P < 0.01. Compared with HC group,#P < 0.05.Figure 1 Changes in body weight and food intake in mice
表1 各组小鼠血清TG、TC、GLU和总Ghrelin水平(n=8)
Table 1 Levels of serum TG, TC, GLU and total Ghrelin in each group of mice(n=8)

组别GroupsTG (mg/dL)TC (mmol/L)GLU (mmol/L)Ghrelin (mmol/L)C0.29 ± 0.022.03 ± 0.098.50 ± 0.780.31 ± 0.09HC 0.34 ± 0.03*4.54 ± 0.03*10.22 ± 1.77*0.30 ± 0.06HE0.33 ± 0.044.66 ± 0.11 8.25 ± 1.33#0.32 ± 0.11HH0.35 ± 0.07 3.98 ± 0.30#△ 8.06 ± 1.29# 0.36 ± 0.15#HHE0.33 ± 0.08 4.24 ± 0.26△ 6.38 ± 1.72#△ 0.40 ± 0.21#△
注:与C组相比,*P< 0.05;与HC组相比,#P< 0.05;与HE组相比,△P< 0.05。
Note. Compared with C group,*P< 0.05. Compared with HC group,#P< 0.05. Compared with HE group,△P< 0.05.
2.3 下丘脑GHSR和胃组织Ghrelin mRNA的表达水平
与C组相比,12周高脂喂养后,HC组下丘脑GHSR和胃组织Ghrelin mRNA表达水平均极显著降低(P< 0.01);4周干预后,HE和HH组下丘脑GHSR mRNA表达水平较HC组有增加趋势,但无显著差异,但HE和HH组胃组织Ghrelin mRNA表达水平较HC组显著性升高(P< 0.01或P< 0.05);HHE组下丘脑GHSR mRNA表达水平较HC组显著上升,胃组织Ghrelin mRNA表达水平较HC组极显著性增加,较HE组也显著性增加(P< 0.05或P< 0.01),见图2。
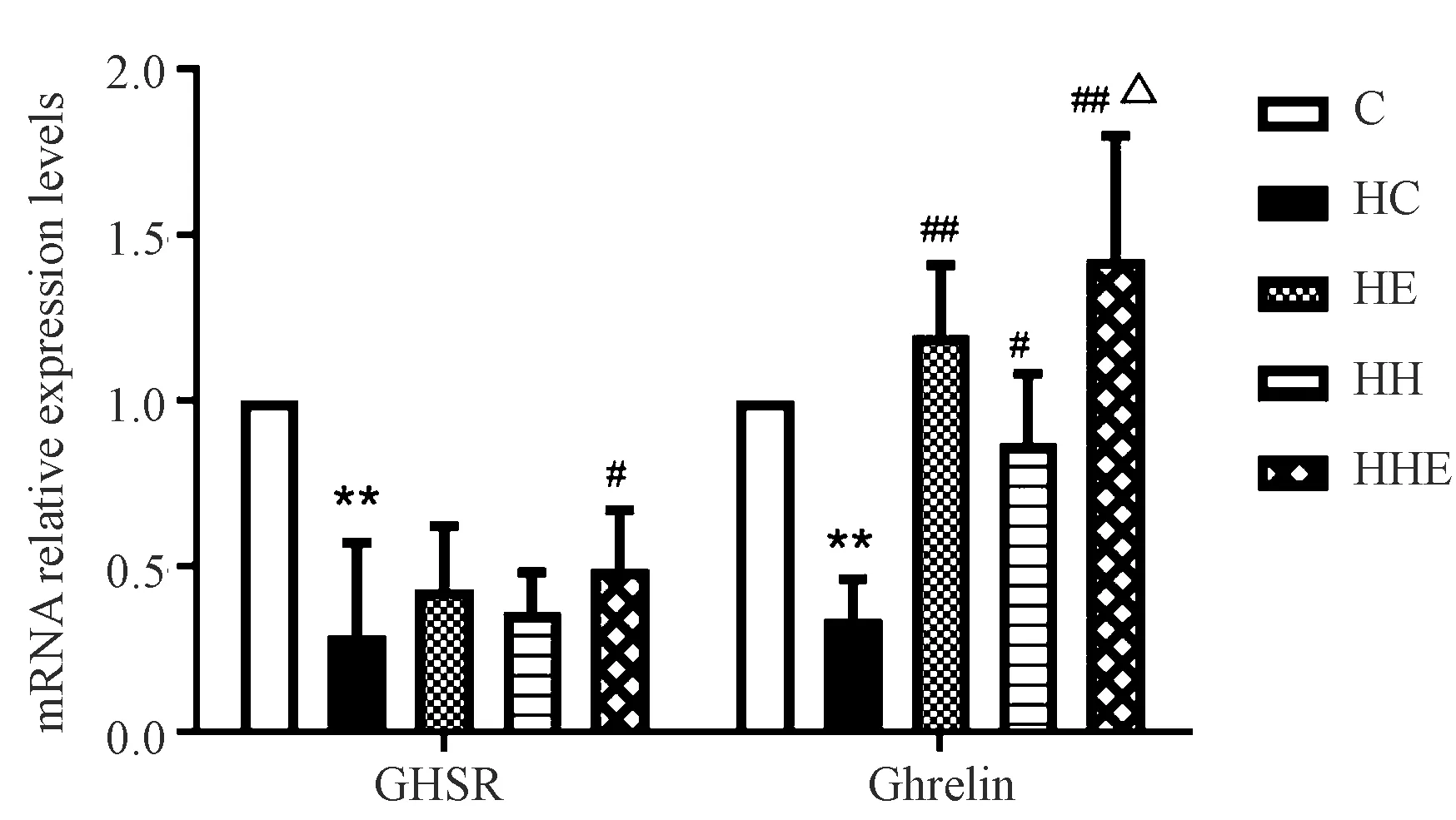
注:与C组相比,**P< 0.01;与HC组相比,#P < 0.05,##P < 0.01;与HE组相比,△P < 0.05。图2 小鼠下丘脑GHSR和胃组织Ghrelin mRNA表达水平Note. Compared with C group,**P < 0.01. Compared with HC group,#P < 0.05,##P < 0.01. Compared with HE group,△P < 0.05.Figure 2 GHSR mRNA expression in hypothalamic tissues and Ghrelin mRNA expression in gastric tissues of mice
2.4 下丘脑和胃组织的蛋白表达水平
12周高脂饲料喂养后,HC组下丘脑GHSR和NPY的蛋白表达水平较C组无显著性差异;HE、HH和HHE组下丘脑GHSR蛋白表达水平较HC组显著增加(P< 0.05);HE和HHE组下丘脑NPY蛋白表达水平较HC组显著上调(P< 0.05)(见图3 A,B)。高脂饲喂后,HC组胃组织Ghrelin、Goat和HIF-2α的蛋白表达水平与C组相比无显著差异;HE组胃组织Ghrelin、Goat较HC组显著增加(P< 0.05);HH组胃组织Ghrelin和HIF-2α的蛋白表达水平较HC组显著增加(P< 0.05);HHE组胃组织Ghrelin、Goat和HIF-2α的蛋白表达水平较HC组显著增加,且HIF-2α蛋白表达水平显著高于HE组(P< 0.05)(见图3C,D)。

注:与HC组相比,#P < 0.05;与HE组相比,△P < 0.05。图3 下丘脑和胃组织相关蛋白WB条带灰度值(A,C)和相对含量(B,D)Note. Compared with HC group,#P < 0.05. Compared with HE group,△P < 0.05.Figure 3 WB results (A, C) and relative amounts (B, D) of hypothalamic and gastric tissue-associated proteins of mice
3 讨论
Ghrelin是由胃底粘膜腺中的X/A样细胞合成和分泌的28个氨基酸的活性肽激素,是调节食欲的重要激素[3]。近年来,Ghrelin被认为具有对抗肥胖的潜能并开始引起广泛关注[6]。
研究发现循环系统中Ghrelin含量与体重成反比[9]。肥胖机体下丘脑和胃组织中的Ghrelin水平会出现下降[10-11]。本研究结果发现肥胖小鼠胃组织Ghrelin和下丘脑GHSR mRNA水平出现显著性下降,血脂和血糖(TG、TC和GLU)水平上调。研究发现,Ghrelin可依赖GHSR发挥调节脂代谢的作用,Ghrelin-GHSR通路可通过促进5’-磷酸腺苷蛋白激酶(adenosine 5’-monophosphate-activated protein kinase,AMPK)磷酸化,以激活AMPK,使乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACC)磷酸化失活,减少丙二酰-CoA(malonyl-CoA)的积累,导致肉碱棕榈酰基转移酶1(carnitine palmitoyl transferase 1,CPT1)活性增加以促进脂肪酸氧化[12]。Ghrelin刺激NPY神经元可阻断黑色素皮质素受体3和4(melanocortin receptor 3/4,MC3/4R),随后通过交感神经调节肝脏、白色脂肪组织、棕色脂肪组织和骨骼肌组织脂代谢相关基因表达以影响外周脂代谢水平[13-14]。此外,Ghrelin还是葡萄糖代谢的中介物,并可调节胰岛β细胞分泌胰岛素[15]。推测Ghrelin-GHSR通路在调控糖脂代谢方面发挥着重要的作用,然而肥胖机体组织Ghrelin-GHSR通路表达下调,出现糖脂代谢紊乱,血糖血脂水平失调[16],从而加剧对机体的危害[17]。
低氧暴露下体重的丢失常被认为与摄食量下调所致[2, 18]。本研究结果发现,低氧暴露的最初阶段,低氧组(HH和HHE组)小鼠摄食量较常氧组(H和HE组)均出现显著下降,但随着低氧暴露时间延长,低氧组小鼠摄食量逐渐回升,在4周干预结束时,与常氧组接近。机体摄食功能对长期低氧暴露的适应可能与Ghrelin-GHSR的调控有关。Ghrelin发挥调节食欲的作用是通过生长激素促分泌受体GHSR所介导的,GHSR高表达于下丘脑中调节摄食和体重平衡的细胞群中,如弓状核NPY神经元和腹内侧核的脂肪酸合成酶(fatty acid synthase,FAS)神经元[19]。而NPY神经元发挥调节食欲的作用由Ghrelin特异性介导的,其他促食欲激素如黑色素聚集激素(melanin-concentrating hormone,MCH)和前原食欲素(prepro-orexins)则无此作用[5]。研究发现急性低氧暴露(12 h)会导致大鼠胃组织Ghrelin mRNA和蛋白水平极具下调,但随着暴露时间的延长(24 h和48 h),Ghrelin水平逐渐回升,甚至超过常氧水平[8]。本研究中,低氧训练组小鼠血清Ghrelin总量、胃组织中Ghrelin和Goat及下丘脑GHSR和NPY蛋白表达水平显著上升,这可能与Ghrelin-GHSR通路被激活以抵抗低氧的进一步损伤和参与前期胃组织损伤的修复有关[20]。而常氧运动小鼠Ghrelin和NPY蛋白水平虽增加但其摄食量未明显改变,可能与运动后产热增加导致体温上升,从而抑制了食欲有关[21]。
本研究中低氧训练干预后,肥胖小鼠血清TC和GLU水平显著下降,并伴随着血液总Ghrelin水平的上调和胃组织中Ghrelin-GHSR通路相关基因mRNA和蛋白水平表达的增加。这可能与运动训练对Ghrelin-GHSR通路的调控有关。由于Ghrelin和运动均可发挥促进能量代谢平衡的作用,因此两者间的相互影响作用引起了学者们的关注[22]。研究发现,93 d的骑行运动后,健康成年男性空腹血液Ghrelin水平增加26%,且体重降低6%[23]。同时,胰岛素抵抗和高胰岛素血症程度与血液Ghrelin水平呈负相关,这可能是运动促进糖脂代谢平衡的重要机制[24]。游泳训练可增加胃组织中Ghrelin表达,从而降低肥胖大鼠体重和内脏脂肪含量[10]。此外,运动训练提高胃组织Ghrelin表达还具有促进胃的排空和肠道的推进力的作用[25],从而有助于代谢废物的排出和营养物质的吸收[26]。运动发挥促进Ghrelin-GHSR通路的表达可能与交感神经活动增强有关,运动激活交感神经和循环系统中肾上腺素和去甲肾上腺素(儿茶酚胺)的水平,同时胃组织中产生Ghrelin的细胞具有α1和β1肾上腺素能受体,而肾上腺素和去甲肾上腺素可刺激β1以促进胃组织分泌Ghrelin[27-28]。通过本研究结果还可观察到低氧运动调控肥胖机体糖脂代谢的作用优于常氧训练,这可能与低氧环境所激活的HIF-2α调控作用有关。本研究结果中低氧训练后肥胖小鼠下丘脑HIF-2α的蛋白表达水平显著增加。HIF是机体缺氧条件下参与组织细胞低氧应答敏感性转录因子,它的表达是机体适应低氧的起始步骤和关键环节。其中HIF-2α在脂代谢中发挥重要的作用,可参与脂滴的形成、脂肪酸的合成和β-氧化及胆固醇代谢的调节[7]。HIF-2α缺失会造成机体脂代谢的异常[29]。低氧暴露所致的食欲下降仅发生在低氧暴露初期,随着低氧时间的延长,食欲逐渐恢复至常氧水平,但仍可达到降低体重的效果,这可能与长期低氧暴露通过刺激HIF-2α以促进脂代谢有关。
本研究结果提示,低氧暴露和运动训练干预后肥胖小鼠的体重和血脂血糖水平下降,并伴随着Ghrelin-GHSR通路的上调,但摄食量并未出现明显下降,提示低氧和运动通过Ghrelin-GHSR通路改善高脂膳食所致肥胖主要与胃肠功能增强和糖脂代谢机能促进有关。而低氧训练中,低氧和运动的双重刺激加速了肥胖机体的糖脂代谢能力,从而更有利于控制机体的血糖血脂水平及抵抗高脂膳食对体重的增加。
肥胖小鼠胃组织Ghrelin和下丘脑GHSR水平降低,伴随着血脂血糖水平的升高和体重的增加;低氧训练通过肥胖小鼠Ghrelin-GHSR通路影响糖脂代谢,改善肥胖机体体重和血脂血糖稳态。
