D-半乳糖与L-谷氨酸诱导树鼩肝组织损伤
2020-05-06陆姜利郭玉倩钱忠义角建林梁张郑红
陆姜利,郭玉倩,钱忠义,角建林,梁张*,郑红*
(1. 昆明医科大学实验动物学部,昆明 650500; 2. 昆明医科大学基础医学院实验教学中心,昆明 650500;3. 昆明医科大学技术转移中心,昆明 650031)
肝是人体新陈代谢的主要器官,具有十分重要和复杂的生理功能[1]。化学物质是导致临床常见肝损伤的因素。通过胃肠道门静脉或体循环进入肝进行转化,有毒物质使肝组织受到损害,表现为肝细胞变性、坏死,肝功能障碍,进而发展为肝硬化,甚至引起肝衰竭、肝癌、肝性脑病等[2-3]。肝疾病对人类健康危害巨大,目前肝疾病的治疗仍然是世界性难题,建立实验性肝损伤动物模型, 有助于肝疾病发病机制的研究、筛选保肝药物。实验性肝损伤动物模型已成为发病机制和药物研发的重要工具。
1968年,首次报道D-半乳糖(D-galactose,D-gal)引起肝损伤[4]。目前,D-gal已被广泛应用于建立实验性衰老、肝损伤等疾病模型[5-8]。D-gal是动物体内正常的营养成分,机体在正常情况下将D-gal转化为葡萄糖-6-磷酸。过量摄入则会引起机体细胞内大量D-gal堆积,导致氧化应激-自由基损害,破坏细胞线粒体、DNA和蛋白质等,进而出现器官损伤[9-10]。L-谷氨酸(glutamate,Glu)是中枢神经系统内最主要的一种兴奋性神经递质,参与机体正常生理活动,但是大量谷氨酸能够引起神经兴奋性毒性,导致神经元的肿胀、凋亡与坏死,谷氨酸诱导肝损伤未见报道[11-12]。因此,D-半乳糖和L-谷氨酸联合作用是增强或降低肝毒性,值得探索。
Toll样受体(toll-like receptor,TLR)最早在果蝇体内发现,TLRs家族是介导炎症反应的关键受体蛋白,其中TLR2通过刺激触发骨髓分化因子88依赖性信号传导可增强核转录因子κB(nuclear factor-kappa B,NF-κB)的活化,激活炎性反应[13-17]。研究表明TLR2/NF-κB信号通路在肝损伤中起到重要作用,在肝损伤时二者表达均升高[18]。P糖蛋白(P-glycoprotein,P-gp)是一种药物转运体,在肝中主要介导疏水性阳离子的外排,降低细胞内的药物浓度。有研究发现P-gp在肝损伤发生时,表达上调[19-20]。
本研究给予树鼩D-半乳糖和L-谷氨酸,探索复合因素的实验性肝损伤动物模型。通过检测TLR2/NF-κB和P糖蛋白的表达,初步探究树鼩肝损伤的机制。
1 材料与方法
1.1 材料
1.1.1 实验动物
28只雄性10月龄树鼩,体重(136 ± 20)g,购自昆明医科大学实验动物学部【SCXK(滇)K2015-0002】,饲养于昆明医科大学普通级实验室【SYXK(滇)K2015-0002】。实验操作符合实验动物伦理学要求【伦理审批号:KMMU2019017】。
1.1.2 主要仪器与试剂
组织包埋机(Leica,美国),切片机(Leica,美国),摊片烤片一体机(Leica,美国),生物显微镜(Leica,美国),L-谷氨酸(Sigma,美国),D-半乳糖(Sigma,美国),Anti-P Glycoprotein(Abcam,ab170904),Anti-NF-κB p65(Abcam,ab32536),Anti-TLR2(Abcam,ab209216)。
1.2 方法
1.2.1 实验动物的分组、给药及取材
将28只健康雄性树鼩随机分为4组,每组7只。分别为对照组(CT组,灌胃生理盐水8 mL/kg)、L-谷氨酸组(G组,灌胃2000 mg/kg)、D-半乳糖组(D组,腹腔注射600 mg/kg)、 D-半乳糖联合L-谷氨酸组(D+G组,腹腔注射D-半乳糖600 mg/kg;灌胃L-谷氨酸2000 mg/kg),每天给药1次,持续8周。每周称量动物体重,记录存活数。心脏采血处死树鼩后,4%多聚甲醛灌注固定脏器,取肝组织立刻置于4%多聚甲醛48 h,透明,浸蜡,包埋。
1.2.2 组织学染色检测
蜡块切片,脱蜡。HE染色:苏木素染色,用水冲洗后盐酸酒精分化,伊红染色,脱水封片。免疫组织化学染色:柠檬酸组织抗原修复液于高压锅里煮2 min,PBS冲洗3次;过氧化氢孵育15 min,PBS冲洗3次;用一抗孵育于4度冰箱过夜,PBS冲洗3次;二抗孵育15 min,PBS冲洗3次;DAB显色液孵育3 min,显微镜观察显色后用PBS冲洗终止显色;苏木素染色4 min,水冲洗,盐酸酒精分化6 s,用水返蓝至镜下观察细胞核为蓝色;脱水封片。
1.3 统计学分析
用Image J对树鼩肝组织免疫组化染色结果进行处理,计算阳性面积占比及平均光密度值;应用Graphpad prism 7对阳性面积占比及平均光密度值作图并进行组间One-way ANOVA法分析,P< 0.05为差异有显著性。
2 结果
2.1 L-谷氨酸与D-半乳糖处理对树鼩体重和存活率的影响
如图1A所示,给药第1周,各组树鼩平均体重均有所下降。与第1周相比,树鼩第8周的平均体重均上升的是CT组(13%)、G组(12%)、D组(6%),而D+G组体重下降6%。如图1B所示,给药8周后,CT组的存活率为100%,G组为87.5%,D组为54.55%,D+G组70%。
2.2 L-谷氨酸与D-半乳糖处理对树鼩肝组织的影响
组织病理学的结果显示,CT组树鼩肝细胞索呈放射状排列,从中央静脉(central vein,CV)辐射并通过血窦(blood sinusoids,S),肝细胞形态良好(图2A)。门静脉(portal vein,PV)区域有分支胆管(bile ducts, BD)(图2E);少量炎症细胞浸润(图2I)。G组可见肝细胞水样变性,部分细胞坏死,肝细胞水肿(edema,E),中央静脉扩张(图2B);门静脉、分支胆管扩张(图2F);炎症细胞浸润较明显(图2J)。D组肝细胞排列紊乱,结构较模糊,可见核固缩(#),CV扩张(图2C);PV、BD扩张(图2G);炎症细胞浸润加重(图2K)。D+G组损伤更为严重,可见肝细胞脂肪变性(&),细胞核空泡化(*),细胞索状消失,肝血窦明显增宽,肝细胞呈游离状态、数量减少,CV扩张(图2D);PV和BD扩张明显(图2H);有大量的炎症细胞浸润(inflammatory cell infiltration,ICI)(图2L)。
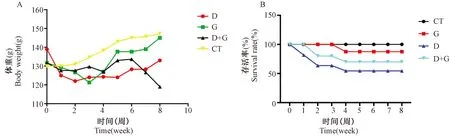
图1 L-谷氨酸与D-半乳糖对树鼩体重(A)和存活率(B)的影响Figure 1 Changes of the body weight(A)and survival rate(B)in tree shrews after intervention
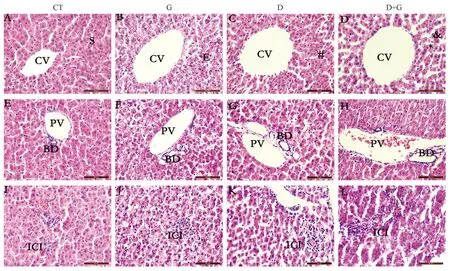
注:CT组(AEI),G组(BFJ),D组(CGK),D+G组(DHL);A-D中,CV,S,E,#,&,*分别表示中央静脉(central vein,CV),血窦(blood sinusoids,S),肝细胞水肿(edema,E),核固缩(#),肝细胞脂肪变性(&),细胞核空泡化(*);E-H中,PV,BD分别表示门静脉(portal vein,PV),分支胆管(bile ducts, BD);I-L中,ICI表示炎症细胞浸润(inflammatory cell infiltration,ICI)。图2 树鼩肝组织形态Note. CT group (AEI), G group(BFJ), D (CGK), D+G grop(DHL). A-D, CV, S, E, #, &, * represent central vein,blood sinusoids, Hepatoedema, Nuclear pyknosis, Cell steatosis, Cell vacuolation. E-H, PV and BD represent portal vein, bile ducts. I-L ICI represent inflammatory cell infiltration.Figure 2 Histological structure in liver tissu
2.3 L-谷氨酸与D-半乳糖处理增加了树鼩肝Toll样受体2(TLR2)的表达
IHC染色显示,TRL2主要在肝血窦与细胞膜上表达(图3A)。G组(P< 0.05)、D组(P< 0.05)、D+G组(P< 0.05)的TRL2阳性面积占比(图3B)、平均光密度值均显著高于对照组(图3C)。在3个处理组中,D+G组(P< 0.05)的阳性面积占比、平均光密度值均显著高于G组和D组。

注:A: 各组树鼩TLR2图片(IHC染色)。B, C: CT组与G,D,D+G组相比,*P< 0.05,D+G组与G,D组相比,#P < 0.05。图3 树鼩肝组织TLR2的表达Note. A, Immunohistochemical staining of TLR2(IHC staining). B, C, CT group compared with G,D,D+G group,*P< 0.05.D+G group compared with G,D group, #P < 0.05.Figure 3 Expression of TLR2 in liver tissue
2.4 L-谷氨酸与D-半乳糖处理增加了树鼩肝核转录因子κB(NF-κB)表达
NF-κB主要表达定位于肝血窦膜上。L-谷氨酸、D-半乳糖及L-谷氨酸联合D-半乳糖均能增加肝NF-κB表达(图4A)。G组、D组、D+G组NF-κB的阳性面积占比(图4B)、平均光密度值均极显著高于对照组(图4C)(P< 0.01)。相对于G组和D组,D+G组的阳性面积占比、平均光密度值均显著升高(P< 0.01)。

注:A: 各组树鼩NF-κB图片(IHC染色)。B,C: CT组与G,D,D+G组相比,**P< 0.01;D+G组与G,D组相比,##P< 0.01。图4 树鼩肝组织NF-κB的表达Note. A, Immunohistochemical staining of NF-κB(IHC staining). B, C, CT group compared with G,D,D+G group,*P< 0.01.D+G group compared with G,D group, ##P< 0.01.Figure 4 Expression of NF-κB in liver tissue
2.5 L-谷氨酸与D-半乳糖处理增加了树鼩肝P-糖蛋白(P-gp)的表达
免疫组化表明树鼩肝P-gp表达主要在细胞核与细胞膜上(图5A)。与CT组比较,G组、D组、D+G组P-gp的阳性面积占比(图5B)、平均光密度值均及显著升高(P< 0.01)(图5C)。D+G组的阳性面积、平均光密度值极显著高于G、D组(P< 0.01)。提示L-谷氨酸、D-半乳糖及L-谷氨酸联合D-半乳糖均能引起肝P-糖蛋白表达增加,以介导药物外排,其中L-谷氨酸联合D-半乳糖的药物外排作用显著高于单独给药。

注:A:各组树鼩P-gp图片(IHC染色)。B,C: CT组与G,D,D+G组相比,**P< 0.01;D+G组与G,D组相比,##P< 0.01。图5 树鼩肝组织P-gp的表达Note. A, Immunohistochemical staining of P-gp(IHC staining). B, C, CT group compared with G,D,D+G group,**P< 0.01.D+G group compared with G,D group, ##P< 0.01.Figure 5 Expression of P-gp in liver tissue
3 讨论
本实验探究D-半乳糖和L-谷氨酸对树鼩肝的损伤情况。有研究表明长期大剂量给予D-半乳糖、谷氨酸均能够对机体产生损伤[21-22]。体重与存活率能反映机体的综合代谢,进而反应药物对机体的治疗和损伤作用。本实验发现,D+G组树鼩体重减轻,存活率下降,提示L-谷氨酸与D-半乳糖联合给药,对树鼩有明显的损伤作用。肝是机体的主要代谢器官,也是化学物质最重要的靶器官,肝损伤是一种多因素疾病。肝损伤的主要靶细胞为肝细胞、胆管上皮细胞和血管内皮细胞,其病理特点复杂多变。肝活检是临床上判断肝损伤严重程度的重要指标,协助分析病因和判断预后[23]。D-半乳糖能够导致小鼠肝组织细胞排列不整齐,肝细胞坏死,出现明显病变[24-27]。谷氨酸钠导致小鼠肝细胞细胞质肿胀,细胞核空泡化,门静脉区域充血,胆管扩张和炎性细胞浸润[28-30]。本实验显示L-谷氨酸对树鼩肝细胞损伤与谷氨酸钠类似。此外,D-半乳糖联合L-谷氨酸给药,肝组织病理损伤更为严重,表现为肝细胞脂肪变性,细胞核空泡化,细胞索状消失,肝血窦明显增宽,中央静脉与门静脉扩张明显,有大量的炎症细胞浸润。提示联合给药导致树鼩肝组织较强炎性反应。
Toll样受体的胞内段与IL-1受体同源,其激活能激发早期抗感染的炎性细胞因子生成,进而启动机体炎性防御机制。TLRS及其信号途径在炎性反应中发挥重要作用。核转录因子NF-κB是具有多种转录调节作用的核转录因子,通过参与炎性细胞因子的表达而参与多种疾病过程。TLRS的激活引起下游分子活化,导致NF-κB的活化及启动子结合蛋白磷酸化,诱导NF-κB信号通路的促炎性因子反应,激活炎性因子产生生物学效应。张昭[31]发现急性出血坏死性胰腺炎(AHNP)肝中TLRs与NF-κB具有正相关性,TLRs表达上调,进一步激活NF-κB,炎性介质表达增强,肝损伤加重。TLR2是TRLs家族中研究最早分布最广泛的成员,受到内外源性配体刺激后,通过骨髓分化因子88依赖性途径活化NF-κB。NF-κB进入细胞核中作为转录因子诱导促炎因子和炎性因子表达[32]。四氯化碳诱导大鼠肝损伤中,TLR2与NF-κB表达显著升高[33]。在AHNP肝损伤模型中大鼠,TLR2mRNA和TLR2的表达均显著升高[34-36]。糖尿小鼠病伴有肝损伤时NF-κB的表达显著上升[37]。与以上报道相似,本实验显示D-半乳糖、L-谷氨酸及二者联合给药均使TLR2、NF-κB的表达升高。推测D-半乳糖、L-谷氨酸通过刺激TLR2/NF-κB信号通路,促发炎性反应,引起肝组织病理改变。
糖蛋白也称为多耐药基因1,是ABC结合转运蛋白超家族成员,依赖ATP供能,介导肝细胞外排药物[38-39]。主要介导疏水性阳离子外排降低肝细胞内药物浓度,产生耐药现象。炎性反应等病理条件下药物转运体的活性和表达改变,进而影响疗效或产生毒性。临床病理条件下,肝药物转运体表达的改变反映病情进程[40]。P-糖蛋白在慢性肝损伤中发挥一定作用[41]。周利婷等[19]在异烟肼致小鼠肝损伤中观察到P-糖蛋白升高。李春桃[20]在小鼠肝癌模型中发现,肝缺血再灌注损伤时,P-糖蛋白显著升高。本实验中L-谷氨酸、D-半乳糖单独或联合给药,均引起树鼩肝P-糖蛋白的高表达,当二者联合给药时P-糖蛋白的表达最高。提示炎症反应严重性与P-糖蛋白增加正相关。
综上所述,D-半乳糖、L-谷氨酸单独或联合作用均可引起树鼩肝组织损伤,其中联合给药损伤较严重。其机制可能涉及TLR2/NF-κB通路激活而诱发炎性反应;同时树鼩肝组织P-糖蛋白代偿性增加,以缓解毒性。
