tdTomato转基因小鼠的建系及其在细胞示踪方面的应用研究
2020-05-06王菲原一桐高渊涛田峰田野李宵李承罡杜若琛李鹏飞王雅丽王春芳
王菲,原一桐,高渊涛,田峰,田野,李宵,李承罡,杜若琛,李鹏飞,王雅丽,王春芳*
(1. 山西医科大学实验动物中心,太原 030001; 2. 南昌大学玛丽女王学院,南昌 330000;3. 山西省人民医院,太原 030001; 4. 山西医科大学第二医院骨科,太原 030001)
自从1980年,Gordon等首次利用原核显微注射法研究动物转基因技术后,对于转基因鼠的研究便不断深入[1-2]。其中,转基因荧光鼠作为一项重大研究成果,现已经变成了生命科学、医学和药学等诸多领域的科研基础,转基因荧光鼠能够在相应激发光下自发荧光的特性,为科学研究提供具有更加简捷、无毒害等优质特点的生物工具以及细胞治疗方面的示踪工具[3-4]。
Tandem-dimer tomato(tdTomato)是一种来自Discosoma coral(DsRed)变体红色荧光蛋白,相比绿色荧光蛋白(green fluorescence protein,eGFP)更加稳定,激发波长也更长。且与其他的DsRed衍生物相比,tdTomato也是最亮且最耐光的[5]。在国外,tdTomato红色荧光蛋白作为稳定的荧光标记物,已经成功构建转基因小鼠品系,同时也在标记表达小白蛋白的神经元实验中以及其他细胞标记实验中进行使用,但在国内尚未展开广泛的应用[6-8]。
干细胞的研究和应用一直都是科研的热门方向,其中干细胞的培养和移植治疗是关键的两个方面[9-10]。目前,神经干细胞(neural stem cells,NSCs)的对于脊髓损伤后的移植治疗已被大量实验证实可以有效减少脊髓损伤后出现的继发组织受损并恢复一定的运动功能,这为临床治疗脊髓损伤疾病带来了新的方向[11-13]。本课题组也一直致力于多种干细胞的研究,其中包括NSCs和骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)以及NSCs在脊髓损伤方面的应用,所以干细胞的培养观察和移植治疗时的示踪都是极为关键的步骤[14-16]。而在细胞实验中,使用荧光鼠来代替细胞标记术能有效地简化细胞实验的实验过程,现为了保障后续干细胞共培养实验过程及NSCs移植示踪实验中能够使用更为快捷、稳定、无影响的荧光模式鼠,拟构建tdTomato转基因小鼠。
1 材料与方法
1.1 材料
1.1.1 实验动物
清洁级C57/BL6小鼠50只,2 ~ 3月龄,雌雄2∶1,体重24 ~ 28 g;清洁级eGFP转基因小鼠4只,2 ~ 3月龄,13 ~ 14 d孕龄,体重26 ~ 32 g,购于山西医科大学实验动物中心【SCXK(晋)2015-0001】,饲养于山西医科大学实验动物中心屏障环境中【SYXK(晋)2009-0004】。实验小鼠的饲养过程和其他实验操作均符合实验动物伦理学要求(审批号:IACUC2017-002)以及中华人民共和国《实验动物管理条例》。
1.1.2 仪器与试剂
PCR仪(Eppendorf AG 22331 Hamburg,德国),荧光显微(OLYMPUS,日本),Impactor M-Ⅲ脊髓击打器(NYU,美国),细胞培养箱(Heal Force,HF240,中国),石蜡切片机(Leica RM 2245,德国),OFK-8000 A多波段LED检查套装(Spectronics,美国)。Gateway® BP ClonaseTMII Enzyme Mix (Invitrogen,11789-020),GatewayTMLR ClonaseTMII Plus Enzyme Mix (Invitrogen,12538-120),Anti-Nestin抗体(BOSTER,BA1289),Anti-CD34抗体(BOSTER,bs-8996R),Anti-CD44 抗体(BOSTER,bs-4916R),NeuroCultTMBasal Medium(STEMCELL,18C88583)。
1.2 方法
1.2.1 转基因小鼠的制作
重叠PCR技术扩增attB1-tdTomato-attB2基因片段,Gateway clone构建pDown-tdTomato转化到Stabl3大肠杆菌中,LB平板上37℃孵育过夜。提取pDown-tdTomato与母载体PRP.Des2s在25℃下进行LR反应3 h,将最终的表达载体PRP.Ex2d-EF1A>tdTomato转化到Stbl3中,完成载体构建。制备假孕母鼠和受孕母鼠,取出受孕母鼠的受精卵。将构建好的tdTomato表达载体通过DNA显微注射注入受精卵原核,转移至假孕母鼠的输卵管内,待其自然产下新生鼠。
1.2.2 转基因小鼠鉴定
双向鉴定法鉴定dTomato转基因小鼠,在波长500的多波段LED手电OF-500AC灯头下(绿色激发光)观察皮肤裸露处的荧光情况,同时剪取其尾尖0.5 cm,提取DNA进行PCR扩增,琼脂糖凝胶电泳鉴定阳性个体。鉴定引物:
Primer I:CTCTGCTGCCTCCTGGCTTCT,
Primer II:CGAGGCGGATCACAAGCAATA,
Primer III:TCAATGGGCGGGGGTCGTT。
灌注阳性转基因小鼠后,取其脑、肝、肺、心脏、脾组织,石蜡包埋制片后,进行HE染色,置于荧光显微镜下观察各个组织的荧光表达情况。
1.2.3 转基因小鼠的建系
取6只鉴定为阳性的原代小鼠与野生型小鼠进行配种繁殖,并将子代中的阳性小鼠继续交叉配种繁殖。在实验动物中心的屏障环境中进行饲养育种,定期送检微生物和寄生虫。
1.2.4 检测转基因小鼠的生长性状和生化指标
取tdTomato转基因小鼠进行眼眶静脉丛采血后,检测生理生化指标检测,测定肝功能、肾功能、血脂等指标,与正常野生小鼠进行统计学分析,检测差异有无显著性。
1.2.5 tdTomato转基因小鼠NSCs的分离与培养
取孕龄为13 ~ 14 d的tdTomato转基因小鼠处死后常规消毒,取出胎鼠,剔除头骨,剥去蛛网膜及小脑,将脑组织放入有培养基的培养皿中吹打至组织消失,200目过滤筛过滤后,离心弃上清,加入培养基充分混匀后转移至培养瓶中,放于细胞恒温箱中培养,每2天半量换液。待培养至3代后,利用免疫荧光术检测神经干标记蛋白Nestin的表达,验证培养所得细胞为NSCs。
1.2.6 tdTomato转基因小鼠提取细胞移植示踪实验
收集第3代的NSCs,离心后将细胞浓度调至1×107/mL。同时制备仅将胸段9T-11T脊髓椎板切除但无任何其他损伤的小鼠模型,使用微量注射泵注入5 μL的NSCs。3 d后利用Bruker Xtreme系统多模式成像系统进行观察拍照。
1.2.7 绿色荧光小鼠BMSCs与红色荧光小鼠NSCs的共培养
从eGFP转基因小鼠的胫、股骨骨髓中分离出BMSCs,采取贴壁法培养,放于细胞恒温箱中培养,每2 ~ 3天换液。传至第3代后,利用免疫荧光术检测细胞特异性标志物(CD44/CD34),并结合细胞形态学分析,证明培养所得细胞为BMSCs。
将上述所得eGFP小鼠3代的BMSCs、tdTomato小鼠的3代NSCs均以1×106/mL的细胞密度接种于六孔板中,观察两种干细胞在共培养后能让否稳定的表达自身的荧光。
1.2.8 绿色荧光小鼠NSCs与红色荧光小鼠NSCs的共培养
按上述方法,分别提取eGFP、tdTomato转基因胎鼠的NSCs,常规操作后,加入统一培养瓶中进行共同培养。培养至3代时,将NSCs接种于六孔板里,观察其贴壁分化后能否稳定表达自身的荧光特性。
1.3 统计学分析

2 结果
2.1 tdTomato转基因小鼠的制作与鉴定
首批构建阳性tdTomato转基因小鼠共9只,4雌5雄。新生小鼠置于OF-500AC灯头下,阳性小鼠自发红色荧光,而阴性小鼠不发荧光(图1A)。提取阳性和阴性小鼠的DNA,凝胶电泳分析表明阳性结果可见在200 ~ 400 bp之间有双条带,阴性结果仅在300 ~ 400 bp之间有单条带(图1B)。剪取阳性转基因小鼠与野生小鼠1 cm鼠尾进行观察,可见在白光源下鼠尾无明显差别,在激发光下转基因小鼠的鼠尾自发红色荧光而正常野生小鼠无荧光表现(图1C-D)。经双向鉴定结果显示,激发光下能自发荧光的转基因小鼠,其DNA鉴定结果亦为阳性。
将tdTomato转基因阳性小鼠进行灌注,取其脑、肝、肺、心脏、脾进行石蜡包埋制片,HE染色后镜下观察(图2A-E)。再置于荧光显微镜下观察,可见红色荧光的稳定表达,表明灌注固定包埋切片等常规处理不会影响转基因小鼠的荧光表达情况(图2a-e)。并且,对比HE染色,红色自发荧光更能明显的辨别各个组织切片的形态学特征。
2.2 转基因小鼠的建系以及与正常小鼠生长性状和生化指标的对比
转基因小鼠饲养于山西医科大学实验动物中心的屏障环境中,期间送检微生物和寄生虫,检查结果符合清洁级实验动物要求。转基因小鼠生长状态稳定,经两年繁殖,现有转基因鼠260余只,其中阳性鼠有208只,总阳性率高达80%,且已有个别小鼠一胎全为阳性。随机选取20只阳性转基因小鼠的外周血检测生理生化指标,与20只野生型小鼠进行对比,其差异无显著性(P> 0.05)。表明tdTomato基因不会影响小鼠的正常生长发育,符合正常实验动物的基本指标。(表1)
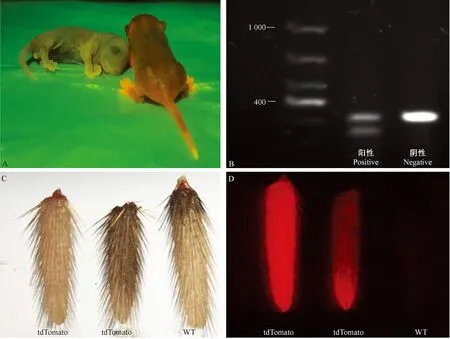
注:A:新生小鼠阳性与阴性在激发光下的对比。B: 凝胶电泳的鉴定结果。C-D: 转基因小鼠与野生小鼠的鼠尾在正常光源下和激发光下的对比。图1 转基因小鼠鉴定结果Note. A, Comparison of positive and negative new born mice under excitation light. B, Identification results of gel electrophoresis. C-D, Comparison of the tails of transgenic and wild mice under normal light (C) and excitation light (D).Figure 1 Identification results of transgenic mice

图2 tdTomato阳性小鼠组织切片结果Figure 2 Results of tissue sections from tdTomato-positive mice
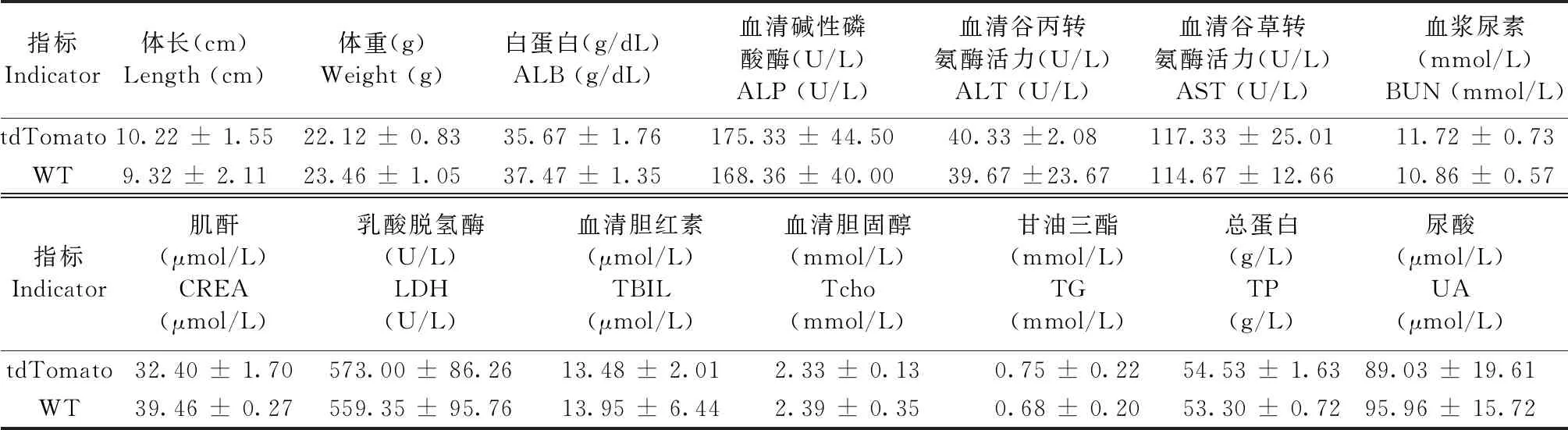
指标Indicator体长(cm)Length (cm)体重(g)Weight (g)白蛋白(g/dL)ALB (g/dL)血清碱性磷酸酶(U/L)ALP (U/L)血清谷丙转氨酶活力(U/L)ALT (U/L)血清谷草转氨酶活力(U/L)AST (U/L)血浆尿素(mmol/L)BUN (mmol/L)肌酸激酶(U/L)CK (U/L)tdTomato10.22 ± 1.5522.12 ± 0.8335.67 ± 1.76175.33 ± 44.5040.33 ± 2.08117.33 ± 25.0111.72 ± 0.73611.67 ± 151.02WT 9.32 ± 2.1123.46 ± 1.0537.47 ± 1.35168.36 ± 40.0039.67 ± 23.67114.67 ± 12.6610.86 ± 0.57684.33 ± 127.88指标Indicator肌酐(μmol/L)CREA (μmol/L)乳酸脱氢酶(U/L)LDH (U/L)血清胆红素(μmol/L)TBIL (μmol/L)血清胆固醇(mmol/L)Tcho (mmol/L)甘油三酯(mmol/L)TG (mmol/L)总蛋白(g/L)TP (g/L)尿酸(μmol/L)UA (μmol/L)tdTomato32.40 ± 1.70573.00 ± 86.2613.48 ± 2.012.33 ± 0.130.75 ± 0.2254.53 ± 1.6389.03 ± 19.61WT39.46 ± 0.27559.35 ± 95.7613.95 ± 6.442.39 ± 0.350.68 ± 0.2053.30 ± 0.7295.96 ± 15.72
2.3 tdTomato转基因小鼠NSCs的鉴定
图3A和3a可见细胞球在绿色激发光下自发红色荧光,表明细胞在体外培养至3代仍然可以稳定的自发红色荧光;图3B和3b可见细胞球呈现绿色荧光,即细胞球呈现Nestin抗原阳性;图3C和3c可见明显的蓝色荧光,即Hochest对细胞核的染色,以上数据证明所培养的细胞为NSCs。

图3 tdTomato转基因小鼠NSCs的鉴定结果Figure 3 Identification results of NSCs from tdTomato transgenic mice
2.4 tdTomato转基因小鼠提取细胞移植示踪实验
收集第3代的NSCs,注入小鼠的胸段脊髓中,3 d后利用Bruker Xtreme系统多模式成像系统进行观察,可见小鼠的注射部位有红色荧光信号(图4)。表明tdTomato转基因小鼠的荧光表达稳定,能够支持活体细胞移植示踪实验,可提供实验需要的观察和数据。

图4 tdTomato转基因小鼠NSCs移植示踪成像图Figure 4 Tracer imaging of NSCs transplantation in tdTomato transgenic mice
2.5 共培养实验结果
将eGFP绿色荧光小鼠的3代BMSCs,分别置于OF-365AUV灯头下(蓝紫色激发光)及正常光源下观察,视野内可见自发绿色荧光的梭形贴壁细胞,分布均匀且形态纤长,与BMSCs的形态学特征相符(图5A、5a)。经过免疫荧光化学鉴定,可见图5b中的红色荧光呈现出与图5B中绿色荧光细胞基本相吻合的规则细胞形态,表示CD44阳性;图5c中可见零散的红色背景噪音,与图5C中的绿色荧光细胞相比,无任何细胞形态,表示CD34阴性。

注:A-C: BMSCs在荧光显微镜下可见绿色荧光蛋白的表达。a: BMSCs在正常光源下的观察图。b:BMSCs的CD44阳性鉴定。c:BMSCs的CD34阴性鉴定。图5 BMSCs培养以及鉴定结果Note. A-C, Expression of green fluorescent protein in BMSCs under fluorescence microscope. a, Image of BMSCs under normal light. b, CD44 positive cells of BMSCs. c, CD34 negative cells of BMSCs.Figure 5 Culture and identification results of BMSCs
将eGFP小鼠3代BMSCs和tdTomato小鼠3代NSCs接种同一盖玻片上共培养,分为4、12、24、48 h进行拍摄记录(图6)。接种4 h后,可见红色NSCs与绿色BMSCs尚未分化;12 h后可见红色NSCs呈不规则圆形,绿色BMSCs也开始分化;24 h后可见红色NSCs和绿色BMSCs均有明显的分化,且分化的过程中,两种干细胞的分化末枝会交叠缠绕在一起;48 h后可看到大片红色NSCs和绿色BMSCs分化后交叠在一起的细胞培养图,红绿荧光颜色明显,表明tdTomato转基因小鼠的红色荧光,在参与两种荧光干细胞共培养实验时,能够稳定表达自身的红色荧光,不会因为干细胞的分化而猝灭也不会受到异色荧光的干扰。
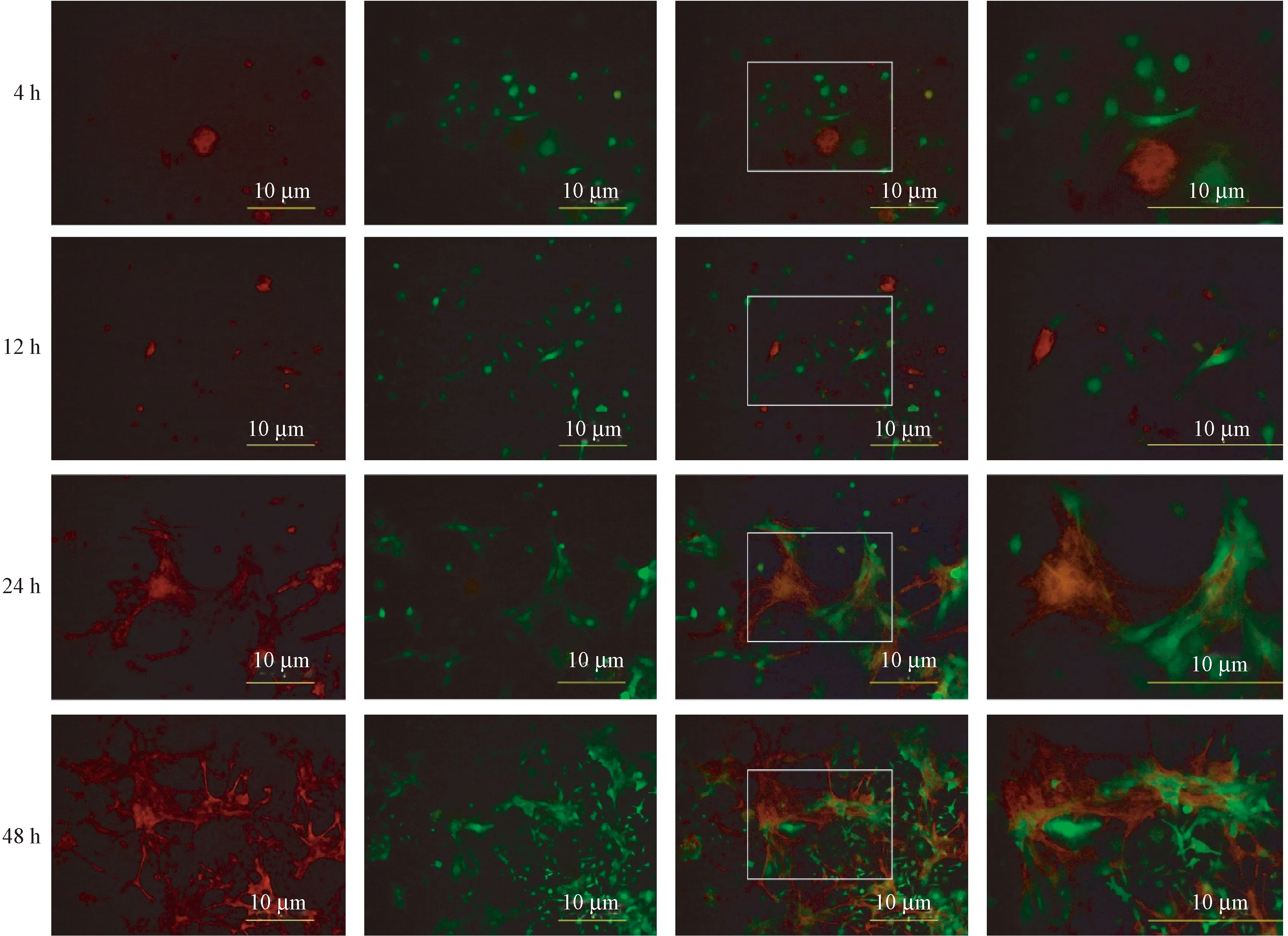
图6 红色NSCs和绿色BMSCs共培养4、12、24、48 h的分化情况Figure 6 Differentiation of red NSCs and green BMSCs in co-culture for 4, 12, 24 and 48 h
取tdTomato、eGFP转基因胎鼠的脑源原代NSCs,共培养于同一培养瓶中,传至3代后接种于多聚赖氨酸处理过的盖玻片上观察(图7)。接种4 h后,可见NSCs球红绿相间且呈不规则圆形;1 d后,细胞球可见分化末枝,且红绿均有,表明两种NSCs的分化较为同步;2 d后,可见红绿色NSCs均有较多分化末枝,且叠加交织在一起。说明NSCs球可由多个异源NSCs聚集而成,并非只能由单个NSCs增殖而成。
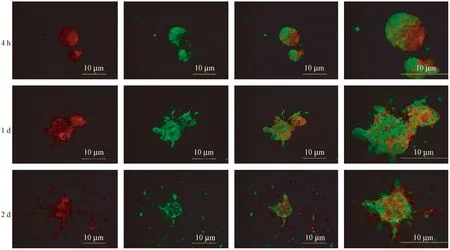
图7 红色NSCs和绿色NSCs共培养4 h、1 d和2 d的分化情况Figure 7 Differentiation of red NSCs and green NSCs in co-culture for 4 h, 1 d and 2 d
3 讨论
随着现代科研水平的发展和深入,干细胞的培养和应用也是研究者面临的问题。但凡涉及到干细胞共培养实验或者干细胞移植治疗实验,均会使用细胞标记技术。但是细胞标记术大多存在稳定性差,会被一些物理化学等因素破坏降解,或者随着被标记细胞的增殖分化造成荧光的衰减,使其很难维持长时间的高标记率,从而影响在实验中对时间的掌控等问题[17]。例如使用慢病毒转染来构建表达荧光蛋白的细胞,操作复杂、过程繁琐、耗时较长,对实验人员操作要求较高,并且转染后可能影响细胞活性。对于大量需要荧光标记细胞且重复率高的实验来说,荧光蛋白转基因小鼠的构建是一劳永逸的解决方法。本课题组在之前的研究中,已经成功构建了eGFP转基因小鼠,并完成一系列相关实验,证实了转基因荧光小鼠在各种实验中,其荧光蛋白均能稳定表达,不会因为多聚甲醛固定或者石蜡包埋等常规实验操作而导致荧光强度的减弱或丢失[18-19]。
目前,NSCs虽然在脊髓损伤后的移植治疗已被证实是有效的,但其在实际中的获取及使用会涉及到伦理学等问题,这也阻碍了在临床应用中的发展[11-13]。而BMSCs是一类细胞来源多、分化范围广、免疫原性低的干细胞[20]。因此诱导BMSCs使其分化为NSCs或神经元从而解决NSCs在临床中的伦理问题成为了一种替代解决办法[21]。现本课题组为了研究NSCs和BMSCs共培养后对BMSCs分化的影响,仍需另外一种荧光鼠,进行双色荧光共培养实验。故本研究选取了相比eGFP表达更稳定、荧光亮度更强的tdTomato红色荧光蛋白,tdTomato已被证实相比eGFP更适合用于转基因动物的细胞迁移以及组织切片的观察,可以作为eGFP的最佳替代品[22]。根据文献报道,国内也有实验室完成了红色荧光小鼠的制作,但所使用基因多非tdTomato且很少有规范建系的报道[3-4]。在后期的建系中,我们与实验中常用的C57近交系实验小鼠相结合成功构建C57-tdTomato转基因小鼠,挑选阳性小鼠互交,完善tdTomato的近交系转基因小鼠的建设平台。近交系小鼠具有更纯正的谱系,是实验动物标准化的一部分,可减少误差,提高实验结果的可比性。
由上述实验结果可知,tdTomato转基因小鼠各常用组织可在OF-500AC灯头下自发红色荧光,其脑源NSCs可在体外培养至3代仍保持荧光的稳定表达。后与绿色荧光小鼠的多种干细胞进行共培养实验结果表明,荧光表达的稳定性不会因为自身干细胞的增殖分化或者细胞共培养时两种荧光标记蛋白互相影响而导致荧光表达的衰弱或猝灭,并且实验的时间跨度对荧光的表达水平也没有影响。双色NSCs的共培养更是说明了,NSCs球可以由多个异源NSCs的聚合而成。另外,在干细胞共培养的实验结果中,部分置于蓝色激发光下拍摄的细胞图中,隐约可见桔色NSCs的淡影,我们认为是由于tdTomato的荧光亮度相比eGFP强了3倍,是荧光蛋白中最亮的一种,且tdTomato的激发光波长更长,所以相比较eGFP更容易被激发[23],此部分不影响任何实验结果且更易于直观的细胞镜下观察。现今,已将tdTomato转基因小鼠投入到实验室的实验工具用鼠中。本课题组,结合之前的实验研究,已经完成了双色转基因荧光鼠的平台构建,后续,本课题组将使用双色荧光鼠来开展对小鼠BMSCs与NSCs共培养后细胞分化方向的影响以及对脊髓损伤治疗作用的研究。选取不同荧光颜色的BMSCs和NSCs,能更加快捷、直接地观察到神经元和胶质细胞增殖分化的状态,省去了反复进行细胞标记的繁琐步骤,从根本上保障了被研究干细胞的一致性。同时,完善双色转基因荧光鼠平台的构建,确保能够提供高质量、高稳定性、高阳性率的荧光工具鼠。
