诸氏鲻虾虎鱼出血病病原鉴定及传播途径分析
2020-05-06余露军李建军蔡磊黄韧
余露军,李建军,蔡磊,黄韧
(广东省实验动物监测所,广东省实验动物重点实验室,广州 510663)
诸氏鲻虾虎鱼(Mugilogobiuschulae)属于鲈形目(Perciformes)、虾虎鱼亚目(Gobioidei)、虾虎鱼科(Gobiidae)、鲻虾虎鱼属(Mugilogobius),在我国南海、东海等西太平洋近海海域广泛分布,是我国实验动物化水平最高的本土海洋实验鱼类,具有体形小、胚胎透明、繁殖量大、繁殖周期短等特点[1]。虾虎鱼已在海洋环境重金属[2]、多环芳烃[3]等多种污染物的毒性评价和疾病模型研究[4]中广泛应用,显示出良好的应用前景。
广东省实验动物监测所先后开展虾虎鱼全人工繁殖、封闭群和近交系培育,以及种质、遗传、微生物和寄生虫、饲料及环境设施等质量控制标准体系研究[1],其中病原项目是虾虎鱼质量控制的重要内容。目前,已有迟缓爱德华菌[5]、创伤弧菌[6]感染引起虾虎鱼“溃烂病”和“败血症”的研究报道,而对虾虎鱼“出血病”的病原研究尚未见报道。石斑鱼、对虾等多种水生经济动物研究表明,外来动物个体、生物饵料、水源是水生动物病原传播的主要途径[7-8]。相对经济鱼类而言,实验鱼的养殖条件相对封闭和可控,病原传播途径和风险也可能有所不同,但相关研究鲜有报道。本文对野外采样的患出血病虾虎鱼进行病原分析,并对不同来源的海水、生物饵料、鱼体等样品进行了病原检测,探讨实验鱼病原传播途径,为虾虎鱼微生物质量控制及病原防控策略提供依据。
1 材料与方法
1.1 材料
1.1.1 实验鱼
患病诸氏鲻虾虎鱼体长2.5 ~ 3.5 cm,取自深圳大鹏湾野生群。回归感染实验用诸氏鲻虾虎鱼为本实验室封闭群子14代,4 ~ 5月龄,体长2.5 ~ 3.0 cm,循环水养殖,盐度20 ~ 22,温度25 ~ 27℃,光照:黑暗时间为14 h:10 h。
1.1.2 试剂与仪器
脑心浸液培养基(Brian Heart Infusion Medium, BHI)(广州环凯公司,中国);细菌基因组试剂盒(天根公司,中国);Taq酶(TaKaRa,日本)。
生物显微镜(Nikon Ci-S,日本);电子天平(常熟双杰测试仪器厂,中国);ATB全自动细菌鉴定仪(梅里埃公司,法国);PCR扩增仪(Techne Prime,英国);凝胶电泳仪和成像系统(Bio-Rad,美国)。
1.2 方法
1.2.1 病原菌的分离、纯化
挑选腹部红肿的个体,无菌操作解剖病鱼,并从肝脏部位取样划线接种于BHI平板,28℃恒温培养24 h后,挑取优势菌落在同样条件下进行纯化培养,用于细菌鉴定。
1.2.2 细菌鉴定
(1)生化鉴定:观察分离纯化的菌落形态,并通过革兰氏染色、氧化酶试验以及API ID32E试剂条进行鉴定。
(2)分子生物学鉴定:按细菌基因组试剂盒说明书提取新鲜培养菌液的DNA,按Zhang等[9]的方法对嗜水气单胞菌gryB基因进行PCR扩增,参照饶静静等[10]的方法对嗜水气单胞菌溶血素基因(hlyA)和气溶素基因(earA)进行双重PCR扩增(引物浓度1∶3),引物序列见表1。gryB基因PCR反应条件为:95℃ 4 min,94℃ 30 s,55℃ 30 s,72℃ 60 s,30个循环,72℃延伸10 min。aerA和hlyA基因双重PCR反应条件为:95℃ 4 min,94℃ 30 s,60℃ 30 s,72℃ 60 s,30个循环,72℃延伸10 min。gryB基因PCR产物纯化后送上海生工进行序列测定,测序结果在NCBI进行Blast分析,选取相似序列MEGA 4软件构建系统发育树。
1.2.3 回归感染
挑取优势菌纯化后的单菌落接种于BHI液体培养基,28℃、180 r/min震荡培养24 h,新鲜培养的菌液6000 r/min离心3 min后,弃上清,无菌生理盐水重悬,用ATB比浊仪将菌液等比稀释至1.8 × 108~ 1.8 × 104cfu/mL。选取健康诸氏鲻虾虎鱼封闭群个体,每组10尾,腹腔注射,每尾注射0.02 mL菌液,同时设置生理盐水对照组。人工感染期间不投喂,静水养殖,水温25 ~ 26℃,盐度20 ~ 22,每天记录死亡数量并及时捞出死鱼,连续观察10 d。按周一平[11]的方法计算半致死量(median lethal dose, LD50)。从感染后症状明显的个体肝脏组织再次进行细菌分离和回归感染。

表1 试验所用引物序列Table 1 Sequences of the primers used in the experiment
1.2.4 病原传播途径分析
(1)样品采集
2016年3月 ~ 6月,先后从深圳大鹏湾、番禺南沙以及惠州大亚湾采集野生虾虎鱼(共3批次),3、5、8月分别取本实验室培育的虾虎鱼封闭群(4 ~ 5月龄,体长2.5 ~ 3.0 cm,共3批次);从海南琼海、福建漳州、惠州大亚湾购买野生轮虫(各2批次),3、5、8月分别取本室内培育轮虫(共3批次);从广州芳村花鸟鱼虫市场购买市售6个商品化的卤虫卵;3、5、8月分别取购买的天然海水和封闭群养殖水样品(各3批次)。各批次样品取样方法如下:
鱼:随机取3尾虾虎鱼的肝、脾组织混合为一个样品;卤虫:卤虫卵在实验条件下[漂白水消毒处理的洁净海水盐度28 ± 2,水温(28 ± 1)℃,光照2000 Lux]孵化24 h后,新孵出的卤虫无节幼体经洁净海水清洗3次,取0.1 mg(鲜重)卤虫无节幼体作为一个样品;轮虫:轮虫用300目纱绢网收集,并用洁净海水清洗3次,取0.1 mg(鲜重)轮虫作为为一个样品;水:随机取新购天然海水和虾虎鱼封闭群养殖水各10 mL为一个样品。
(2)样品处理
无菌条件下,将鱼的肝脾组织、卤虫、轮虫匀浆后,按体积比1∶9加入灭菌碱性蛋白胨水;水样8000 r/min离心3 min后,弃上清,用10 mL灭菌碱性蛋白胨水重悬;28℃、150 r/min增菌培养12 h后,取2 mL增菌液12000 r/min离心收集细菌,采用细菌基因组试剂盒提取总DNA。
(3)样品检测
按1.2.2(2)的方法对嗜水气单胞菌毒力基因hlyA和earA进行双重PCR扩增,检测致病性嗜水气单胞菌。
2 结果
2.1 诸氏鲻虾虎鱼出血病症状
患病虾虎鱼身体发黑,聚群沉底,活力下降,反应迟钝;腹部(尤其是肛门处)红肿充血;下颌及胸鳍、腹鳍基部出血,鳍条缺损;剖检可见腹腔有积水,肠系膜有出血点,并附着淡红色粘液。
2.2 分离株形态与生化特性
从临床症状典型个体的肝脏部位分离获得优势菌(编号PYMc15-1),BHI平板28℃培养24 h后,PYMc15-1菌落呈圆形凸起、淡黄色、半透明、表面光滑、直径约1.0 ~ 1.5 mm,有特殊气味。革兰氏染色显示为阴性、杆菌,氧化酶反应为阳性。ATB全自动细菌鉴定仪鉴定为嗜水气单胞菌,鉴定结果ID:99.9%,T值:0.72,详细生化结果见表2。回归感染后二次分离的优势菌PYMc15-1’生化特性与PYMc15-1一致。
2.3 gryB基因序列分析
菌株PYMc15-1经嗜水气单胞菌gryB基因引物PCR扩增获得800 bp左右目的片段,hlyA和aerA基因双重PCR扩增获得800 bp和1300 bp左右目的片段(图1)。gryB产物序列Blast分析结果显示,菌株PYMc15-1与GenBank上登陆的嗜水气单胞菌(登录号 KX822741)同源性最高(98.5%)。菌株PYMc15-1gryB序列聚类分析显示,PYMc15-1与嗜水气单胞菌自然聚类(图2)。上述结果表明,菌株PYMc15-1为嗜水气单胞菌,并具有潜在的致病性。
2.4 人工感染
人工感染健康虾虎鱼后第2天开始出现死亡,第3天、第4天为高峰,死亡个体腹部和肛门红肿充血,腹腔有大量积水。从第4天死亡个体肝脏部位分离细菌,获得优势菌PYMc15-1,再次回归感染健康虾虎鱼,出现相似症状,表明本次试验分离的优势菌PYMc15-1为虾虎鱼出血病病原。
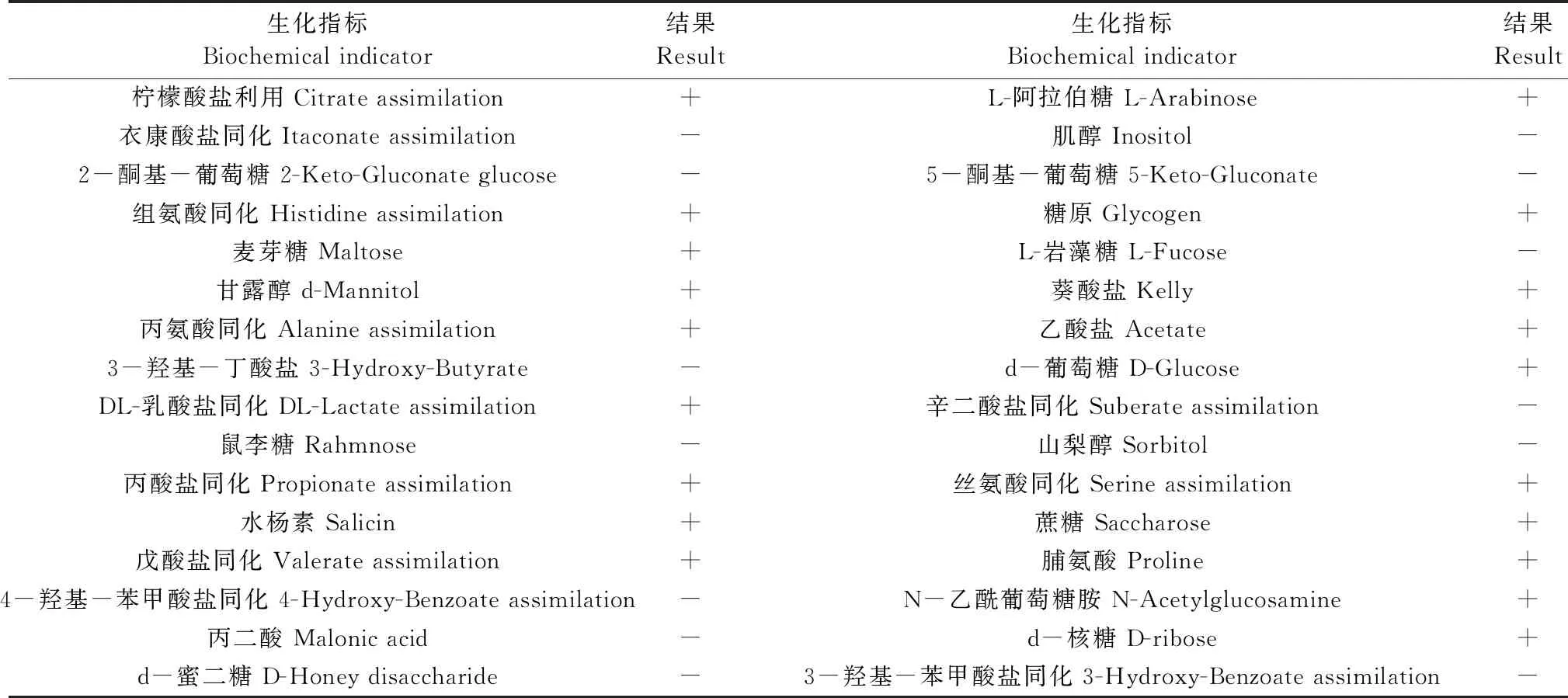
表2 菌株PYMc15-1生化鉴定结果Table 2 Results of biochemical identification of strain PYMc15-1
注:“+”阳性;“-”阴性。
Note. “+” is positive; “-” is negative.
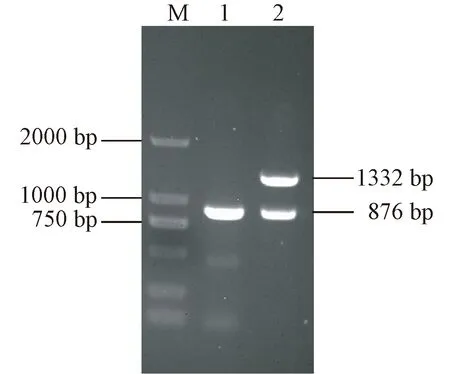
注:M为DL2000 bp Marker; 1为gryB基因PCR产物;2为aerA基因和hlyA基因双重PCR产物。图1 菌株PYMc15-1 gryB基因、aerA基因和hlyA基因PCR检测电泳图Note. M, DNA Marker DL 2000. 1, PCR product of gryB gene. 2, PCR products of aerA gene and hlyA gene.Figure 1 Electropherogram of strain PYMc15-1 gryB gene, aerA gene and hlyA gene of detected by PCR
不同浓度的PYMc15-1菌液人工感染试验结果显示,2.1×108cfu/mL浓度组实验鱼全部死亡,生理盐水对照组实验鱼无死亡,菌株PYMc15-1对虾虎鱼的LD50为每尾1.2×104cfu(表3)。
2.5 虾虎鱼、生物饵料及水的致病性嗜水气单胞菌检测
PCR检测结果显示,野生虾虎鱼(1/3)、卤虫无节幼体(1/6)和野生轮虫(2/6)分别检出致病性嗜水气单胞菌,室内培育的轮虫以及天然海水、虾虎鱼封闭群养殖水均未检出致病性嗜水气单胞菌。
3 讨论
本研究从患病虾虎鱼肝脏分离到优势菌株PYMc15-1,经生物学特性、生化鉴定和gryB基因序列同源性分析,鉴定为嗜水气单胞菌,并通过回归感染确定为虾虎鱼出血病病原,对虾虎鱼具有较强的致病性(LD50为每尾1.2×104cfu),为我国海水实验鱼——虾虎鱼感染嗜水气单胞菌的首次报道。嗜水气单胞菌属弧菌科、气单胞菌属,广泛存在于水体、淤泥等环境中,具有广泛的致病性,可引起多种海、淡水水生动物爆发性出血病,常造成水产养殖重大的经济损失[12-13]。嗜水气单胞菌也是我国农业部《一、二、三类动物疫病病种名录》(2008年)规定的二类疫病病原,需要采取严格控制、扑灭等措施,防止扩散的病原[14]。同时,我国淡水实验鱼斑马鱼和剑尾鱼已有嗜水气单胞菌感染导致细菌性败血症的报道[15-16];国内19家斑马鱼实验室调研结果发现,斑马鱼竖鳞、腹水是常见病害症状,虽然其病原尚未研究证实,但由于该症状与嗜水气单胞菌感染鱼类引起的临床症状类似[17-18],因此斑马鱼“竖鳞病”、“腹水病”很可能与嗜水气单胞菌感染有关。上述结果表明,嗜水气单胞菌对虾虎鱼、斑马鱼等海、淡水实验鱼均具有严重危害,在实验鱼生产和实验过程中应引起足够的重视并加以控制。

注: 节点处数值为自展重复1000次的置信值。图2 基于气单胞菌属gryB基因序列的系统发育树Note. The degree of confidence for each branch point was determined by bootstrap analysis (1000 repetitions).Figure 2 Phylogenetic tree based on gryB gene sequences of Aeromonas
表3 菌株PYMc15-1对虾虎鱼攻毒试验结果
Table 3 Results of of challenge test with strain PYMc15-1 inM.chulae

菌液浓度(cfu/mL)Bacterial concentration(cfu/mL)试验鱼数(尾)Number of test fish死亡数(尾)Number of deaths半致死浓度(cfu/fish)LD50(cfu/fish)2.1 × 10810102.1 × 1071072.1 × 1061052.1 × 1051042.1 × 104103生理盐水Physiological saline1001.2 × 104
gyrB是普遍存在于细菌中编码DNA促旋酶亚基B蛋白的单拷贝基因,每100万年的平均碱基替换率为0.7% ~ 0.8%,其进化速率较16S rRNA快,且不发生水平转移,特别适用于气单胞菌、芽孢杆菌等近缘种的区别和鉴定[19-20]。气单胞菌属中常见的鱼类病原菌多达20余种,其中多个菌种亲缘关系接近,通过16S rRNA基因序列分析无法有效区分[21]。本研究对生化鉴定为嗜水气单胞菌的分离株PYMc15-1进行gyrB基因测序分析,其序列与已知的嗜水气单胞菌(登录号 KX822741)同源性达98.5%,与同属不同种的温和气单胞菌(HQ442698)同源性则低于91.7%,显示出较高的分辨率,可判定分离株PYMc15-1为嗜水气单胞菌。值得注意的是,嗜水气单胞菌有致病性菌株和非致病性菌株之分,朱大玲等[22]、王远微等[23]研究发现,只有致病性嗜水气单胞菌aerA基因呈阳性扩增;饶静静等[10]在致病性嗜水气单胞菌中至少扩增到aerA或hlyA基因的一种,可见aerA基因和hlyA基因是致病性嗜水气单胞菌最为关键的毒力基因。本实验对分离株PYMc15-1aerA基因和hlyA基因进行检测,结果显示为阳性;回归感染试验也表明该菌株对虾虎鱼具有致病性,表明分离株PYMc15-1为致病性嗜水气单胞菌。
PCR检测方法已成为国外大型实验动物机构在实施实验动物质量监测和病原体诊断中的重要手段,在我国啮齿类实验动物病原检测中已有较多应用[24-25]。病原的传播主要有水平传播和垂直传播两种途径,大多数水生动物病原的传播以水平传播为主[26]。本研究采用嗜水气单胞菌hlyA基因和aerA基因特异性引物对虾虎鱼养殖过程相关的鱼、生物饵料、水等样品进行致病性嗜水气单胞菌检测,结果发现,野生虾虎鱼、卤虫和野生轮虫部分样品检出阳性,表明野生鱼体、卤虫和野生轮虫是嗜水气单胞菌潜在的传播媒介,这与Yan等[27]、Zhang等[28]、宋晓玲等[29]研究结果一致。本实验中虾虎鱼封闭群及其养殖水、室内净化培育的轮虫均未检出致病性嗜水气单胞菌,说明通过鱼体隔离净化、水体消毒以及轮虫净化培育能有效控制病原的传播。不同来源、不同批次的6个卤虫样品检测中,有1个样品检出致病性嗜水气单胞菌,表明通过病原检测筛选合格的卤虫是必要的。鉴于生物饵料可能携带病原的情况,建议使用生物饵料时应采用净化培育、消毒等处理措施,并对各批次生物进行病原检测,以控制其病原微生物质量。
