线粒体靶向抗氧化剂MitoQ在猪卵母细胞冷冻保存中的应用
2020-05-06王文杰张树山吴彩风戴建军张德福
王文杰,葛 雷,张树山,吴彩风,戴建军,张德福*
(1 上海海洋大学水产与生命学院,上海201306;2上海市农业科学院畜牧兽医研究所,上海 201106;3上海市农业遗传育种重点实验室动物遗传工程研究室,上海201106)
哺乳动物配子及胚胎冷冻保存在种质资源保存和跨区域种质资源交流上具有重要意义。近年来,玻璃化冷冻技术已经有了很大的进步,但由于猪卵母细胞内脂肪含量较高,对低温较为敏感,极易受到低温损伤,冷冻后发育能力与其他动物相比较低[1-2]。线粒体是哺乳动物卵母细胞中重要的细胞器之一,是细胞内三磷酸腺苷(ATP)的提供者和早期胚胎发育的唯一能量来源,在卵母细胞和胚胎发育中具有十分重要的作用。有研究表明,玻璃化冷冻破坏了人[3]和牛[4]卵母细胞线粒体功能,降低了ATP含量,这可能是导致冷冻保存后卵母细胞发育能力低下的原因之一[4]。氧化应激和细胞凋亡也被认为是卵母细胞冷冻后活力下降的主要因素[5-6]。线粒体靶向抗氧化剂MitoQ是一种特效作用于线粒体,通过降低线粒活性氧水平、减少氧化应激来保护线粒体功能的抗氧化剂[7]。目前,线粒体靶向抗氧化剂MitoQ在猪卵母细胞冷冻保存应用方面未见相关报道。本试验在猪卵母细胞冻后孵育液中添加MitoQ,研究线粒体膜电位、氧化应激水平、凋亡状态、发育能力和相关基因表达水平,以期探讨MitoQ对猪卵母细胞冻后发育的影响及可能的作用机理。
1 材料与方法
1.1 主要试剂
常规生化试剂除特别说明外均购自美国Sigma Aldrich公司,培养液购自美国Gilbco公司。
1.2 猪卵母细胞的采集和体外成熟培养
在屠宰场采集新鲜猪卵巢,置于含有青链霉素的37℃生理盐水中,于2 h内运回实验室。使用18号针头的10 mL注射器抽取卵巢表面直径为2—6 mm的卵泡。在显微镜下选取胞质均匀且至少有3层完整颗粒细胞包围的卵母细胞复合体(cumulus-oocyte complexes,COCs)。COCs首先用台式液清洗3次,再用TCM-199洗3次,然后置于四孔板中培养44 h。每60枚COCs置于500 μL体外成熟培养液中培养,体外成熟培养液为TCM-199加10%猪卵泡液(实验室自制),加入10 IUmL孕马血清促性腺激素(宁波第三激素制品有限公司),10%胎牛血清,10 IUmL双抗,0.1 mgmL L-半胱氨酸和10 ngmL表皮生长因子。培养条件为38.5℃、5%CO2及饱和湿度。成熟培养44 h后用0.1%透明质酸酶消化,选择形态均一且排出第一极体的猪卵母细胞用于冷冻保存。
1.3 玻璃化冷冻和解冻
猪卵母细胞的玻璃化冷冻和解冻均在38.5℃的热台上进行,具体方法参考吴彩凤等[8]。先将猪卵母细胞在冷冻保护液I[7.5%乙二醇(EG)+7.5%二甲基亚砜(DMSO)+10%胎牛血清(FBS)]中平衡处理3—5 min,然后移入冷冻保护液II(17%EG+17%DMSO+10%FBS+0.4 molL蔗糖)中, 平衡15—20 s后用OPS装载,并迅速投入液氮中保存。解冻时,将OPS管中的细胞置于含有0.5 mmolL蔗糖的培养液中平衡3—5 min,然后转入含0.25 mmolL蔗糖的培养液中继续平衡3—5 min,TCM-199洗3次。解冻后的对照组为在含有10%FBS的TCM-199孵育液中孵育2 h;MitoQ处理组为在含有200 nmolL MitoQ的孵育液中孵育2 h。
1.4 猪卵母细胞冻后存活率和孤雌发育能力的测定
猪卵母细胞冻后存活率采用FDA染色方法测定。将各处理组的卵母细胞置于5 mgmL FDA染色中38.5℃染色5 min,洗涤后于荧光显微镜(LSCM,Nikon,日本)下观察拍照,发强绿色荧光视为存活。猪卵母细胞冻后体外发育能力采用孤雌激活法测定。处理好的猪卵母细胞在电激活液中洗3次,移入铺满激活液的激活槽,均匀排列,以1.2 kVcm的直流电压激活30 μs。激活后的猪卵母细胞在PZM-3中洗3次,然后置于38.5℃、5%CO2及饱和湿度的培养箱中进行培养,分别在第2 天和第7天检测卵裂率和囊胚率。
1.5 线粒体膜电位检测
线粒体膜电位ΔΨm检测采用JC-1试剂盒(碧云天生物技术公司)。猪卵母细胞在JC-1染液(含800 μL TCM-199和200 μL 5×染色液缓冲液)中避光38.5℃孵育20 min,染色缓冲液洗3次(保持染色缓冲液4℃)后置于共聚焦显微镜(LSCM,Nikon,日本)下观察拍照。使用Image-Pro Plus 6.0软件进行量化,分别记录绿色和红色荧光信号强度,各猪卵母细胞红色(RITC)和绿色(FITC)荧光强度的比值即为ΔΨm。
1.6 凋亡早期检测
使用Annexin V-FITC试剂盒(碧云天生物技术有限公司)对猪卵母细胞进行检测。处理后的猪卵母细胞用TCM-199洗3次,然后移入195 μL Annexin V-FITC结合液和5 μL Annexin V-FITC染液的混合液中,室温避光孵育10 min后移入190 μL Annexin V-FITC结合液和10 μL碘化丙啶染色液混合液中,冰浴避光10 min。TCM-199洗3次后在荧光显微镜下观察。
1.7 活性氧(ROS)检测
采用活性氧检测试剂盒检测。处理好的猪卵母细胞移入含有10 μmolL DCFH-DA的TCM-199中,在37℃培养箱内孵育20 min。用TCM-199洗3次,充分去除未进入细胞内的DCFH-DA。荧光显微镜下观察拍照,使用Image-Pro Plus 6.0分析荧光强度。
1.8 脂质氧化检测(MDA)
采用脂质氧化(MDA)试剂盒(碧云天生物技术有限公司)进行检测。处理好的猪卵母细胞加入150 μL细胞裂解液,待裂解后,1 600g离心10 min,取100 μL上清加入到含有事先配好的200 μL MDA检测工作液的离心管中,混匀后沸水浴加热15 min,水浴冷却至室温,1 000g离心10 min。取200 μL上清加入到96孔板中,用酶标仪在532 nm处测定吸光度。MDA值以μmolmg表示。
1.9 Pan-Caspase染色
Pan-Caspase原位荧光染色采用Promega(美国)公司试剂盒。将FITC-VAD-FMK用TCM-199 以1∶500稀释配成染色液,处理好的猪卵母细胞置于染色液中孵育20 min,TCM-199洗3次,然后在荧光显微镜下观察拍照。用Image-Pro Plus 6.0软件进行量化,分析荧光强度值。
1.10 凋亡相关基因表达检测
用一步法cDNA提取试剂盒(全式金生物技术有限公司,北京)提取试验组和对照组猪卵母细胞(各240枚)的cDNA。参考NCB I中猪卵母细胞凋亡相关基因的cDNA序列设计引物,以GADPH为内参基因。引物信息见表1,用SYBR Green I进行荧光定量Real-time PCR。按TransStart Top Green qPCR SuperMix试剂盒(全式金生物技术有限公司,北京)说明书配制20 μL反应体系:1 μL cDNA模板,0.4 μL Forward Primer(10 μmolL),0.4 μL Reverse Primer(10 μmolL),10 μL 2×TransStart Top Green qPCR SuperMix,8.2 μL ddH2O。反应程序为94℃ 30s;94℃ 5 s,60℃(参照各引物最佳退火温度而定)30 s,45个循环。所有样品均3次重复。相对表达量采用2-ΔΔCt法计算比较。
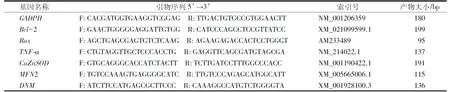
表1 qRT-PCR所用引物信息
1.11 数据分析
采用SPSS 13.0软件对试验数据进行统计分析,结果以“平均数±标准误”表示,P<0.05为差异显著。
2 结果与分析
2.1 冻后MitoQ处理对猪卵母细胞线粒体膜电位和凋亡水平的影响
冻后MitoQ处理组线粒体膜电位(0.66±0.06)与冻后对照组线粒体膜电位(0.47±0.05)相比显著升高,表明MitoQ处理能提高冻后猪卵母细胞线粒体功能。MitoQ处理后猪卵母细胞早期凋亡比率(43.00±3.51%)和总Caspase荧光强度值(5.88±0.27)与对照组(55.33±1.45和8.03±0.51)相比显著降低,表明MitoQ处理降低了冷冻后猪卵母细胞的凋亡水平。
图1中红色荧光与绿色荧光比值为线粒体膜电位,橙色荧光强度越高表示线粒体膜电位越高,MitoQ组复合通道下荧光强度高于对照组。图2中卵母细胞呈绿色荧光,表明细胞发生早期凋亡,冷冻后2个组均出现大量早期凋亡猪卵母细胞, MitoQ处理后凋亡下降明显。图3中荧光强度越高表示Pan-Caspase活性越高,MitoQ处理组猪卵母细胞荧光强度值显著下降。以上结果表明,冷冻后猪卵母细胞进行MitoQ处理提高了其线粒体功能,降低了其凋亡比例。
2.2 冻后MitoQ处理对猪卵母细胞氧化应激水平的影响
冻后MitoQ处理组猪卵母细胞的ROS水平(3.03±0.61)与对照组ROS水平(13.13±1.52)相比显著降低;MitoQ处理猪卵母细胞的MDA含量(20.54±0.91)与对照组(26.78±0.54)相比亦显著降低。由图4可见,活性氧(ROS)含量与绿色荧光正相关,冻后MitoQ处理组的绿色荧光强度显著低于对照组。上述结果表明,冻后猪卵母细胞孵育液中添加MitoQ可显著降低细胞氧化应激水平。
2.3 冻后MitoQ处理对猪卵母细胞存活和体外发育的影响
冻后MitoQ处理组猪卵母细胞的存活率(60.33%±1.86%)、卵裂率(28.82%±1.38%)、囊胚率(4.50%±0.48%)与对照组的存活率(47.67%±1.67%)、卵裂率(22.07%±1.07%)、囊胚率(2.20%±0.51%)相比均显著提高,表明冻后MitoQ处理能显著提高猪卵母细胞的体外发育能力。
2.4 线粒体功能和凋亡相关基因表达
如图5所示,冻后添加MitoQ处理的猪卵母细胞与对照组相比,线粒体氧化应激相关基因CuZnSOD相对表达量显著提升;线粒体功能相关基因Mfn2相对表达量显著提升,DNM1相对表达量显著下降;凋亡相关基因TNF-α、Bax相对表达量显著下降,Bcl-2相对表达量显著升高,表明冻后MitoQ处理能调控猪卵母细胞线粒体功能和凋亡相关基因的表达。
3 讨论
哺乳动物卵母细胞和早期胚胎中,线粒体作为极其重要的细胞器不仅产生ATP,还参与着许多重要的功能,如通过调控Ca2+、活性氧水平以及诱导细胞凋亡等,从而影响卵母细胞的发育能力[9]。线粒体靶向抗氧化剂MitoQ是由三苯基磷酸阳离子与辅酶Q10的苯醌部分通过一个十碳脂肪链共价结合而成,能够通过降低线粒体氧化损伤保护线粒体,从而降低细胞氧化应激水平,抑制细胞凋亡[10]。在帕金森病模型中,MitoQ可提高神经细胞的线粒体功能[7]。在人精子冷冻方面,刘丽等[11]发现MitoQ处理可改善精子氧化应激水平,提高精子活力。本试验在猪卵母细胞冷冻保存后孵育过程中添加200 nmolL MitoQ,显著提高了其冻后存活率和孤雌激活胚胎的发育能力,与上述研究相似。
线粒体膜电位的下降是细胞凋亡早期的标志性现象之一,膜电位下降,线粒体的功能受到影响。线粒体在凋亡相关信号引导下,膜通透性转换孔(PTP)开放,释放不同促凋亡因子,凋亡因子能够活化凋亡蛋白酶Caspase,激活后的Caspase能够促进更多的凋亡因子活化,通过级联反应启动凋亡程序。因此,线粒体膜电位和总Caspase荧光染色常被用于检测细胞凋亡水平。磷脂酰丝氨酸(PS)正常情况下分布在细胞膜内侧,在细胞早期凋亡时会由内侧转移至外侧,裸露在细胞膜表面,常用Annexin V-FITC进行早期凋亡检测。本试验表明,猪卵母细胞冻后MitoQ处理提高了线粒体膜电位水平,降低了Caspase活性和早期凋亡现象。这与Wani等[12]用MitoQ在小鼠脑组织中改善细胞凋亡水平的结果类似,也与Sun等[13]在肝癌细胞中的研究结果一致。
细胞冷冻后受到氧化损伤,细胞内生成大量的ROS是主要的氧化应激损伤原因[14]。细胞内活性氧的产生和清除正常情况下保持动态平衡,ROS过多时就会产生氧化应激,氧化应激使得细胞处于易损状态,并且能够产生过量的脂质过氧化产物MDA,破坏生物膜和细胞的正常功能,降低酶活性,诱导细胞大分子(脂质、蛋白质和DNA)氧化变性,抑制蛋白质功能,促进细胞凋亡[15]。本试验表明,冻后猪卵母细胞添加200 nmolL MitoQ能够明显降低细胞内ROS水平,减少MDA形成,该结果与Kelso等[16]用MitoQ降低大鼠肝细胞氧化应激水平的结果类似。这表明MitoQ能够有效降低猪卵母细胞冻后氧化应激水平,减少氧化应激损伤。
冷冻损伤主要体现在对线粒体功能造成负面影响,并且启动相关凋亡程序,线粒体受到损伤能够诱导细胞线粒体途径的凋亡[17]。本试验中,添加200 nmolL MitoQ处理冻后卵母细胞,与对照组相比,促凋亡相关基因Bax、TNF-α显著降低,抑制凋亡相关基因Bcl-2、CuZnSOD显著升高,表明MitoQ能够降低细胞凋亡水平,与Dai等[18]研究结果一致;线粒体融合蛋白Mfn2介导线粒体内外膜的融合,添加MitoQ能够显著提升Mfn2基因的相对表达量,降低线粒体分裂相关蛋白基因DNM1的表达水平,与谢南昌等[19]用线粒体分裂蛋白抑制剂来降低小胶质细胞凋亡和氧化损伤水平结果相符。总之,MitiQ可改善线粒体功能,降低细胞凋亡与氧化应激水平。
综上,添加MitoQ处理冻后猪卵母细胞,能提高其线粒体功能,缓解细胞氧化损伤,降低细胞凋亡水平,从而起到促进卵母细胞冻后体外发育水平的效果。本研究揭示了MitoQ作为新型冷冻保护剂的可能性,为卵母细胞冷冻提供了新思路。
