采用分子动力学模拟研究温度对乳球蛋白稳定性的影响
2020-05-04刘祥雨覃小丽钟金锋
刘祥雨,覃小丽,钟金锋
(西南大学 食品科学学院,重庆,400715)
牛乳营养价值高、易于消化且具有诸多保健功能。目前市面上的牛乳制品主要是液态制品和固态制品两大类,液态奶按杀菌方式又可分为巴氏杀菌奶和超高温瞬时杀菌奶[1]。牛乳在加工过程中必须经过加热杀菌以保证奶产品的质量安全,但加热时发生的一系列物理化学变化,如风味变化、营养物损失和蛋白质变性等[2],会影响乳制品的感官品质和稳定性,因此在牛乳生产加工过程中,适宜的温度对于牛乳的品质控制至关重要。
乳蛋白是牛乳中最重要的营养成分,超过60 ℃热处理就会造成其一定程度的变性,进而形成聚合体,影响乳制品的品质[3]。其中乳球蛋白是乳蛋白的重要成分,其空间结构是通过一些复杂作用力的平衡来维持,高温会导致空间结构的改变而引起变性。由于乳球蛋白的上述特性,研究其热稳定性对乳制品加工生产过程具有重要意义。SAKKAS等[4]研究表明液态乳中乳蛋白含量与牛乳加工过程中加热方式和程度显著相关。MAYER等[5]研究发现,生乳中乳球蛋白含量为3 261~5 215 mg/L,经过巴氏杀菌后的乳球蛋白含量下降50%,而超高温瞬时杀菌方式乳球蛋白含量降低90%。然而,上述研究尚未阐明乳品的不同典型加工温度对乳球蛋白结构的影响程度,无法确定乳球蛋白的变性温度,导致牛乳加工后乳蛋白含量不足,营养价值下降。目前研究乳球蛋白温度稳定性的方法主要集中在常规实验分析手段,还无法获取蛋白在微观层面的变化程度。随着科技发展,借助于分子动力学模拟的技术,有望获取蛋白分子以及原子水平上的丰富结构信息[6]。目前,借助分子动力学模拟研究蛋白质结构变化的模拟时间通常为10~50 ns[7-10],对蛋白质热加工变化程度在分子层面的信息获取还比较有限,因此,选择模拟时间为100 ns的分子动力学模拟的方法对乳球蛋白的热稳定性进行分析,有望获得较为丰富的蛋白质结构变化信息,为相关生产提供理论指导。
本研究采用分子动力学模拟的方法,研究乳球蛋白在水溶液环境中乳品的不同典型加工温度(25、45、70、100和120 ℃)对其影响,通过分析乳球蛋白的均方根误差、均方根波动值、溶剂可及表面积、回旋半径以及氢键等来获取乳球蛋白的结构变化信息,以期为乳品在典型加工过程中采取适宜加工温度提供有价值的参考。
1 材料与方法
分子动力学模拟使用GROMACS(version: 2019.03)软件包[11],可视化分析采用VMD(version: 1.9.3)软件[12]。乳球蛋白结构(PDB:3BLG),从RCSB蛋白质数据库网站中获得,对乳球蛋白结构进行除去结晶水和杂质离子预处理[13]。模拟过程使用GROMOS 54A7力场,分子模拟的温度设置分别为25、45、70、100和120 ℃。在模拟之前,应用周期性边界条件,制备一个体积为279.12 nm3的水盒子,使乳球蛋白与盒子边缘最小距离为1 nm,加入SPC水分子来填充水盒子,再加入钠离子中和体系电荷,以保证正确的渗透压和静电中性。使用最陡下降法进行体系能量最小化,然后在25 ℃下对乳球蛋白施加限制势进行100 ps模拟,使溶剂弛豫。
然后在5种温度下进行100 ns的分子动力学模拟。使用LINCS算法约束与氢相连的键;采用SPME方法计算静电作用;使用截断方式计算范德华作用,截断半径为1 nm。选用Parrinello-Rahman压浴方式,Isotropic为控压方式,使用Velocity-rescale的控温方式,温度以20 ℃/ns速率从初始值25 ℃逐渐升至45、70、100和120 ℃,达到目标温度后系统保持在此温度下进行剩余的模拟。模拟步长为2 fs,每4 ps储存一次数据,每个温度平行模拟2次,用Origin 8.0软件和xmgrace绘图。
2 结果与分析
2.1 乳球蛋白的结构
乳球蛋白主要存在于猪、牛等动物乳汁中,具有重要的营养功能,是乳清蛋白的重要组成部分,分子质量约为18 KDa,约占乳清蛋白总量的50%[14],如图1所示。

图1 乳球蛋白在水盒子里的二级结构VMD图
乳球蛋白由分子C端上的1个α-螺旋和9个反平行的β-折叠构成,具有由1个8条β-折叠组成的“β-桶”结构中央疏水区域,此结构可以自动结合疏水分子,并对疏水配体具有保护作用,是乳球蛋白最主要的配位结合点[15]。乳球蛋白共有162个氨基酸残基,主要以稳定的二聚体形式存在,由非共价键连接的2个单体组成[16]。
2.2 均方根误差的分析
均方根误差(root mean square deviation, RMSD),是特定时间蛋白质构象与原始结构之间的平均偏差[17],是衡量体系是否稳定的重要依据。如图2所示,在25 ℃时,乳球蛋白的RMSD变化程度很小。45 ℃时,乳球蛋白的RMSD值升高,保持在0.25 nm。在70 ℃下,RMSD曲线分为了4个阶段。在30 ns之前曲线较为平稳,30~40 ns间RMSD曲线呈现直线上升,结构偏移较大。在40~80 ns之间,RMSD曲折上升,模拟达到80 ns后趋于平稳,RMSD维持在0.45 nm左右。当温度上升至100 ℃,20 ns内乳球蛋白的RMSD值匀速上升,随后维持在0.5 nm附近。在120 ℃时,RMSD在40 ns内曲折上升,在40 ns后趋于平稳,保持在0.6 nm左右。此温度下40 ns的乳球蛋白与33 ns相比,可以看出乳球蛋白的 C端和N端的肽链伸直,二级结构β-折叠紊乱,整体结构膨胀。从整体来看,乳球蛋白在5种温度下,其RMSD值在前40 ns变化比较剧烈,在后60 ns变化相对平缓。在25 ℃时,RMSD有最低值为0.2 nm,在120 ℃时有最大值为0.65 nm。这表明了乳球蛋白结构随着温度的上升会发生不同程度的变化。

图2 温度对乳球蛋白均方根误差的影响
2.3 均方根波动值的分析
均方根波动值(root mean square fluctuation, RMSF),是指某一帧构象相比于平均构象每个氨基酸的均方根位移。由于蛋白质中不同区域有着不同的生物功能,通过观察残余物的RMSF值的变化,可以获取不同温度下蛋白质的变性程度。如图3所示,随着温度的升高,乳球蛋白残基RMSF的波动性增大,说明温度越高对蛋白质的影响越大,蛋白质在高温下内部分子间会丢失部分作用力,导致天然构象失去稳定性[18]。图3中每个温度曲线都显示出同样的趋势,曲线上的峰表示为最易移动的残余物,残基Gln35、Glu51和Leu87的RMSF值分别为0.56、0.51和 0.50 nm,相对于其他氨基酸残基表现出最大的变异。在70 ℃以上,蛋白质的N端和C端的RMSF大幅度上升,120 ℃时RMSF有最大值0.99 nm,这表明乳球蛋白的N端和C端极易受到温度变化的影响。

图3 乳球蛋白均方根波动值与残余物的关系
2.4 溶剂可及表面积的分析
图4表示了乳球蛋白在5种温度下亲水和疏水区域的溶剂可及表面积随着时间的变化。从25 ℃升高至120 ℃的过程中,亲水区域溶剂可及表面积变化很小,保持在55 nm2左右,疏水区域溶剂可及表面积在逐渐变大,由38 nm2增加到42 nm2。疏水基团和亲水基团分别位于乳球蛋白的分子内部和分子表面,由于热作用使乳球蛋白结构发生了变化,原本的疏水基团暴露在表面,使得疏水区域溶剂可及表面积增加[19]。在模拟过程中,亲水区域溶剂可及表面积始终大于疏水区域溶剂可及表面积,所以乳球蛋白表现出亲水性大于疏水性的特点,即乳球蛋白在整个模拟过程是水溶性的,高温没有改变乳球蛋白的溶解性[20]。与模拟初始相比,总溶剂可及表面积上升10 nm2左右,这说明高温使乳球蛋白的结构伸展,使疏水基团与水接触的表面积增加。
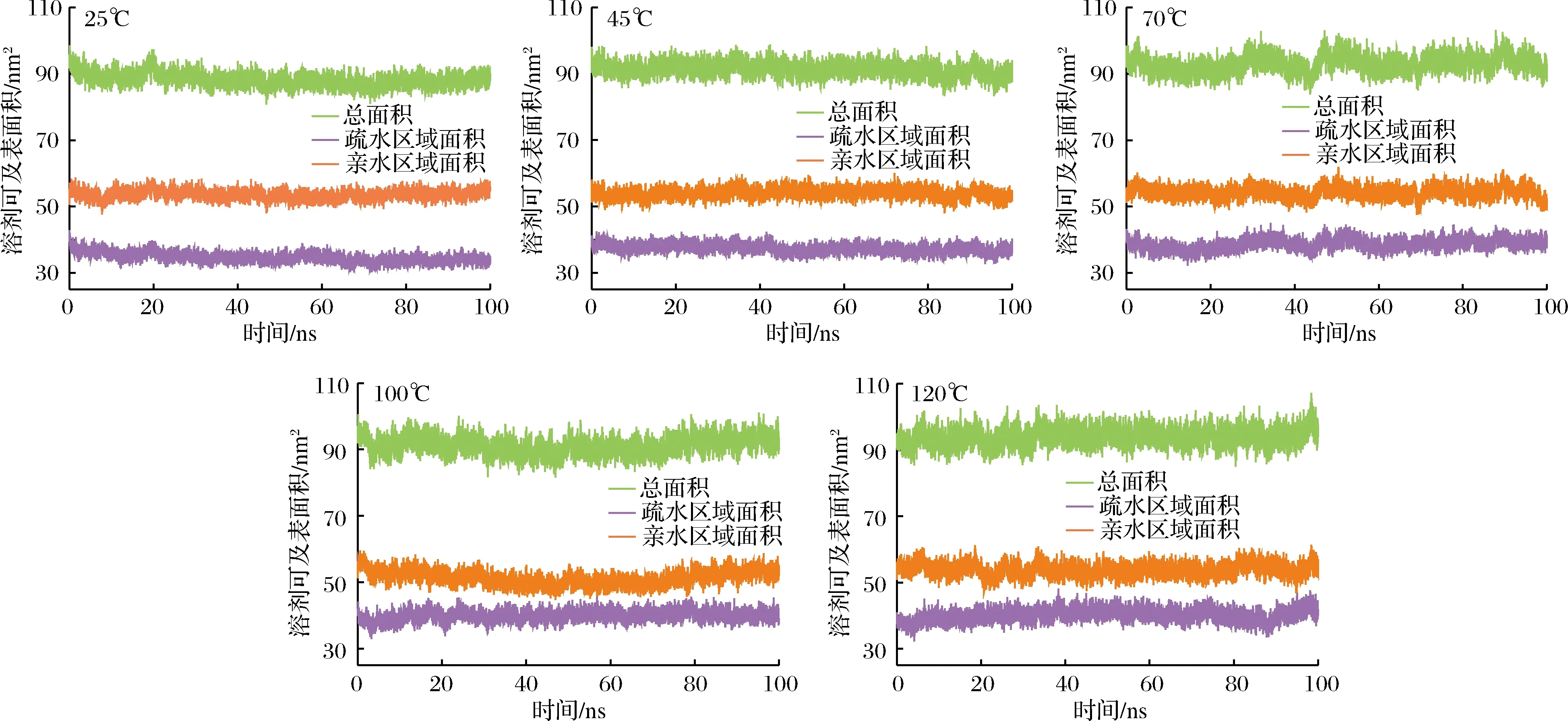
图4 乳球蛋白在25、45、70、100和120 ℃下的溶剂可及表面积
2.5 二级结构变化分析
为了进一步研究温度对于乳球蛋白稳定性的影响,使用DSSP软件对乳球蛋白的结构进行分析[21]。乳球蛋白二级结构数量的变化表明了乳球蛋白的整体稳定性和过程发生的动力学[22]。5种温度下100 ns乳球蛋白二级结构的变化图如图5所示。总二级结构的数量随着温度的升高而逐渐下降,在70 ℃以上有明显的数量变化,在120 ℃时变化程度最大,降低了20%左右。不论在哪一种温度下,β-折叠的数量最多,当温度升高至70℃后,随着温度的升高数量下降25%左右,表示在70 ℃以上部分β-折叠被破坏。α-螺旋和转角的数量随着温度升高而下降,当温度达到70 ℃以上不再变化,说明α-螺旋和转角在低温下已经发生变化。

图5 乳球蛋白在25、45、70、100和120 ℃的二级结构变化
从图5可以看出,线圈的数量在较低温度时上升速度缓慢,在70 ℃以上其数量开始明显增加,在120 ℃时增加的程度最大,线圈数量由37增加到了59,说明线圈在70 ℃以上易被温度影响,特别是120 ℃时极大影响了线圈的稳定性。乳球蛋白二级结构中弯曲和3-螺旋的数量在所考察温度范围内一直保持在30和5左右,β-盐桥的数量在0~1之间波动,随着温度变化三者变化程度非常小,这表示弯曲、3-螺旋和β-盐桥对于温度变化稳定性较高。综上说明了乳球蛋白的二级结构在70 ℃以上的高温开始发生变化,引起乳球蛋白的变性,使乳球蛋白结构展开,进而影响乳制品的品质。
2.6 回旋半径分析
图6显示了乳球蛋白的回旋半径随着时间的变化情况(45、100 ℃的回旋半径分别与25、70 ℃相同,此处不予显示)。回旋半径是描述乳球蛋白结构致密性的物理量,值越小表示乳球蛋白的致密性越大,越大则表示体系越膨胀。如图6所示,随着温度的升高,乳球蛋白回旋半径值增加。在温度为25 ℃时,乳球蛋白的回旋半径随时间变化很小,稳定在1.50 nm左右。当温度上升至70 ℃时,乳球蛋白的回旋半径值比25 ℃增加0.02 nm,此时乳球蛋白有较大的膨胀体系,结构开始发生变化。在120 ℃时,回旋半径在40 ns前处于较低的水平,40 ns时回旋半径值升高并维持在1.54 nm左右,此时的乳球蛋白表现出最大的膨胀结构体系,乳球蛋白受到温度的影响发生变性。这表明在70 ℃以上乳球蛋白发生热变性,其结构发生不可逆的变化,乳球蛋白结构伸展,整体结构膨胀,导致生物活性的丧失。

图6 温度对乳球蛋白回旋半径的影响
2.7 拉式构象图分析
拉氏构象图(ramachandran)是一种使蛋白质结构中主链氨基酸残基的二面角可视化的方法,主要用来鉴定蛋白质的构象是否合理。拉式图主要分为3个区域:允许区(深色)、最大允许区(浅色区)和不允许区(空白区)。图7展现了乳球蛋白主链氨基酸残基的二面角在5种不同的模拟温度下的拉式构象图。从整体可以看出,随着温度的升高,Ramachandran图也在逐渐变化。在温度25和45 ℃时,拉式构像图几乎没有变化,蛋白质结构稳定。当温度升高至70 ℃时,不允许区中的点开始增加,蛋白质结构发生变化。继续升温至120 ℃后,与25 ℃的拉式构象图相比,乳球蛋白结构发生了极大的变化,稳定性下降。这表明随着温度的升高,乳球蛋白结构中主链氨基酸残基的二面角在逐渐地变化,乳球蛋白的结构发生了变化,结构稳定性随着温度的升高而逐渐减弱。
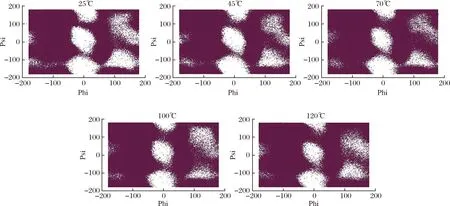
图7 在25、45、70、100和120 ℃下乳球蛋白的拉式构象图
2.8 乳球蛋白氢键分析
蛋白质氢键是一种非常重要的非共价结构力[23],是影响蛋白质稳定性的重要因素。随着温度的变化,乳球蛋白的结构以及氢键的数量和存在方式都会发生变化[24]。图8显示,25和120 ℃乳球蛋白分子内的氢键数量随着时间的变化(25、45、70和100 ℃的氢键数量几乎相同,此处只显示25 ℃的氢键数量),模拟过程中一直发生氢键断裂和新的氢键形成。从图8可以看出,温度在100 ℃以下的氢键数量稳定在125左右。当温度升高至120 ℃时,80 ns前乳球蛋白氢键数量较为稳定,但在80 ns后氢键数量先下降后上升,最后氢键数量降至100。这说明了氢键在100 ℃以下的温度稳定性较高,120 ℃以上的高温导致了乳球蛋白结构发生变化,氢键数量减少,降低了乳球蛋白的稳定性[25]。

图8 温度对乳球蛋白氢键数量的影响
2.9 乳球蛋白盐桥分析
盐桥是带电氨基酸残基之间的相互作用,对蛋白质折叠、结构和功能方面有重要的影响[26]。乳球蛋白内部疏水“β-桶”结构是重要的结合位点,在温度升高过程中,内部的疏水基团会逐渐暴露出来,乳球蛋白结构趋向松散。通过VMD可视化软件选择2个与乳球蛋白内部“β-桶”疏水结构相连的盐桥,分别为Glu45-Lys70和Glu89-Lys60,它们在温度为25和120 ℃时的盐桥距离变化如图9所示(因其余3个温度的盐桥距离与25 ℃时接近,此处只显示25和120 ℃的距离变化)。盐桥Glu45-Lys70在25 ℃时距离维持在8~12 Å范围内,但是当温度升高至120 ℃时,盐桥间距离随着时间而逐渐变大,最终保持在16 Å左右。盐桥Glu89-Lys60的距离在温度为25和120 ℃时表现出极大的差别,随着温度的升高,盐桥的距离随之增大。在温度为25 ℃时,盐桥Glu89-Lys60的距离逐渐下降,最终距离为8 Å。当温度升高至120 ℃,盐桥距离先下降后上升,最高盐桥距离可以达到24 Å。这表明了乳球蛋白的盐桥随着温度升高距离逐渐变大,盐桥破裂,乳球蛋白发生变性,稳定性下降。

图9 盐桥Glu45-Lys70(a)和Glu89-Lys60(b)在25与120 ℃的距离变化
2.10 乳球蛋白骨架变化分析
根据VMD可视化软件得到了乳球蛋白在5种温度下的骨架构象变化。图10展示了乳球蛋白在5种模拟温度下的骨架变化,红色代表乳球蛋白在模拟初期的状态,而蓝色代表模拟完成后的状态。

图10 乳球蛋白在25、45、70、100和120 ℃下的骨架变化
乳球蛋白骨架在5种温度下都有不同程度的变化。在温度为25与45 ℃时,初始与模拟后的骨架结构差别不大,模拟完成后乳球蛋白仍能保持原有的结构。当温度升高至70 ℃时,与初始结构相比,模拟结束后的骨架结构表现出轻微的膨胀,这与回旋半径得出的结果一致。在温度为100 ℃的骨架变化中,模拟后的骨架表现出更大的膨胀,此时骨架与初始骨架结构相比有轻微的变化。当温度继续升高至120 ℃时,此时模拟后的乳球蛋白的骨架结构与初始相比有更大的变化,“β-桶”结构变成无序状态,整体结构伸展。通过初始与模拟后骨架图可以观察到乳球蛋白在不同温度下的变化程度。这说明了乳球蛋白在高温下,尤其是在120 ℃的高温下,蛋白质的结构发生改变,导致蛋白质变性,降低了乳球蛋白的营养价值和活性。
2.11 乳球蛋白性质分析
乳球蛋白不仅营养价值丰富且具有优良的功能性质,在一定的温度下乳球蛋白的结构发生改变,进而引起其性质的变化。近年来,不同热处理温度牛乳中乳球蛋白性质研究总结如表1所示。从表1可以看出,由于在加热过程中蛋白质发生了变性导致聚集和沉降[27],乳球蛋白的含量和溶解度随着温度的升高而下降,在100 ℃已经有91%以上的乳球蛋白发生变性。乳球蛋白经过60 ℃加热后较常温的乳球蛋白的乳化性低75.55 m2/g,这是由于加热导致乳球蛋白聚合亲水性下降进而引起乳球蛋白乳化性降低[28]。RAHAMAN等[29]使用ANS作为荧光探针并用荧光法测定乳球蛋白表面疏水性,发现高温使乳球蛋白内部疏水基团暴露,乳球蛋白的表面疏水性随着温度升高而增大,并在100 ℃时增大至常温的2倍。乳球蛋白结构和生理功能的改变说明了乳球蛋白在70 ℃时开始发生变性,并随着温度的升高变性的程度增大。上述研究结果在一定程度上,与本文中采用的分子动力学模拟分析得出结论相一致。
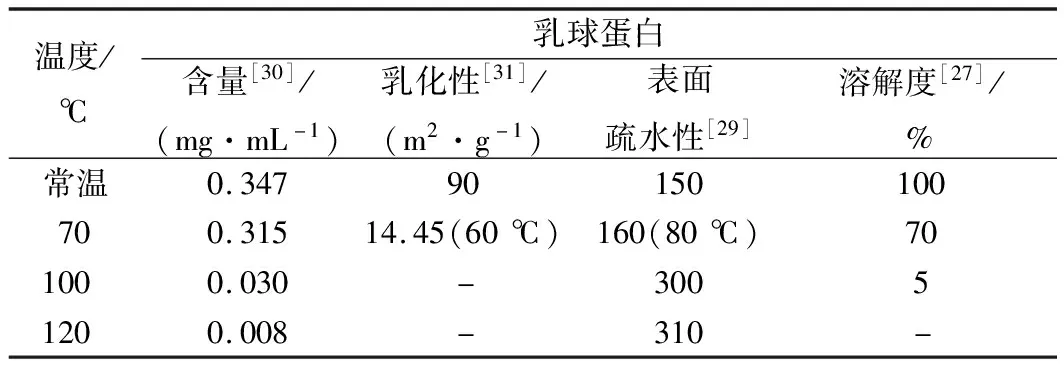
表1 不同热处理温度下牛乳中乳球蛋白功能性质的变化
注:常温,25 ℃;“-”表示无此实验条件下数据
3 结论
本文采用了分子动力模拟的方法研究并分析了乳球蛋白在5种温度(25、45、70、100和120 ℃)下的结构变化,乳球蛋白在低于70 ℃时,结构比较稳定。但当温度升高至70 ℃后,乳球蛋白的结构发生变化,主要表现在RMSD和RMSF值显著增加,回旋半径值增大,疏水基团暴露,导致疏水区域溶剂可及表面积增加了15 nm2,乳球蛋白内部氢键数量减少25个左右,盐桥间的距离增大。同时乳球蛋白的二级结构也随着温度的上升发生不同的变化,乳球蛋白结构被明显破坏,特别是在120 ℃的高温下,乳球蛋白发生了极大的变性,破坏了乳球蛋白的活性。
