比浊法测定硫酸多黏菌素抑制霉菌的条件优化
2020-05-04王志新宏丹鲁雷震周景波刘洋宁亚维马爱进贾英民
王志新,宏丹,鲁雷震,周景波,刘洋,宁亚维,马爱进,贾英民
1(河北科技大学 生物科学与工程学院,河北省发酵工程技术研究中心,河北 石家庄,050018) 2(北京工商大学 食品与健康学院,北京,100048)
抗菌肽(antimicrobial peptides, AMPs)是指具有抑菌活性的小分子多肽,可以抑制多种病原微生物[1-3]。种类多、抑菌谱广、抑菌活性高、无污染、无残留是抗菌肽的显著优势[4]。现今抗菌肽已广泛应用于农业[5]、养殖业[6, 4, 11-12]、食品工业[7-10]、医药行业[13]等领域。近年来,抗菌肽替代抗生素的研究已成为人们关注的热点。目前,抗菌肽已被广泛开发与使用,常见抑制革兰氏阳性菌的肽有杆菌肽,抑制革兰氏阴性菌的肽有多黏菌素B、黏菌素等[14],抑制真菌的肽有沙拉霉素、硫酸多黏菌素等[15],用于食品保藏剂的有乳链菌肽[16-18],用于饲料添加剂的有硫肽菌素、那西肽等[19]。
食品在加工、包装和储运过程中与外界环境接触,使得食品带有种类繁多的微生物,其中霉菌生长力旺盛、抵抗力强,食品中丰富的营养物质加速霉菌的繁殖,最终引起食品腐烂变质。部分霉菌在侵染食品的过程中还会产生有毒物质,因此,防治霉菌污染已成为食品保藏中的重要研究内容。在霉菌污染的防治中,生物防腐剂或抑菌剂已被广泛开发与应用。龚庆伟[20]研究发现,芽孢杆菌脂肽Bacillomycin D对黄曲霉病菌孢子的最小抑菌质量浓度为0.05 g/L,最小致死质量浓度为0.2 g/L。韩玉竹等[21]报道辣椒籽抗菌肽能够抑制黄曲霉生长,在最小抑菌浓度(minimum inhibitory concentration, MIC)下,黄曲霉的萌发率降至18.51%,浓度达到4MIC时能完全抑制黄曲霉孢子的萌发。但目前在抗菌肽抑制腐败霉菌的研究存在一定问题,即测定方法和评价指标不统一,致使测定结果可比性差。因此,寻找一种简单、准确、快速的评价方法成为抗菌肽研究与开发的关键。
目前关于抗菌肽抑制真菌的活性检测方法主要有琼脂扩散法[22]、菌丝生长抑制法[23]和孢子萌发抑制法[24]。本实验室前期采用琼脂扩散法测定了抗菌肽抑制真菌[15]和细菌[25]的活性,显示方法准确,但所需试验时间较长(一般需要30~34 h);而采用菌丝生长抑制法和孢子萌发抑制法测定对真菌的抑菌活性时容易产生试验误差。因此,寻找简单、准确、快速测定抗菌肽对真菌抑菌活性的方法尤为重要。目前对于抗菌肽的测定一般参照中国药典[26]中抗生素的测定方法,其主要采用微生物检定法,其中的比浊法是通过建立抗生素浓度对数值与吸光度的线性关系来测定抗生素对细菌和酵母菌的抑菌活力[26],很多文献也有相关报道[27-29]。该方法操作简单、结果相对准确快速,但此方法在中国药典中并未涉及对真菌的检测。由于真菌具有菌丝,这种测定方法是否适用于抗菌肽对真菌的抑菌活性检测,还有待于研究。
基于此,本文采用比浊法,以硫酸多黏菌素B和青霉为研究对象,考察此法是否适合评价抗菌肽对霉菌的抑菌活性;同时对影响比浊法测定的关键因素进行优化,建立抗菌肽浓度对数值与吸光度的线性关系,利用线性相关系数R2、斜率、截距等优化指示菌浓度、抗菌肽浓度、二者比例和两者反应时间等因素,并进一步选用常见的引起食品腐败的霉菌典型代表——黑曲霉、黄曲霉、总状毛霉进行验证,以期获得简单、准确、快速的测定方法。
1 材料与方法
1.1 试验材料
1.1.1 菌株
产黄青霉(Penicilliumchrysogenum)ATCC 10106、黑曲霉(Aspergillusniger)ATCC 16404、黄曲霉(Aspergillusflavus)ATCC 9643、总状毛霉(Mucorracemosus)ATCC 23314,本实验室保存。
1.1.2 培养基
马铃薯葡萄糖肉汤培养基(PDB)、马铃薯葡萄糖琼脂培养基(PDA),北京奥博星生物技术有限责任公司。
1.1.3 抗菌肽
硫酸多黏菌素 B(polymyxin B),上海麦克林生化科技有限公司。
1.2 仪器设备
ZHJH-C1109C超净工作台,苏州安泰空气技术有限公司;ZSD-A1160全自动新型生化培养箱,上海智城分析仪器制造有限公司;EVOLUTION 220紫外分光光度计,天美科学仪器有限公司;OLYMPUS-CX31显微镜,日本奥林巴斯株式会社;SHZ-A水浴恒温振荡器,上海博讯实业有限公司医疗设备厂。
1.3 试验方法
1.3.1 孢子悬液的配制
将产黄青霉均匀涂布于PDA培养基,28 ℃恒温静置培养18~24 h,取适量生理盐水加入培养基表面,用涂布棒在培养基表面轻轻刮动,脱脂棉过滤菌丝,获得孢子悬液,血球计数板进行计数,采用生理盐水对孢子悬液进行稀释和调整,备用。
1.3.2 硫酸多黏菌素溶液的配制
选用无菌水配制硫酸多黏菌素,质量浓度为0.01~5.0 g/L,备用。
1.3.3 指示菌培养方式的选择
将1.3.1制备的孢子悬液添加到PDB培养基中,保证两者的指示菌初始添加浓度相同,选择静置与振荡2种培养方式,每隔2 h采用紫外分光光度计测定吸光度(OD600),观察2种培养方式对指示菌生长的影响。
1.3.4 硫酸多黏菌素浓度与吸光度的线性关系
指示菌浓度为(1~2)×106CFU/mL,硫酸多黏菌素质量浓度选择0.01~2.5 g/L(终质量浓度为0.01~0.5 g/L),指示菌与硫酸多黏菌素比例为4∶1,振荡培养10 h后观察其生长情况,并测定OD600值。将硫酸多黏菌素质量浓度对数值设为横坐标,吸光度OD600值设为纵坐标,分析两者是否成线性关系。
1.3.5 定量测定方法的优化
1.3.5.1 硫酸多黏菌素浓度的选择
指示菌浓度为(1~2)×106CFU/mL,硫酸多黏菌素质量浓度为0.01~2.5 g/L(终质量浓度0.01~0.5 g/L),指示菌与硫酸多黏菌素比例为4∶1,振荡培养10 h,观察其生长情况并测定OD600值。
1.3.5.2 指示菌浓度的选择
选择产黄青霉浓度为(1~2)×105、(1~2)×106和(1~2)×107CFU/mL,硫酸多黏菌素质量浓度选择0.01~2.5 g/L(终质量浓度0.01~0.5 g/L),指示菌与硫酸多黏菌素比例为4∶1,振荡培养10 h,观察其生长情况并测定OD600值。并进一步采用(3~5)×106CFU/mL的指示菌,进行验证。
1.3.5.3 指示菌与硫酸多黏菌素比例的选择
保证不同比例下硫酸多黏菌素质量浓度为0.01~2.5 g/L(终质量浓度0.01~0.5 g/L)和指示菌终浓度为(1~2)×106CFU/mL,通过调节二者的初始浓度,将指示菌与硫酸多黏菌素浓度比例分别设为1∶1、4∶1和9∶1,培养10 h后观察其生长情况并测定OD600值的变化。
1.3.5.4 反应时间的选择
指示菌浓度为(1~2)×106CFU/mL,硫酸多黏菌素质量浓度选择为0.01~2.5 g/L(终质量浓度0.01~0.5 g/L),指示菌与硫酸多黏菌素比例为4∶1,分别振荡培养7、8、9、10、11 h,观察其生长情况并测定OD600值。
1.3.6 验证试验
不同实验人员的验证:另外3名实验人员按照优化后的测定条件进行方法稳定性的验证。
不同指示菌的验证:选用黑曲霉ATCC 16404、黄曲霉ATCC 9643和总状毛霉ATCC 23314为指示菌进行方法通用性的验证。
2 结果与分析
2.1 指示菌培养方式的选择
霉菌生长较为缓慢,不同培养方式对霉菌的生长具有显著影响,本试验选择振荡与静置2种培养方式。从图1可以看出,0~3 h产黄青霉浓度呈现下降趋势,初步推断在加入硫酸多黏菌素后将部分产黄青霉杀死。振荡培养3 h开始,青霉开始生长,浓度呈现上升趋势;培养到12 h以后,吸光度呈现下降趋势,根据实验实际情况观察,此时青霉菌丝生长明显,菌丝相互缠绕,影响吸光度的测定,导致OD下降。静置培养3 h开始,青霉浓度呈现上升趋势,但OD600值相对于振荡培养增长缓慢,培养到15 h以后,吸光度呈现下降趋势,此时青霉菌丝生长明显,导致OD600值下降。为了节省试验时间,提高效率,本试验选择振荡培养进行抑菌活性的研究。
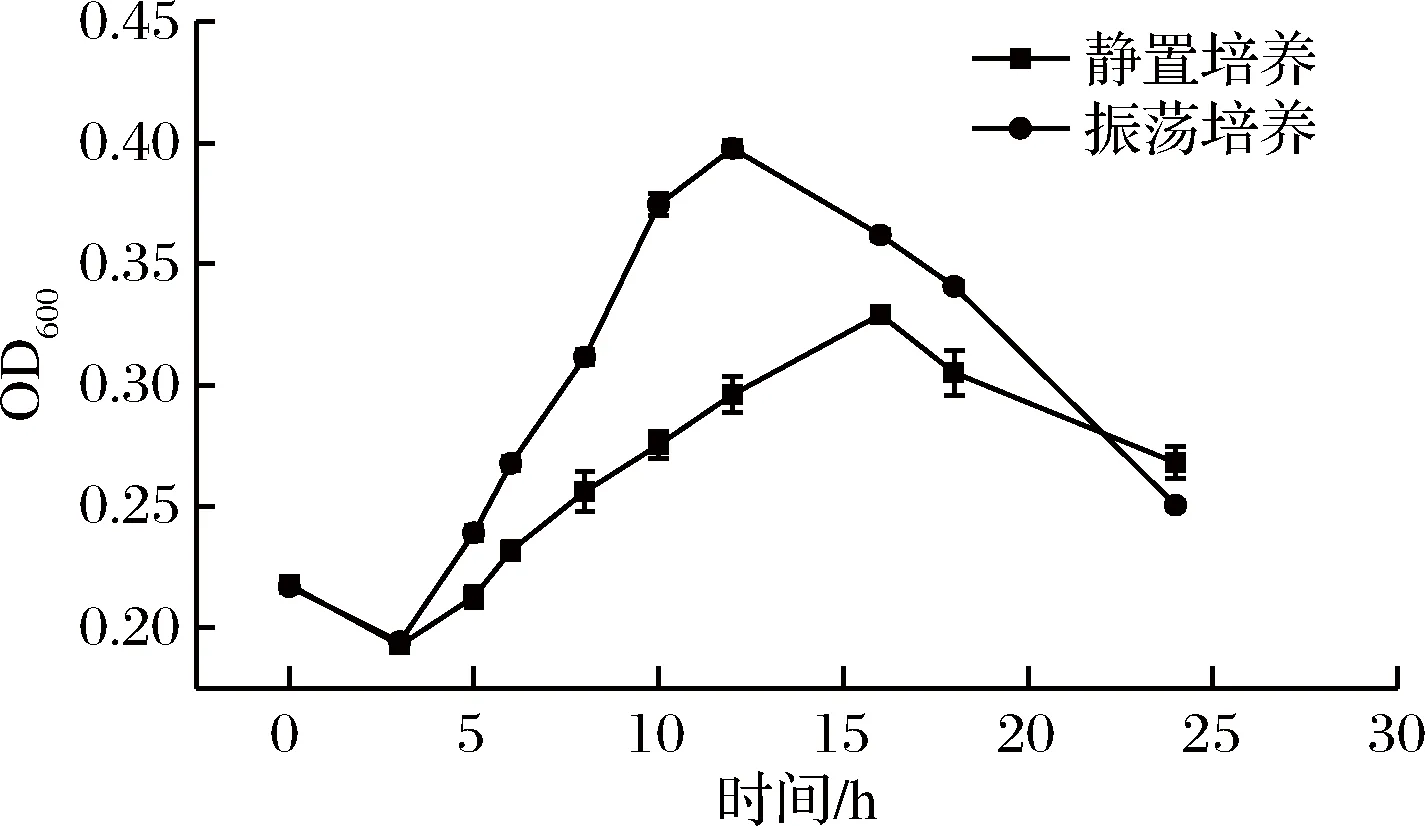
图1 静置培养与振荡培养的比较
2.2 硫酸多黏菌素浓度对数值与指示菌吸光度值线性关系的验证
从图2看出,硫酸多黏菌素在0.01~2.5 g/L(终质量浓度0.01~0.5 g/L)范围内,比浊法测定硫酸多黏菌素的浓度对数值与吸光度值呈现线性关系。
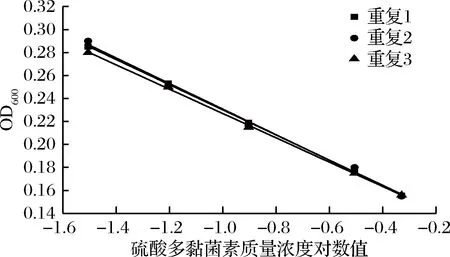
图2 硫酸多黏菌素浓度对数值与吸光度之间的线性关系
由表1可知,3次重复试验,斜率截距的相对偏差均较小,且相关系数R2均高于0.99,说明此方法测定结果的准确性和精密度较高,且重复性较好。
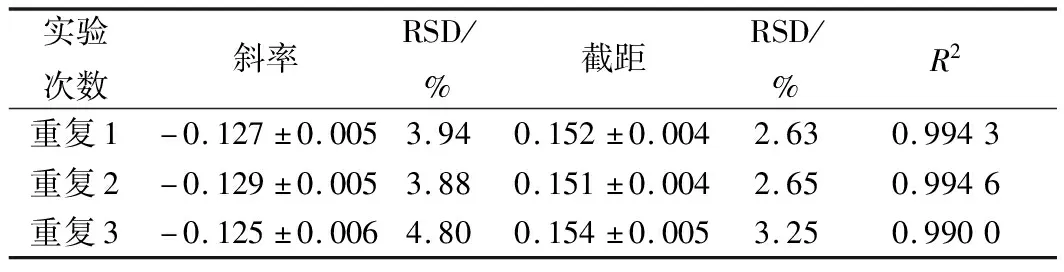
表1 硫酸多黏菌素浓度对数值与吸光度线性关系的结果分析
2.3 硫酸多黏菌素定量测定方法的优化
在试验过程中,硫酸多黏菌素浓度、指示菌浓度、两者的比例和培养时间等因素均会对试验测定产生影响,因此,下一步需要对以上因素进行优化,以期获得最适的定量测定条件。
2.3.1 硫酸多黏菌素浓度的选择
采用0.01~2.5 g/L(终质量浓度0.01~0.5 g/L)的硫酸多黏菌素质量浓度进行研究,其结果见图3和表2。硫酸多黏菌素质量浓度在0.01~2.5 g/L(终质量浓度0.01~0.5 g/L)范围内呈现良好的线性关系,3次重复的R2均大于0.99,根据斜率和截距可知,该试验的精密度和稳定性较好。
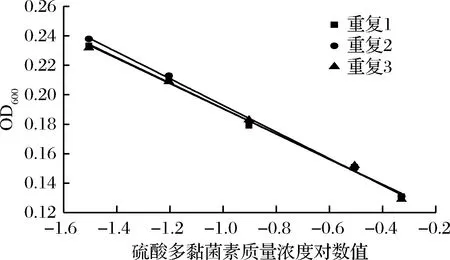
图3 硫酸多黏菌素浓度的选择
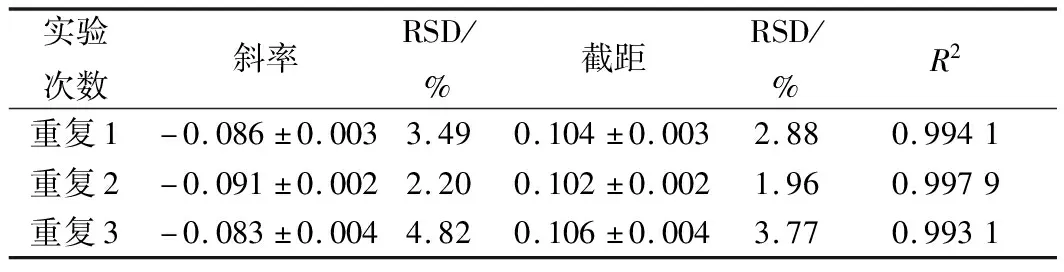
表2 不同硫酸多黏菌素浓度结果分析
2.3.2 青霉浓度的选择
根据实际情况和表3的结果可知,培养10 h后,产黄青霉浓度为(1~2)×105CFU/mL时,菌体生长不明显,不能很好地表征硫酸多黏菌素的抑菌效力,且导致试验误差大,在一定的硫酸多黏菌素浓度范围内不能呈现线性关系。青霉浓度为(1~2)×107CFU/mL时菌体浓度高,菌体量大,生长旺盛,培养10 h后出现菌丝缠绕现象,影响吸光度值,误差较大(图4)。青霉浓度为(1~2)×106CFU/mL时,在特定的硫酸多黏菌素浓度范围内呈现良好的线性关系且重复性较好(图5和表3)。

表3 不同指示菌浓度结果分析

图4 产黄青霉浓度为(1~2)×107 CFU/mL的生长情况
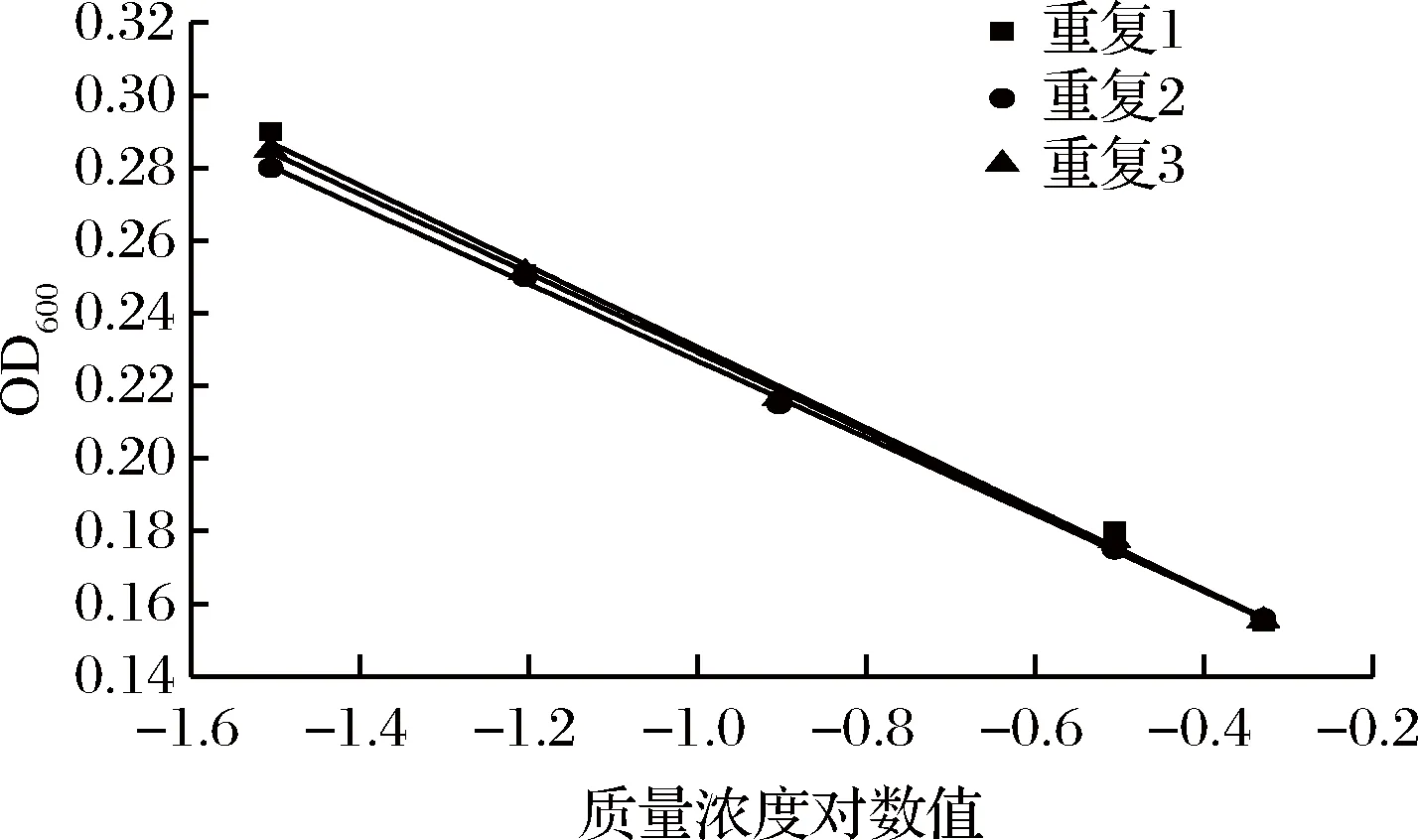
图5 产黄青霉浓度为(1~2)×106 CFU/mL的试验结果
进一步采用(3~5)×106CFU/mL浓度的青霉进行验证,从图6和表4可以看出,线性关系良好,根据斜率和截距得出,青霉浓度为(1~2)×106和(3~5)×106CFU/mL时,试验的精密度和稳定性都很高,因此,青霉浓度选择(1~5)×106CFU/mL。
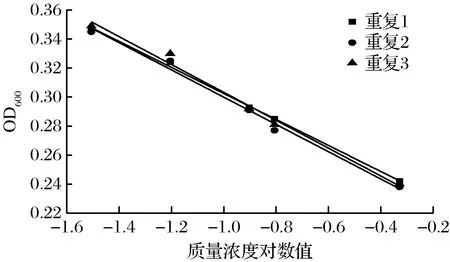
图6 产黄青霉浓度为(3~5)×106 CFU/mL的试验结果
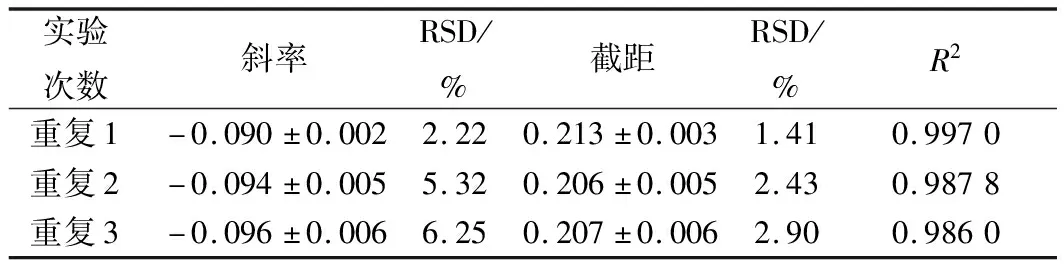
表4 产黄青霉浓度(3~5)×106 CFU/mL验证试验
2.3.3 指示菌和硫酸多黏菌素比例的选择
指示菌与硫酸多黏菌素浓度比例分别设为1∶1、4∶1和9∶1,从图7和表5看出,指示菌与硫酸多黏菌素浓度比例为1∶1和9∶1时线性相关差,且比例为1∶1时,体系中培养基量较少,不能为菌体的生长提供足够的营养物质;比例为9∶1时,菌体生长较快,不能很好地表征硫酸多黏菌素的抑菌效力;而当两者比例为4∶1时,培养基适中,线性相关性较好,斜率和截距相对偏差较小,此时精密度和稳定性好,因此本试验选择指示菌和硫酸多黏菌素的比例为4∶1。
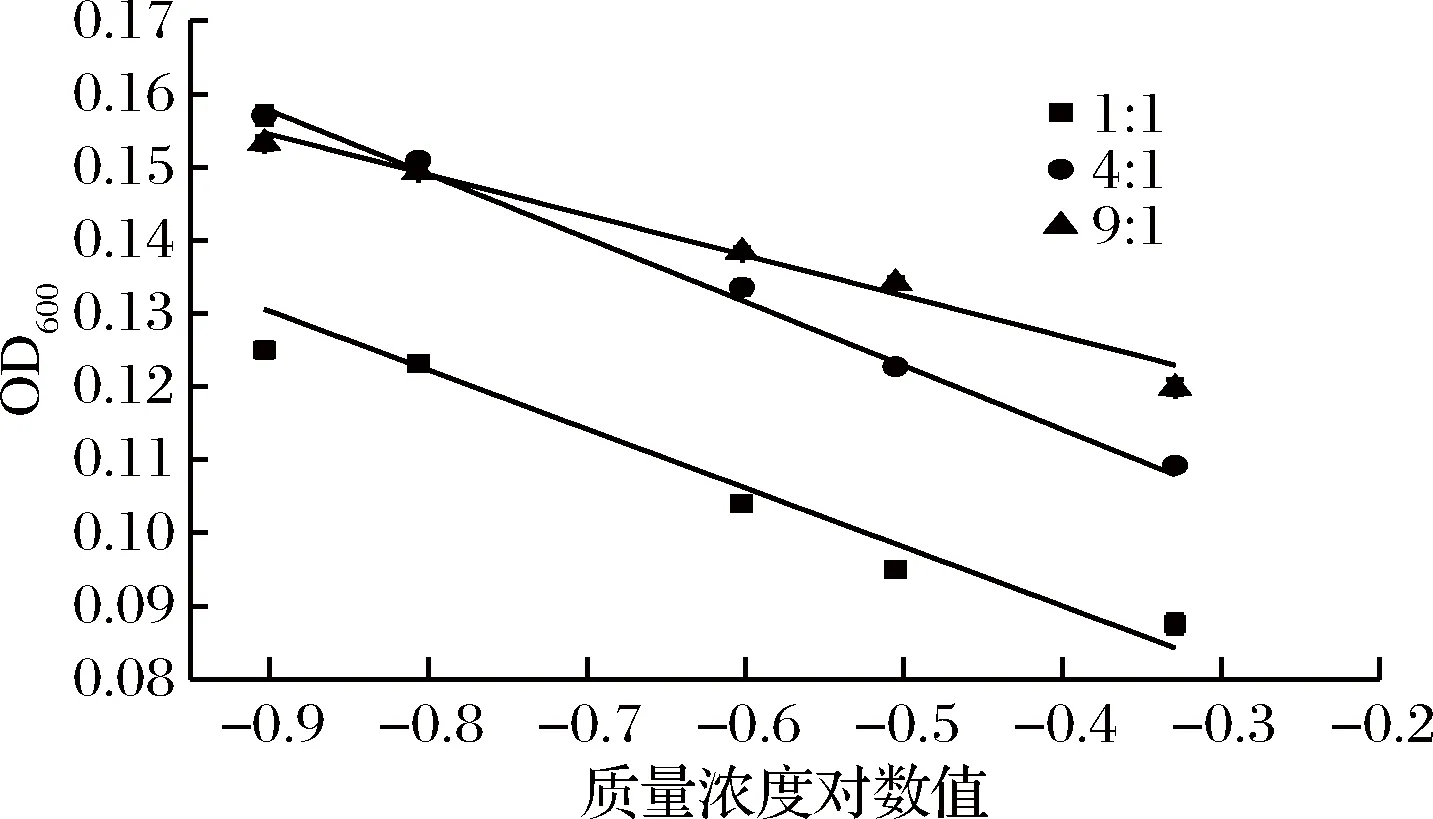
图7 指示菌和硫酸多黏菌素比例的选择
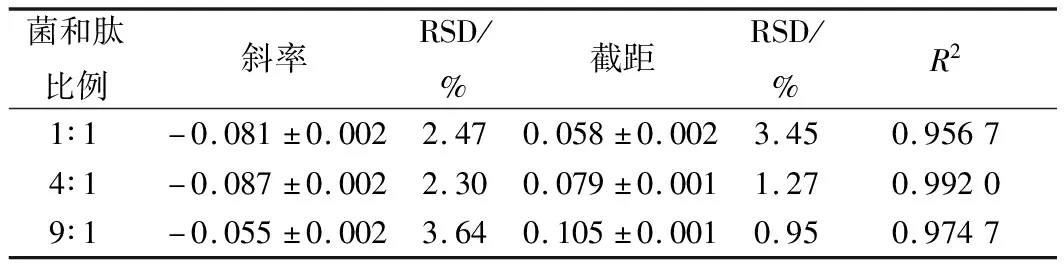
表5 指示菌和硫酸多黏菌素不同比例的试验结果分析
2.3.4 反应时间的选择
不同反应时间的结果见图8和表6。培养7和8 h后指示菌菌体量少,结果误差较大,硫酸多黏菌素浓度对数值与吸光度线性关系较低,斜率和截距相对偏差较大。随着培养时间的延长,11 h时青霉已长出菌丝,出现菌丝缠绕现象,测定结果不稳定。而培养时间为9 h时,基本还未出现菌丝,且线性相关性较强(R2>0.99),根据斜率和截距可以看出,精密度和稳定性也较好,因此,本试验选择反应时间为9 h。
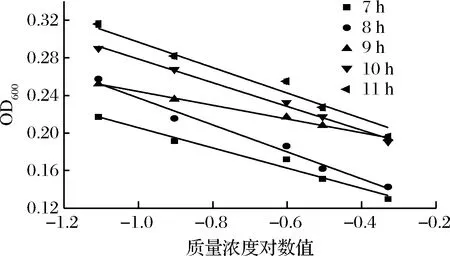
图8 指示菌和硫酸多黏菌素反应时间选择
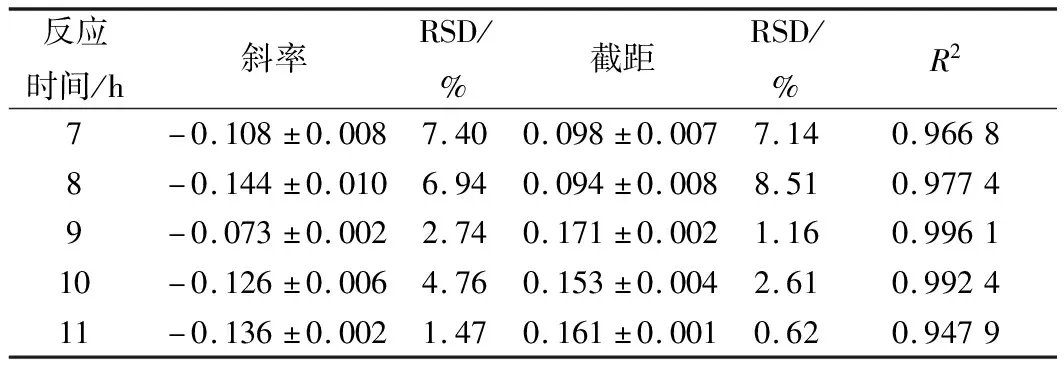
表6 指示菌和硫酸多黏菌素反应不同时间试验结果分析
2.4 验证实验
利用优化后的条件:指示菌浓度(1~5)×106CFU/mL,硫酸多黏菌素质量浓度0.01~2.5 g/L(终质量浓度0.01~0.5 g/L),二者比例4∶1,反应时间9 h,进一步验证方法的准确性和通用性。
通过不同人员的操作研究方法的准确性,实验结果如图9和表7。结果显示,硫酸多黏菌素浓度对数值与吸光度之间呈现良好的线性关系(R2>0.99),从斜率和截距可以看出,本实验的精密度和稳定性较好。
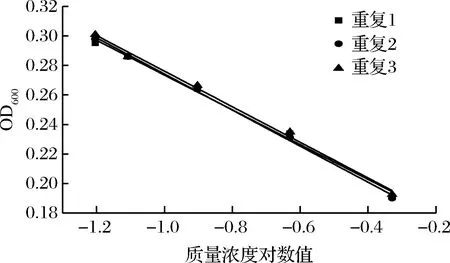
图9 硫酸多黏菌素抑制P.chrysogenum ATCC 10106的验证实验
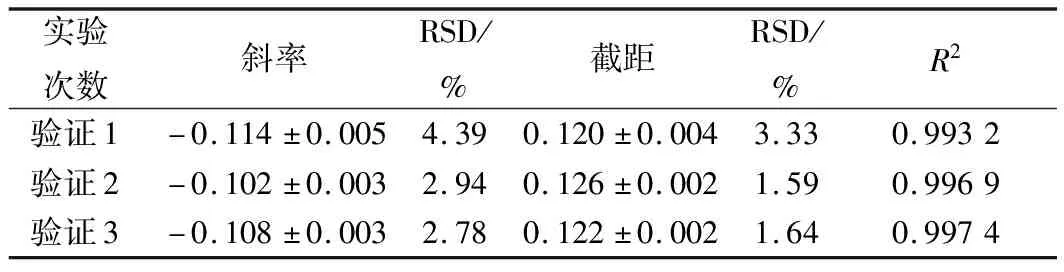
表7 硫酸多黏菌素抑制P.chrysogenum ATCC 10106的验证实验结果分析
进一步选用黑曲霉、黄曲霉和总状毛霉为指示菌,利用优化后的条件进行方法通用性的验证。从图10、11、12和表8、9、10看出,硫酸多黏菌素浓度对数值与吸光度成线性关系,斜率和截距相对偏差较小,说明试验精密度高,稳定性好。
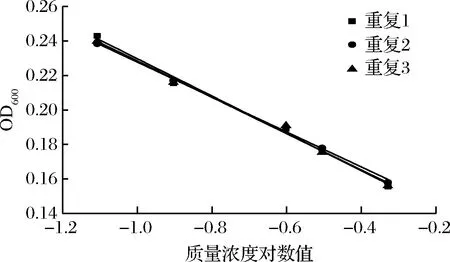
图10 硫酸多黏菌素抑制A.niger ATCC 16404的验证实验
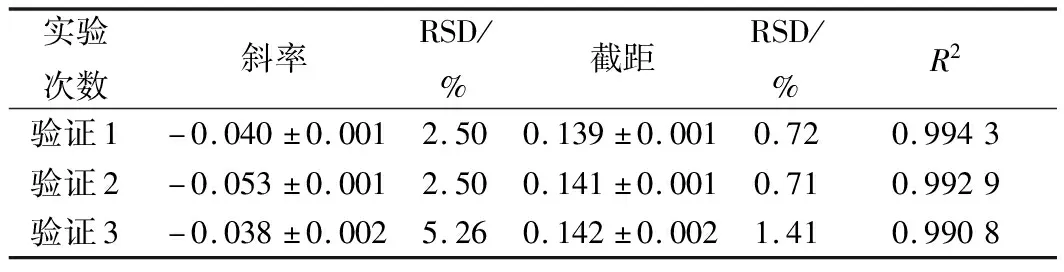
表8 硫酸多黏菌素抑制A.niger ATCC 16404的验证实验结果分析
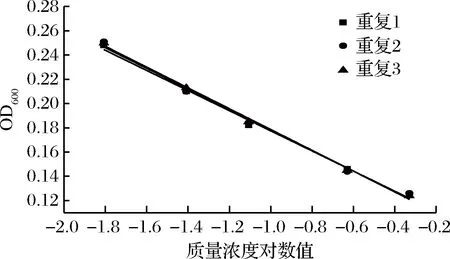
图11 硫酸多黏菌素抑制A.flavus ATCC 9643的验证实验
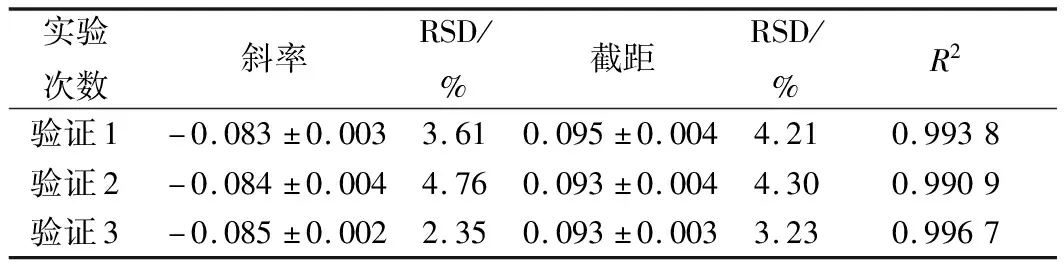
表9 硫酸多黏菌素抑制A.flavus ATCC 9643的验证实验结果分析
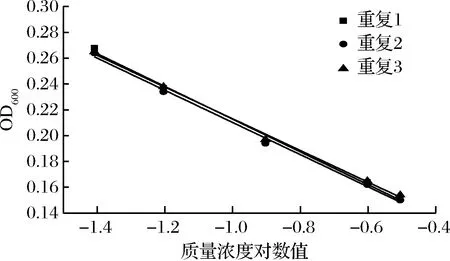
图12 硫酸多黏菌素抑制M.racemosus ATCC 23314的验证实验
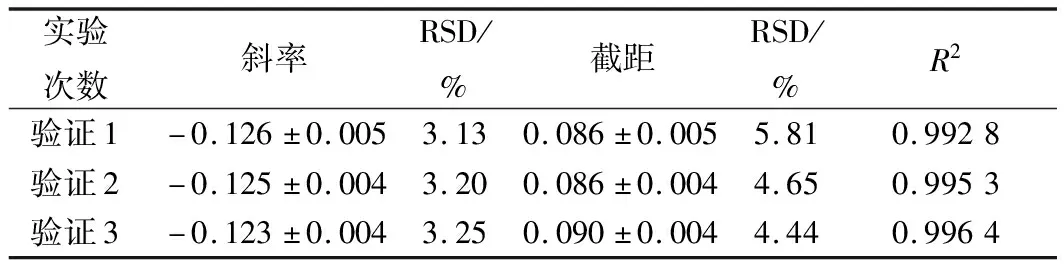
表10 硫酸多黏菌素抑制M.racemosus ATCC 23314的验证实验结果分析
通过上述验证试验进一步说明,利用比浊法研究硫酸多黏菌素对霉菌的定量测定,该方法具有广泛适用性,且测定简单、准确、快速。
3 结论
本研究选用比浊法,通过优化指示菌浓度、硫酸多黏菌素浓度、二者的比例以及反应时间等因素,建立了硫酸多黏菌素抑制霉菌的定量测定方法,其最佳条件为:指示菌浓度(1~5)×106CFU/mL,硫酸多黏菌素质量浓度0.01~2.5 g/L(终质量浓度0.01~0.5 g/L),二者比例4∶1,反应时间9 h,在600 nm波长下测定吸光度,硫酸多黏菌素浓度对数值与吸光度之间呈现线性关系,选用黑曲霉、黄曲霉和总状毛霉作为指示菌进一步验证,结果显示,比浊法的重复性高。
本实验室前期采用琼脂扩散法[15]研究多黏菌素抑制霉菌的测定方法,显示其进行抑菌活力测定时需要30~34 h(4 ℃冰箱预扩散6~10 h,28 ℃培养箱培养18~24 h),而本研究采用的比浊法仅需要9 h即可完成测定,时间缩短了21~25 h,解决了琼脂扩散法测定抗菌肽效价时间长的问题。由此可以表明,比浊法测定硫酸多黏菌素抑制霉菌活性的方法具有简单、准确、快速的特点。
