例谈利用差量法速解化学计算题
2020-05-01朱均伟
■朱均伟
差量法是依据化学反应前后的某些“差量”(固体质量差、溶液质量差、气体质量差、气体体积差等)与反应物或生成物的变化量成正比而建立的,具体分析如下。
一、差量法的理论依据
应用于化学计算题中的差量法的理论依据是数学知识中的“等比定理”。

注意:只有当差量与始态量或终态量存在比例关系且是同一物理量时,才可以采用差量法求解。
二、利用差量法解题的步骤
第一步,分析化学反应前后各物质间的数量关系及产生差量的原因,确定题目中的“理论差值”。
第二步,写出正确的化学方程式,找到题目提供的“实际差值”。
第三步,列出正确的比例式,求出答案。
三、利用差量法解答的四类问题
1.求固体质量差问题。
例1将氢气通入10g 灼热的氧化铜中,经过一段时间后得到8.4g固体,反应的化学方程式为,求参加反应的氧化铜的质量。
解析:由题意可得理论差值为CuOCu=O,实际差值为10g-8.4g=1.6g。设参加反应的CuO 的质量为x,则有:

列式80∶16=x∶1.6g,解得x=8g。
2.求溶液质量差问题。
例2天平两端各放一只质量相等的烧杯,内盛等体积、等浓度的足量稀盐酸,将物质的量都为amol的铝和镁分别放入左盘和右盘的烧杯中,反应完毕后,在哪一盘中加入多少克砝码才能使天平两端平衡?
解析:由题意可得:

经比较可知右盘的烧杯中溶液质量增加得较少,所以需要在右盘中加入24ag-22ag=2ag砝码才能使天平两端平衡。
3.求气体质量差问题。
例3将12gCO 和CO2的混合气体通过足量灼热的氧化铜后,得到气体的总质量为18g,求原混合气体中CO2的质量分数。
解析:设参加反应的CO 的质量为x,由题意可得:

列式28∶x=16∶6g,解得x=10.5g。因此原混合气体中CO2的质量分数=。
4.求气体体积差问题。
例4CS2能够在氧气中完全燃烧生成CO2和SO2。现将0.228gCS2在448mL氧气(标准状况下)中完全燃烧,反应后气体混合物在标准状况下的体积是( )。
A.112mL B.224mL
C.336mL D.448mL
解析:因为反应前后气体在同温、同压的条件下变化,所以可以根据气体反应前后的分子总数之差,利用气体体积的差列比例式求解。
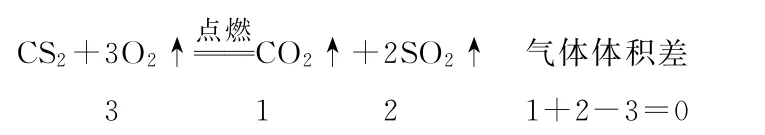
因为反应前后气体的体积差为零,所以反应后气体混合物在标准状况下的体积仍然是448mL。选D。
