通瘀煎对ApoE基因敲除小鼠动脉粥样硬化斑块形成的影响及机制
2020-04-30卢素宏姚丽梅刘瑶杨雅琴林华景
卢素宏 姚丽梅 刘瑶 杨雅琴 林华景
(广东食品药品职业学院,广东 广州 510520)
动脉粥样硬化(AS)指动脉管壁及其分支管壁内膜和内膜下出现脂质、碳水化合物及血液成分的灶状沉积,结缔组织和钙沉积所致,同时出现大量中层平滑肌细胞向内膜移动、增殖,导致内膜增厚,逐渐形成粥样病灶或纤维脂质斑块病灶的一种炎症性疾病,炎症反应贯穿于AS发生发展的全过程。研究表明,AS是一种炎症反应性疾病,炎症反应贯穿于AS发生和发展的全过程〔1〕,动脉管壁内大量炎症因子的形成和释放与AS斑块的形成关系密切〔2〕。在AS早期,当不稳定斑块出现破裂时,即伴随炎症信号通路的激活。因此,及早识别不稳定的AS斑块,探寻敏感而特异的血清学标志物及相关炎症靶点,通过采用调节脂质代谢紊乱、抗炎等治疗,减少或阻止AS等血管事件的发生是现阶段研究的热点之一。目前,防治AS的药物研究相对较少,临床常用他汀类药物,其对AS的防治有一定的作用,但长期服用易导致肝损害等不良反应的发生〔3~5〕。中药和中药复方具有整体调节,适应证广泛,毒副作用小等优点,在AS的预防和治疗上具有自身独到的特点。通瘀煎(《景岳全书》)具有活血祛瘀,行气止痛的功效,临床主要用于气滞血积,经脉不利,痛极拒按等症。研究表明,通瘀煎具有治疗高脂血症、改善血液流变学、抗炎等多种药理活性〔6〕,提示其可能通过改善脂质代谢紊乱及脂质沉积、改善血液流变学等作用对血管壁起到较好的保护作用。本研究拟探讨通瘀煎的抗AS作用及其作用机制。
1 材料及方法
1.1实验动物 8周龄健康雄性SPF级载脂蛋白(Apo)E基因敲除小鼠50只,体重(25.0±2.0)g,购自北京微通利华实验动物技术有限公司〔许可证号SCXK(京)2012-0001〕;8周龄SPF级雄性C57BL/6雄性小鼠10只,体重(20.0±2.0)g,购自广东省动物实验中心〔许可证号SCXK(粤)2015-0109〕。
1.2通瘀煎药材组方 当归尾15.0 g,山楂6.0 g,香附6.0 g,红花6.0 g,乌药6.0 g,青皮4.5 g,泽泻4.5 g,木香2.1 g,均购自康美药业。阿托伐他汀钙片(立普妥,规格:20 mg×7片)购自辉瑞制药有限公司;羧甲基纤维素钠(CMC-Na)购自上海博湖生物科技有限公司。高脂饲料(3%胆固醇、0.5%胆酸钠、0.2%丙基硫氧嘧啶、5%白糖、10%猪油、81.3%基础饲料均匀混合而成,以钴60辐照-辐照剂量25.0 kGy)由广东省实验动物中心加工。
1.3仪器及试剂 LBY-N6B型全自动模块式血液流变仪;生物组织包埋机(TB-718D型);智能程控生物组织自动脱水机(TC-120S型);Zeiss-Axioskop20显微镜电子显微镜、透射电镜;E-选择素(E-selectin)酶联免疫吸附试验(ELISA)试剂盒、血管细胞黏附分子(ICAM)-1 ELISA试剂盒、血管内皮细胞黏附分子(VCAM)-1 ELISA试剂盒、白细胞介素(IL)-6 ELISA试剂盒、干扰素(IFN)-γ ELISA试剂盒均购自上海拜力生物科技有限公司。抗-细胞因子信号转导抑制蛋白(SOCS)1单抗、抗-细胞内信号传导及转录活化子(STAT)3单抗、抗-phospho-STAT3(Tyr701)单抗均购自广州浩玛生物科技有限公司。
1.4动物分组及给药 采用随机数字表法,50只ApoE基因敲除小鼠随机分为5组各10只,模型组、阳性药物组(立普妥组)、通瘀煎低、中、高剂量组均以高脂饲料饲养;C57BL/6雄性小鼠10只为空白组,以普通饲料喂养。实验第1天起,通瘀煎高、中、低剂量组分别给予通瘀煎26.0、13.0、6.5 g/(kg·d)灌胃给药;立普妥组给予立普妥5 mg/(kg·d)灌胃给药(药物均用0.5% CMC-Na配成混悬溶液后给药),空白组、模型组给予等量0.5% CMC-Na灌胃,均持续给药12 w。通瘀煎常规中药煎煮,经减压旋转浓缩成每毫升相当于1 g生药的混悬液。
1.5指标检测 ①小鼠主动脉石蜡冰冻切片,以苏木素-伊红(HE)染色,Zeiss-Axioskop20显微镜下观察主动脉管壁形态学变化情况。②AxiocanHRc相机拍摄主动脉HE染色切片,用Leica Qwin Image Processing and Analysis软件分析切片上显示的AS和血管横截面管腔面积。③主动脉超薄切片,采用JEM-1200EX型透射电镜观察管壁超微结构变化。④血清总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)含量的测定; ⑤ELISA检测血液中黏附分子E-selectin、ICAM-1、VCAM-1的含量及主动脉组织内IL-6、IFN-γ、肿瘤坏死因子(TNF)-α的含量; ⑥Western印迹法分析主动脉STAT3、磷酸化(p)STAT3、SOCS1蛋白表达水平。
1.6统计学方法 采用SPSS16.0软件进行正态性检验、单因素方差分析、LSD-t检验。
2 结 果
2.1各组主动脉组织形态学 空白组主动脉形态规则完整,内膜光滑,没有出现局部缺损或增厚,内弹力层连续规整、无断裂现象,平滑肌细胞呈整齐有序排列,未见炎性细胞浸润,管腔内无赘生物形成。模型组主动脉形态结构出现明显改变,内膜明显增生、增厚,连续性结构破坏,大量泡沫细胞积聚在管腔内、大量胆固醇结晶堆积,内膜增生处明显的缺损及间断性钙化灶和无结构样坏死物,明显的AS斑块纤维帽;中膜亦出现增厚、变形,内膜层可见大量的平滑肌细胞堆聚。与模型组比较,各给药组主动脉根部粥样斑块的形成明显受到抑制,病变程度明显减轻,其中通瘀煎低剂量组主动脉根部斑块内的脂质中心面积相对变小,断续性钙化灶和无结构样坏死物;通瘀煎高剂量组AS病变程度最轻,仅少量钙化灶和无结构样坏死物。见图1。
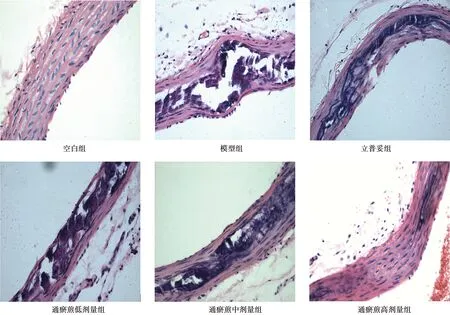
图1 各组主动脉组织病理(HE染色,×200)
2.2各组主动脉粥样硬化病变相对面积 与空白组〔(0.76±0.11)%〕相比,模型组主动脉病变相对面积〔(26.37±4.59)%〕显著增加(P<0.01)。与模型组相比,立普妥组〔(9.51±1.68)%〕、通瘀煎低、中、高剂量组主动脉病变相对面积〔(13.68±2.27)%,(12.87±2.55)%,(9.83±1.81)%〕均有明显减少(P<0.01,P<0.05)。与通瘀煎中、低剂量组相比,立普妥组及通瘀煎高剂量组主动脉病变相对面积较少(P<0.05)。
2.3主动脉电镜观察 空白组主动脉内皮细胞排列整齐、形态正常,细胞核完整,内弹力膜连续完整无缺损、厚薄均匀,未发现脂质空泡形成及胶原纤维增生。模型组主动脉出现一定程度的病理改变,内皮细胞出现大量脱落、坏死,坏死处的内皮细胞基本消失,出现大量细胞碎片及纤维样物质,大量脂质沉积于内皮下方,间质内亦可见大量胶原纤维附着,内弹力膜出现连续性破坏,部分区域有灶性溶解,大量泡沫细胞浸润,胶原纤维显著增多。与模型组比较,各给药组主动脉超微结构病理改变均有不同程度减轻,其中通瘀煎低浓度组主动脉内皮细胞出现少部分脱离,有少量坏死内皮细胞,弹力膜呈间断性破坏,局部可见溶解,散在性脂滴浸润于内皮下层,有少量泡沫细胞堆积及胶原纤维增生出现在中膜内;通瘀煎高剂量组内弹力膜结构基本完整,AS超微结构改变最少,内皮下仅观察到少许胶原纤维沉积及脂质空泡浸润。见图2。
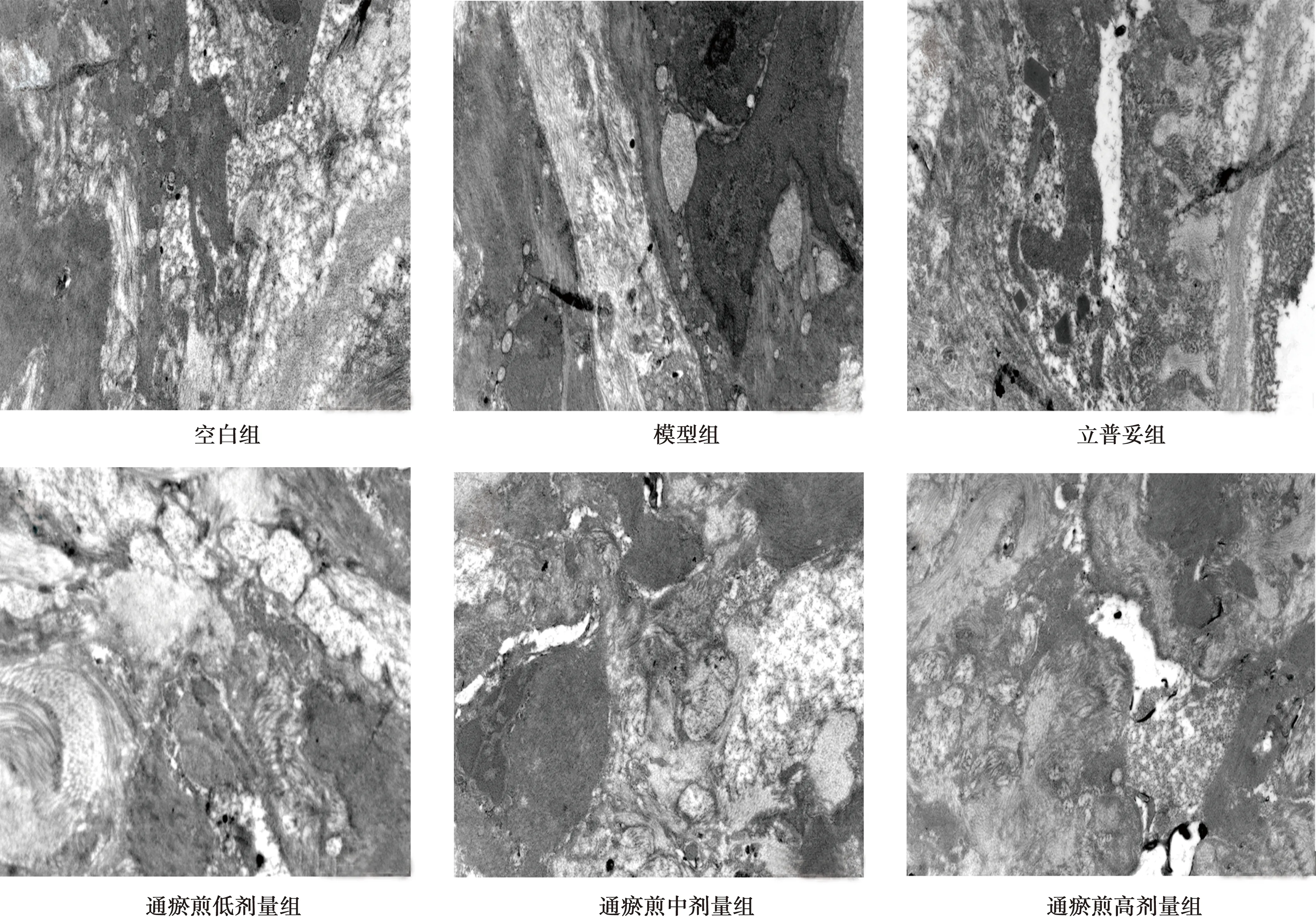
图2 各组主动脉超微结构(透射电镜,×12 500)
2.4各组血清TC、TG、HDL-C、LDL-C含量比较 与空白组相比,模型组TC、TG及LDL-C显著升高、HDL-C显著降低(P<0.01)。与模型组相比,立普妥组与通瘀煎中、高剂量组TC、TG及LDL-C含量明显降低,HDL-C含量明显升高(P<0.05,P<0.01)。与模型组相比,通瘀煎低剂量组血脂改善并不明显(P>0.05),但有下降的趋势。与通瘀煎中、低剂量组相比,立普妥组和通瘀煎高剂量组TC、TG及LDL-C含量明显降低,HDL-C含量明显升高(P<0.05)。见表1。
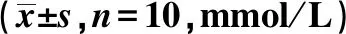
表1 各组血清TC、TG、HDL-C、LDL-C含量比较
与空白组比较:1)P<0.01;与模型组比较:2)P<0.01,3)P<0.05;与通瘀煎中、低剂量组比较:4)P<0.05;表2、3同
2.5各组血清黏附分子含量比较 与空白组相比,模型组血清E-selectin、ICAM-1、VCAM-1含量显著升高(P<0.01)。与模型组相比,立普妥组、通瘀煎中、高剂量组血清E-selectin、ICAM-1、VCAM-1含量明显降低(P<0.01,P<0.05),通瘀煎低剂量组E-selectin含量显著降低(P<0.05),VCAM-1、ICAM-1有下降趋势,但无统计学差异(P>0.05)。通瘀煎中、低剂量组ICAM-1、VCAM-1显著高于立普妥组和通瘀煎高剂量组(P<0.05),见表2。
2.6各组主动脉内炎症因子的含量比较 与空白组相比,模型组主动脉组织IL-6、IFN-γ、TNF-α含量显著升高(P<0.01)。与模型组相比,立普妥组与通瘀煎高剂量组主动脉组织IL-6、IFN-γ、TNF-α含量明显降低(P<0.01)。通瘀煎中、低剂量组主动脉组织IL-6、TNF-α含量显著低于模型组且高于立普妥组和通瘀煎高组(P<0.05,P<0.01)。见表3。
2.7各组主动脉STAT3、p-STAT3、SOCS1蛋白表达比较 与空白组相比,模型组主动脉组织STAT3、SOCS1含量显著降低(P<0.01),p-STAT3显著升高(P<0.01)。与模型组相比,立普妥组、通瘀煎高、中剂量组主动脉组织STAT3、SOCS1含量明显增高(P<0.05,P<0.01),p-STAT3含量明显降低(P<0.01),通瘀煎低剂量组主动脉组织p-STAT3含量明显降低(P<0.05),SOCS1含量明显增高(P<0.05)。通瘀煎高剂量组p-STAT3含量降低及SOCS1增高显著优于各给药组(P<0.05)。见表4。
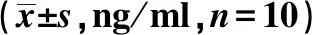
表2 各组血清E-selectin、ICAM-1、VCAM-1含量比较
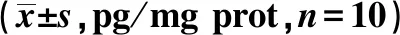
表3 各组主动脉内炎症因子IL-6、IFN-γ、TNF-α含量比较
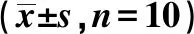
表4 各组主动脉组织STAT3信号通路相关蛋白表达水平比较
与空白组比较:1)P<0.01;与模型组比较:2)P<0.01,3)P<0.05;与通瘀煎中、低剂量组比较:4)P<0.05;与立普妥组比较:5)P<0.05
3 讨 论
AS是临床常见的一种血管病变,是现阶段威胁人类健康最为严重的心血管疾病之一。目前,人类对AS的研究已经由最初单一的血脂变化逐渐发展到管壁细胞学、内皮功能紊乱、氧化应激、炎症反应等多个方面。AS是一种炎症性疾病,血管内、外的炎症反应贯穿于AS发生发展的前过程。IL-6是炎症反应瀑布的源头所在,发挥着极为重要的介导作用,参与AS的形成和发展过程,与AS病变程度呈正相关。IL-6通过与其受体紧密结合后,可诱导STAT3得以活化,活化后的STAT3(p-STAT3)可参与激活多种基因表达。研究证实,IL-6/STAT3信号传导通路在AS中可被激活〔7〕,IL-6为源头所在,其过度表达可激活STAT3信号通路,从而表现出促AS作用〔8〕。事实上,这种慢性炎症反应的发生,是由VCAM-1、ICAM-1和E-selectin等黏附分子所介导的。AS的形成过程中ICAM-1、VCAM-1、E-selectin等黏附分子介导的炎症过程,在AS的发生发展全程中起着非常重要的作用,可明显增强聚集反应,导致斑块的形成,并影响粥样斑块的稳定性〔9,10〕。
本研究中AS小鼠血脂、黏附分子及炎症因子的各项指标趋势与主动脉组织病理学变化大致相符。可见,AS模型小鼠存在严重的脂质代谢紊乱、血清黏附分子及炎症因子大量生成,这一结果也进一步验证实了AS是一种炎症反应,AS的过程伴随有大量炎症因子的释放。本研究提示AS模型主动脉组织中STAT3被活化,主动脉组织及血液中IL-6、IFN-γ、TNF-α等炎症因子大量表达。通过药物干预后发现,通瘀煎可纠正或改善AS小鼠脂质代谢紊乱,减少血液中黏附分子E-selectin、VCAM-1、ICAM-1及主动脉组织中IL-6、IFN-γ、TNF-α等炎症因子的含量,诱导SOCS1的蛋白含量表达,减少STAT3的磷酸化,从而抑制增生信号通路IL-6/STAT3的活化,从而显著抑制或改善AS小鼠血液黏、凝、稠、聚的“血瘀”证状态。因此认为,通瘀煎的抗AS作用可能通过抑制IL-6/STAT3信号通路,发挥其抗炎、抗增生效应,从而有效抑制AS斑块的形成。
综上,AS状态下,主动脉组织中大量IL-6、IFN-γ、TNF-α等炎症因子的生成,可刺激STAT3增生信号通路的激活,相关的基因及蛋白表达均呈现出高水平表达。通瘀煎低、中、高剂量均表现出一定的抗AS作用,以高剂量组效果最佳。其可能通过降脂、减少炎症因子的释放、抑制主动脉内炎症及增生反应的发生,从而表现出较好的抗AS斑块形成的作用。此外,在本实验周期范围内,低剂量的通瘀煎具有一定的抗AS作用,但其对AS小鼠并未呈现出明显的降脂作用。因此推测,低剂量通瘀煎可能不在其降脂最小有效剂量范围,其降脂效应在一定范围内可能呈剂量依赖性。但通瘀煎低剂量组主动脉根组织病理形态改变明显优于模型组,未发现有明显粥样斑块的形成,提示通瘀煎可能有独立于降脂之外的抗AS作用,这一作用可能是通过其良好的抗炎作用得以实现。
