多奈哌齐联合丁苯酞对多发性脑梗死性痴呆的预后及血清中血管内皮生长因子、血管内皮生长因子受体水平的影响
2020-04-30陈冬
陈冬
多发性脑梗死性痴呆是由多发脑梗死或多次脑缺血引起的智力性衰退现象,临床上属于脑血管性痴呆[1]。大脑局部缺血导致脑神经细胞凋亡,若治疗不及时会导致病人自主神经功能紊乱、行为异常、肺部感染等并发症发生,对病人的生活质量造成严重影响[2]。丁苯酞常用于脑组织缺血疾病的治疗,近年来逐渐应用于脑血管性痴呆的治疗,并取得一定效果[3-4]。多奈哌齐是一种胆碱酯酶抑制剂,广泛用于脑血管性痴呆的治疗[5],为提高治疗效果,本文研究多奈哌齐联合丁苯酞对多发性脑梗死性痴呆病人血清中血管内皮生长因子(vascular endothelial growth factor,VEGF)、血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR)水平及预后影响。
1 资料与方法
1.1 一般资料 选取2018 年1 月至2019 年3 月于江汉大学附属武汉市第六医院接受治疗的多发性脑梗死性痴呆病人102 例,采用随机数字表法分为观察组与对照组,观察组51例,男27例,女24例,年龄范围为58~78 岁,年龄(65.27±5.64)岁;对照组51例,男26 例,女25 例,年龄范围为57~80 岁,年龄(64.37±6.38)岁。两组病人年龄、性别比较,差异无统计学意义(P>0.05)。
1.2 纳入与排除标准 纳入标准:①符合2013 年美国精神病学会修订的《精神病的诊断和统计手册第5版(DSM IV)》中关于多发性脑梗死性痴呆诊断标准;②有多发性脑梗死病史,发病前无认知功能障碍,发病后3个月出现认知功能障碍;③近1个月未服用过促智或精神药物;④病人近亲属或监护人签署知情同意书。排除标准:①严重的心、肝、肾功能障碍或患有血液系统疾病;②因神经症、失语、阿尔兹海默症或其他原因引起的痴呆;③患有精神病或其他神经系统疾病;④对胆碱酯酶抑制剂过敏者。本研究符合《世界医学协会赫尔辛基宣言》相关要求。
1.3 治疗方法 两组病人均参照脑血管病二级预防给予基础治疗,包括控制病人血压、血脂、血糖,以及抗血小板凝集治疗。对照组在常规治疗基础上给予口服丁苯酞软胶囊(石药集团恩必普药业有限公司,生产批号6181710037)治疗,2 克/次,3 次/天,观察组在对照组治疗基础上联合多奈哌齐[卫材(中国)药业有限公司,生产批号12050978]治疗,5 毫克/次,1 次/天,于晚上口服;丁苯酞用法用量同对照组。两组病人均连续用药16周。
1.4 观察指标与疗效评价 ①采用简易精神状态评定表(minimum mental state examination,MMSE)评定治疗前后两组病人认知功能变化情况。MMSE量表评价内容包括语言能力、注意力、与回忆力等。总分30分,得分越高表示认知功能越好。MMSE评分<12分,表示重度痴呆;MMSE评分为12~18分,表示中度痴呆;MMSE评分为18~24分,表示轻度痴呆。
②采用临床痴呆评定量表(clinical dementia rating,CDR)评定治疗前后两组病人的痴呆程度变化情况。评价内容包括记忆力、判断与结合决问题的能力等,根据评分结果判定痴呆程度,0 分为正常,0.5分~1分为可疑;1~2分为轻度;2~3分为中度;3分及以上为重度。
③分别于治疗前后抽取两组病人晨起时空腹静脉血4 mL,离心,收集上层清液,采用双抗体夹心ELISA法检测病人血清中VEGF及VEGFR水平。
④采用Fugl-Meyer评分量表评定治疗前后两组病人运动功能变化情况,评定范围包括上肢、下肢两个方面,总分为100分,得分越高表示运动功能越好。Fugl-Meyer 评分<50 分,表示严重运动障碍;Fugl-Meyer 评分为50~85 分表示明显运动障碍;Fugl-Meyer 评分为86~95 分,表示为中度运动功能障碍;Fugl-Meyer评分为96~99分,表示轻度运动功能障碍。
⑤采用日常生活能力(activities of daily living,ADL)量表评价治疗前后两组病人日常生活能力改善情况,ADL 量表由工具性日常生活活动量表(instrumental activities of dailyliving,IADL)和躯体生活自理量表(physical self-maintenance scale,PSMS)组成,IADL 量表包括打电话、做家务、使用交通工具、服药等等;PSMS 量表包括进食、穿衣、洗澡等。得分越低表示日常生活能力越强,ADL评分<16分表示生活能力完全正常;ADL 评分为16~22 分,表示日常生活能力有所下降;ADL 评分>22 分,表示日常生活明显障碍。
⑥观察两组病人治疗过程中的不良反应发生情况。
1.5 统计学方法 本研究采用SPSS 19.0进行数据分析。其中计量资料采用表示,组间比较采用成组t检验,组内比较采用配对t检验。计数资料采用例数及率(%)表示,两组间比较采用χ2检验。P<0.05表示差异有统计学意义。
2 结果
2.1 治疗前后两组病人MMSE、CDR 评分变化情况比较 治疗前,两组病人的MMSE、CDR 评分比较,差异无统计学意义(P>0.05);与治疗前相比,治疗后两组病人MMSE、CDR评分降低,差异有统计学意义(P<0.05);与治疗后对照组相比,治疗后观察组病人MMSE、CDR 评分降低,差异有统计学意义(P<0.05)。见表1。
表1 治疗前后两组病人MMSE、CDR评分变化情况/(分)
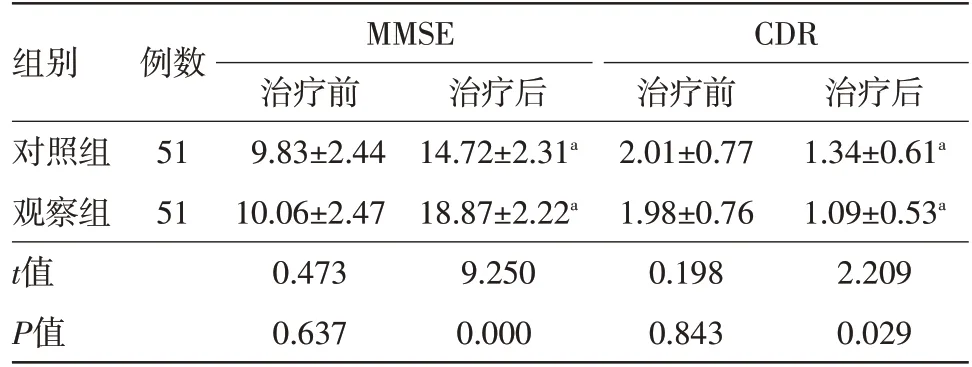
表1 治疗前后两组病人MMSE、CDR评分变化情况/(分)
注:组内与治疗前相比,aP<0.05,MMSE 为精神状态评分,CDR为临床痴呆程度评分
组别对照组观察组t值P值例数51 51 MMSE CDR治疗后1.34±0.61a 1.09±0.53a 2.209 0.029治疗前9.83±2.44 10.06±2.47 0.473 0.637治疗后14.72±2.31a 18.87±2.22a 9.250 0.000治疗前2.01±0.77 1.98±0.76 0.198 0.843
2.2 治疗前后两组病人血清VEGF、VEGFR 水平变化情况比较 治疗前,两组病人的血清VEGF、VEGFR水平比较,差异无统计学意义(P>0.05);与治疗前相比,治疗后两组病人血清VEGF、VEGFR水平升高,差异有统计学意义(P<0.05);与治疗后对照组相比,治疗后观察组病人血清VEGF、VEGFR水平升高,差异有统计学意义(P<0.05)。见表2。
表2 治疗前后两组病人血清VEGF、VEGFR水平变化情况/(ng/L,)

表2 治疗前后两组病人血清VEGF、VEGFR水平变化情况/(ng/L,)
注:组内与治疗前相比,aP<0.05,VEGF 为血管内皮生长因子,VEGFR为血管内皮生长因子受体
组别对照组观察组t值P值例 数 5 1 VEGF VEGFR治疗后476.68±39.62a 503.32±37.43a 3.490 0.001 51治疗前438.36±41.85 443.17±43.53 0.569 0.571治疗后473.49±43.63a 537.35±41.78a 7.550 0.000治疗前403.14±40.63 406.37±41.25 0.398 0.691
2.3 治疗前后两组病人运动功能比较 治疗前,两组病人Fugl-Meyer评分的上肢、下肢得分比较,差异无统计学意义(P>0.05);与治疗前相比,治疗后两组病人Fugl-Meyer评分的上肢、下肢得分升高,差异有统计学意义(P<0.05);与治疗后对照组相比,治疗后观察组病人Fugl-Meyer 评分的上肢、下肢得分升高,差异有统计学意义(P<0.05)。见表3。
表3 治疗前后两组病人运动功能Fugl-Meyer评分比较/(分,)

表3 治疗前后两组病人运动功能Fugl-Meyer评分比较/(分,)
注:组内与治疗前相比,aP<0.05
组别对照组观察组t值P值例数51 51上肢功能下肢功能治疗后16.89±2.42a 23.56±3.46a 11.281 0.000治疗前9.11±2.65 8.91±2.79 0.371 0.711治疗后23.12±3.54a 35.73±6.21a 12.598 0.000治疗前8.12±2.67 7.47±2.72 1.218 0.226
2.4 治疗前后两组病人生活能力比较 治疗前,两组病人ADL 评分比较,差异无统计学意义(P>0.05);与治疗前相比,治疗后两组病人ADL 评分降低,差异有统计学意义(P<0.05);与治疗后对照组相比,治疗后观察组病人ADL 评分降低,差异有统计学意义(P<0.05)。见表4。
表4 治疗前后两组病人日常生活能力评分比较/
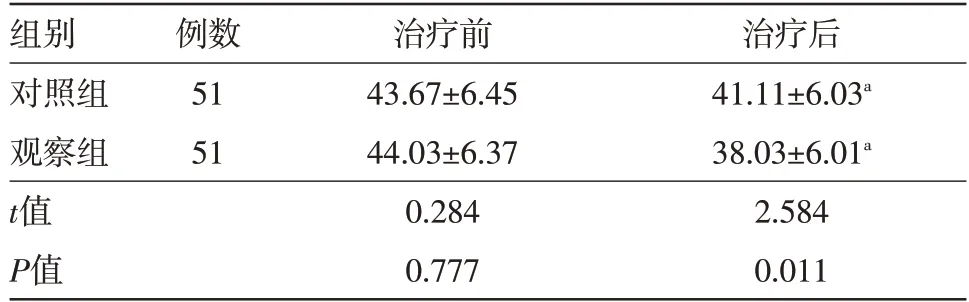
表4 治疗前后两组病人日常生活能力评分比较/
注:组内与治疗前相比,aP<0.05
组别对照组观察组t值P值治疗后41.11±6.03a 38.03±6.01a 2.584 0.011例数51 51治疗前43.67±6.45 44.03±6.37 0.284 0.777
2.5 治疗过程中两组病人不良反应发生情况 两组病人均未见死亡或其他严重不良反应发生,观察组与对照组病人各出现2 例(3.92%)头晕、腹泻,1例(1.96%)表情减少、肌肉强直等不良反应。此外,观察组发生1 例(1.96%)躁动、情绪易怒等不良反应,停止用药后,症状消失或减弱。两组病人在治疗期间生命体征平稳。观察组病人的不良反应发生率为7.84%(4/51),对照组病人为5.88%(3/51),两组病人不良反应发生率比较,差异无统计学意义(χ2=0.153,P>0.05)。
3 讨论
多发性脑梗死性痴呆是由脑血管壁病变加上血流动力学改变导致的认知功能障碍。该病为慢性进行性疾病,发病机制较为复杂,目前认为致病的主要原因之一是胆碱能的缺乏导致相应的神经元功能缺失[6],故采用胆碱酯酶抑制剂类药物治疗可能取得满意疗效。
丁苯酞作为中国自主研发的抗脑缺血药物,常作为临床治疗脑梗死性痴呆的药物,可缓解细胞水肿、改善脑部血液微循环、增强脑代谢,从而减少神经细胞凋亡[7-8],单独使用时,临床疗效尚不能令人满意。多奈哌齐作为第二代选择性胆碱酶抑制剂,通过特异性地抑制大脑内乙酰胆碱酯酶对乙酰胆碱的水解,增加基底核神经突触间隙及大脑皮质中乙酰胆碱浓度,减轻因胆碱能传递受损而导致的神经元变性,从而改善病人认知功能[9]。对于脑梗死后痴呆病人,采用多奈哌齐于丁苯酞联合治疗,可以在改善脑部血液循环的同时提升神经传导功能,有利于病人运动功能及认知功能的恢复。
本研究采用多奈哌齐联合丁苯酞治疗多发性脑梗死性痴呆,结果发现治疗后两组病人的MMSE、CDR 评分均明显降低,但观察组降低效果显著,与文献[10-11]研究结果一致。提示丁苯酞可改善病人认知障碍,缓解病人痴呆程度,但联合多奈哌齐治疗脑梗死性痴呆,病人认知障碍和痴呆程度可得到进一步改善。VEGF 是特异性的血管生成因子,具有促进新血管生成作用[12]。VEGF 和其受体VEGFR具有高度亲和力,二者结合共同促进血管内皮细胞增殖,调控血管发生和成熟[13-14]。研究发现脑组织损伤后,VEGF/VEGFR 系统激活,促使VEGF 和VEGFR高表达[15],二者特异性地作用于血管内皮细胞,促进血管内皮细胞增殖及侧支循环建立。大量研究表明VEGF、VEGFR 水平随缺血缺氧程度动态变化,脑梗死急性期脑组织对VEGF、VEGFR需求增加,侧枝循环建立后,二者水平逐渐下降[16]。本研究发现,治疗后两组病人的VEGF与VRGER水平均升高,但观察组升高效果显著,提示丁苯酞联合多奈哌齐治疗脑梗死性痴呆可有效减少脑梗死急性期神经细胞凋亡或坏死,促进侧枝循环建立,从而改善脑供血、减轻脑缺血再灌注脑损伤。
进一步研究发现,治疗后两组病人的Fugl-Meyer 评分的上肢、下肢得分、ADL 评分结果均得到改善,其中观察组改善程度更优,提示两组病人在接受治疗后,运动功能得到明显改善,但联合应用较单独服用丁苯肽治疗更能有效改善病人的运动功能;治疗后ADL 评分下降,观察组下降效果较对照组显著,与郭阳等[17]研究结果相似,提示联合治疗更能有效改善病人生活能力,提高病人生活质量。通过对治疗过程中两组病人不良反应发生情况比较发现,观察组和对照组病人均无明显不良反应出现,提示使用多奈哌齐联合丁苯酞治疗不会增加药物的不良反应,该治疗方案值得在临床推广应用。
综上所述,丁苯酞软胶囊联合多奈呱齐治疗多发性脑梗死性痴呆在改善病人认知功能、痴呆程度、神经功能、改善病人预后方面较单独使用丁苯酞效果更好,且在提高临床效果的同时不会增加不良反应。但本研究仍存在不足,如因纳入对象较少、随访时间较短,可能造成结果一定偏倚,故在后期临床研究中,纳入更多样本进行远期随访,深入探究丁苯酞软胶囊、多奈呱齐的具体作用机制。
