UPLC-ESI-MS/MS法分析藤黄炮制前后化学成分的变化
2016-06-01潘凌云修彦凤
潘凌云, 徐 敏, 王 亿, 修彦凤*
(1.上海中医药大学中药学院,上海201203;2.上海中医药大学科技实验中心,上海201203)
UPLC-ESI-MS/MS法分析藤黄炮制前后化学成分的变化
潘凌云1,2, 徐敏1, 王亿1, 修彦凤1*
(1.上海中医药大学中药学院,上海201203;2.上海中医药大学科技实验中心,上海201203)
摘要:目的 建立超高效液相色谱-电喷雾-串联质谱(UPLC-ESI-MS/MS)法研究藤黄Garcinia hanburyi炮制(高压、豆腐、清水、荷叶制)前后化学成分的变化。方法 分析采用Acquity UPLCBEH C8(2.1 mm×100 mm,1.7 μm)色谱柱;流动相为乙腈-0.1%甲酸溶液,梯度洗脱;柱温为35℃;体积流量为0.3 mL/min。主成分分析(PCA)和偏最小二乘判别(PLS-DA)法分析炮制前后化学成分的差异。结果 炮制前后,藤黄中化学成分的种类没有明显变化。当加热超过2 h,以及豆腐或荷叶炮制后,13种成分的含有量下降,并且gambogenin更为明显。不同炮制方法间存在差异,贡献值依次为gambogenin、莫里林酸、异莫里林酸、R-异藤黄酸、R-30-羟甲基藤黄酸、成分5(未知)、异新藤黄酸、S-30-羟甲基藤黄酸、isogambogenin、S-异藤黄酸、R-藤黄酸、新藤黄酸、S-藤黄酸。结论 不同炮制方法和加热时间对藤黄化学成分有一定影响,其含有量的降低可能是该植物炮制后减毒的原因之一。
关键词:藤黄;炮制;化学成分;UPLC-ESI-MS/MS;PCA;PLS-DA
KEY WORDS:Garcinia hanburyi;processing;chemical constituents;UPLC-ESI-MS/MS;PCA;PLS-DA.
藤黄为藤黄科植物藤黄Garcinia hanburyi Hook.f.所分泌的胶质树脂。有大毒,对局部组织有较强的刺激性,内服后可刺激胃壁神经和肠黏膜,使胃部分泌物增多,肠蠕动亢进,胆汁增加。剂量较大时,可引起胃肠炎甚至肠出血等[1]。藤黄经炮制后,其毒性均有不同程度的下降[2-4],内服应用必须要经过炮制。90年代,叶定江课题组采用薄层扫描法与高效液相色谱法测定藤黄及其炮制品中藤黄酸和新藤黄酸的含有量,结果表明炮制前后化学成分未发生明显变化[5-7]。近年来对于藤黄的研究主要集中在其抗肿瘤作用及其机制的研究,对于藤黄炮制过程的物质基础变化未见进一步的研究,其炮制减毒机理的研究也未见报道。为了开展藤黄炮制减毒机理的研究,本课题采用超高效液相色谱-电喷雾-串联质谱(UPLC-ESI-MS/MS)法测定了不同炮制方法(高压制、豆腐制、清水制和荷叶制)和不同加热炮制时间的藤黄炮制品,探讨藤黄炮制前后化学成分发生的动态变化,为深入探究其炮制减毒机理奠定基础。
1 材料与仪器
1.1 仪器 Waters Acquity超高效液相色谱仪(美国Waters公司);API5500三重四极杆质谱仪(美国AB Sciex公司);SB-3200D超声清洗机(宁波新芝生物科技有限公司);Sartorius CP225D电子分析天平(德国赛多利斯公司);01J2003-04立式压力蒸汽灭菌锅(上海东亚压力容器制造有限公司)。
1.2 材料 5批生藤黄样品(S1~S5)分别购自亳州市百洲堂电子有限公司、亳州市华礁商贸有限公司、亳州市药材市场、上海童涵春堂中药饮片厂和上海市药材公司,经上海中医药大学丁文平教授鉴定为藤黄科植物藤黄Garcinia hanburyi Hook.f.所分泌的胶质树脂。藤黄酸(批号T0434)、新藤黄酸(批号X0435)购自上海顺勃生物工程技术有限公司,含有量≥98%;五味子甲素(批号110764-200408)购自中国食品药品检定研究院;清美老豆腐购自上海联华超市;荷叶购自上海养和堂药店。乙腈为色谱纯;水为超纯水;其他试剂均为分析纯。
2 方法与结果
2.1 藤黄不同炮制品的制备[8]
2.1.1 生藤黄 将5份原药材拣去杂质,研细,过24目筛,编号S1~S5。
2.1.2 高压制藤黄 分别取生藤黄粗粉5份,每份20 g,置于蒸发皿中,高压蒸锅0.12 MPa下蒸制0.5、1、2、3 h,取出,低温干燥,研细,过24目筛,即得。
2.1.3 豆腐制藤黄 将豆腐块平铺于瓷盘内,分别取生藤黄粗粉5份,每份50 g,置于500 g豆腐上,再覆盖另一层豆腐,常压蒸1、2、3、4 h,至藤黄全部溶化后取出,冷却凝固,除去豆腐,低温干燥,研细,过24目筛,即得。
2.1.4 清水制藤黄 分别取生藤黄粗粉5份,每份50 g,放入烧杯内,加10倍量水煮沸,滤过,不断搅拌,中途添加沸水,连续煮0.5、1、2、3、5 h,浓缩至糊状,取出,低温干燥,研细,过24目筛,即得。
2.1.5 荷叶制藤黄 取50 g荷叶,分别加入10、8倍量水煎煮2次,时间分别为30、20 min,滤过,合并滤液,浓缩得到荷叶汁(0.1 g/mL),取500 mL,分别加入生藤黄粗粉5份,每份50 g,煮至烊化,并继续浓缩至稠膏状,取出,低温干燥,研细,过24目筛,即得。
2.2 样品溶液的制备
2.2.1 对照品溶液 精密称取藤黄酸、新藤黄酸5.0 mg,五味子甲素2.5 mg,置于5 mL量瓶中,甲醇溶解并定容,摇匀,即得。临用前,用流动相稀释。
2.2.2 供试品溶液的制备 分别精密称取藤黄不同炮制品(生品、高压、豆腐、清水、荷叶制)细粉0.05 g,置于离心管中,精密加入甲醇5 mL,密塞,称定重量,超声10 min(功率180 W、频率40 kHz),放冷,甲醇补足减失重量,离心5 min (5 000 r/min),精密吸取上清液0.1 mL,加入内标五味子甲素(0.5 mg/mL)0.1 mL,甲醇稀释定容至10 mL。再精密吸取上清液50 μL,甲醇稀释定容至5 mL,0.22 μm微孔滤膜滤过,即得。
2.3 色谱与质谱条件
2.3.1 液相色谱条件 色谱柱Acquity UPLC BEH C8色谱柱(2.1 mm×100 mm,1.7μm);流动相乙腈(A)-0.1%甲酸水溶液(B);梯度洗脱(0→8.5 min,70%A;8.5→9.5 min,90%A;9.5→10 min,70%A);柱温为35℃;体积流量为0.3 mL/min,进样量为1 μL。
2.3.2 质谱条件 电喷雾离子源(ESI),正离子扫描模式;离子源喷雾电压5.5 kV;离子源气帘气241.3 kPa;碰撞气48.3 kPa;离子源温度500℃;雾化气413.7 kPa;辅助气413.7 kPa;多反应监测模式(MRM)。
2.4 藤黄不同炮制品的UPLC-ESI-MS/MS分析取“2.2”项下对照品和藤黄不同炮制品溶液,按“2.3”项下方法分析。参考文献[9-11],选取m/z分别为561、631、615、629、645的准分子离子,再结合MS2的主要碎片离子作为离子对进行监测,得到13个化合物的色谱峰。参考对照品藤黄酸、新藤黄酸设定的质谱参数,进一步优化其他各化合物的碰撞能量(CE)、去簇电压(DP)、碰撞室出口电压(CXP),UPLC-ESI-MS/MS多反应监测模式图见图1。通过质谱分析,得到各化合物在正离子模式下的色谱图,通过与对照品的保留时间和质谱信息进行对照(图1A),再结合文献[9-11],最终推断出了12个色谱峰所对应的化合物,结果见表1。
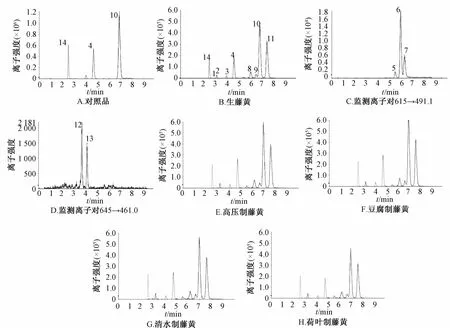
1.异莫里林酸 2.莫里林酸 3.异新藤黄酸 4.新藤黄酸 5~7.未知、isogambogenin、gambogenin 8.R-异藤黄酸9.S-异藤黄酸 10.R-藤黄酸 11.S-藤黄酸 12.R-30-羟甲基藤黄酸 13.S-30-羟甲基藤黄酸 14.五味子甲素1.isomorellic acid 2.morellic acid 3.isogambogenic acid 4.gambogenic acid 5-7.unknown,isogambogenin and gambogenin 8.R-isogambogic acid 9.S-isogambogic acid 10.R-gambogic acid 11.S-gambogic acid 12.R-30-hydroxygambogic acid 13.S-30-hydroxygambogic acid 14.deoxyschizandrin图1 多反应离子监测色谱图Fig.1 M ultip le reaction monitoring(MRM)chromatogram s
2.5 数据分析
2.5.1 藤黄加热炮制前后化学成分的动态变化将藤黄不同成分的色谱峰面积除以内标物五味子甲素的对应峰面积,即得到每个色谱峰的相对峰面积,以消除前处理及测定过程中出现的误差。将5批藤黄炮制品与生藤黄的相对峰面积平均值进行比较,结果见表2,13种成分在不同藤黄炮制品中的变化见图2。
由表2、图2可知,高压制0.5~1 h后,藤黄中gambogenin含有量降低,其他成分变化不大;2 h后,其含有量降低,而其他成分明显增加;3 h后,各成分含有量均降低。豆腐制藤黄1~2 h后,除gambogenin含有量降低外,其他成分变化不大;3~4 h后,各成分含有量均降低。清水制藤黄1~3 h后,除gambogenin含有量明显降低外,大部分成分略有降低;煮至5 h时,13种成分含有量均降低。荷叶制藤黄后,各成分含有量均降低。
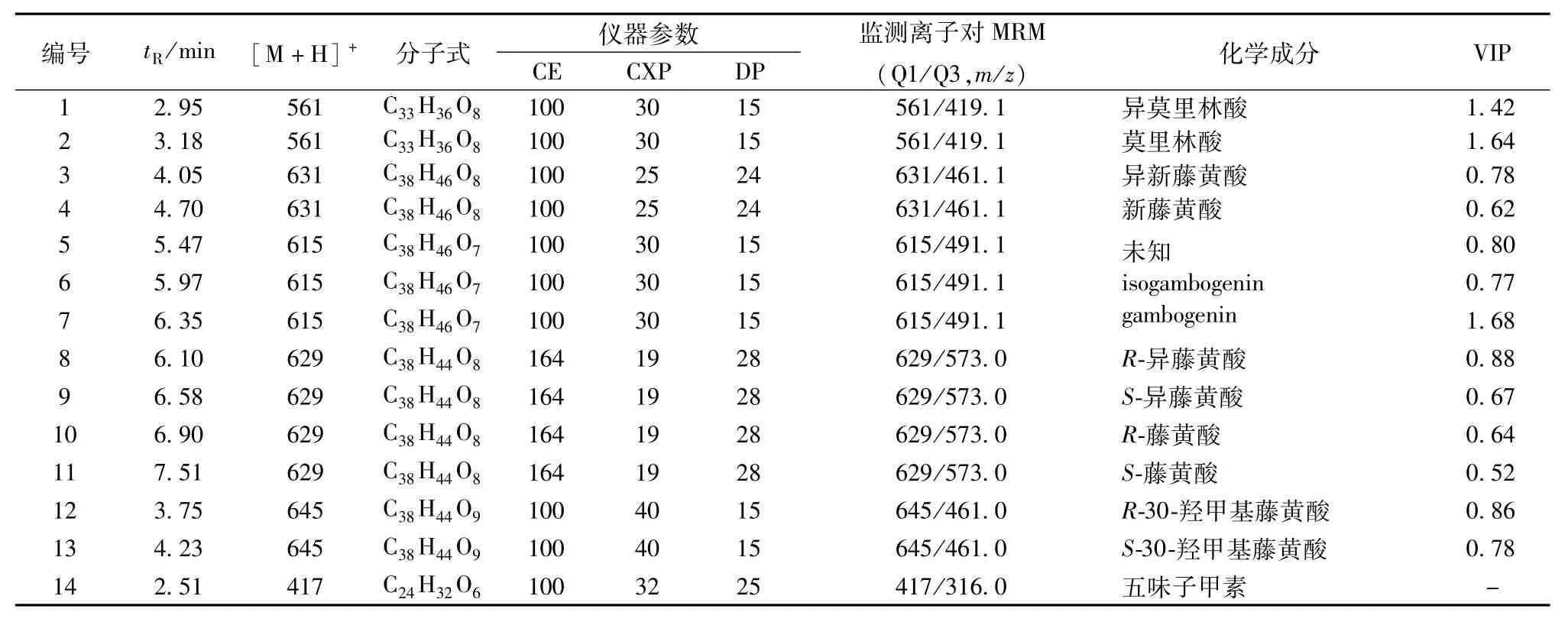
表1 分析数据及化学成分Tab.1 Analysis data and chem ical constituents

表2 相对峰面积比值Tab.2 Ratios of relative peaK areas

图2 各成分在不同样品中的变化趋势Fig.2 Changing trends of various constituents in different sam ples
综上所述,gambogenin在所有炮制品中的含有量均降低。炮制时间对炮制品中成分的含有量有影响,随高压、豆腐、清水制加热时间的延长,大部分成分的含有量先增加后减少,加热时间大于2 h后,各成分含有量明显减少。由图2可知,gambogenin含有量降低较明显,其他成分变化趋势基本一致。
2.5.2 主成分分析(PCA)和偏最小二乘法-判别分析(PLS-DA) 采用SIMCA-P11.0软件,对不同炮制方法的13种成分相对峰面积进行主成分分析(PCA),结果见图3。然后,通过偏最小二乘法-判别分析(PLS-DA)的VIP值来筛选炮制前后变化显著的化学标志物。
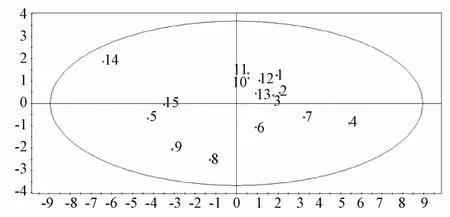
图3 PCA得分图Fig.3 PCA score plot
由图可知,生藤黄与炮制品2(高压制0.5 h)、3(高压制1 h)、10(清水制0.5 h)、11(清水制1 h)、12(清水制2 h)、13(清水制3 h)位置接近,而其他炮制品分别分布在不同区域。4(高压制2 h)、5(高压制3 h)、14(清水制5 h)、15(荷叶制)、6(豆腐制1 h)、7(豆腐制2 h)、8(豆腐制3 h)、9(豆腐制4 h)差别明显,表明加热时间大于2 h后,高压、清水、荷叶炮制品与生品有明显差异;豆腐制时间越长,其炮制品与生品差异越大,说明炮制时间和辅料豆腐对藤黄中的化学成分有一定影响。
然后,采用常用变量重要性投影VIP值来描述变量的贡献程度。经PLS-DA分析得到VIP值,由大到小依次为gambogenin >2 >1 >8 >12 >成分5(未知)>3 >13 >isogambogenin >9 >10 >4 >11,见表1。即gambogenin >莫里林酸>异莫里林酸>R-异藤黄酸>R-30-羟甲基藤黄酸>成分5(未知)>异新藤黄酸>S-30-羟甲基藤黄酸>isogambogenin > S-异藤黄酸>R-藤黄酸>新藤黄酸>S-藤黄酸。
3 结论与讨论
本实验采用UPLC-ESI-MS/MS法,分析了藤黄生品及其高压、豆腐、清水、荷叶炮制品中的化学成分,对其中13种成分的相对峰面积进行了PCA 和PLS-DA分析,发现藤黄加热炮制后,成分的种类没有明显变化;加热时间超过2 h,以及加豆腐或荷叶炮制后,各成分含有量变化明显,既包括含有量较高的藤黄酸和新藤黄酸等,也包括含有量较低的成分5(未知)、isogambogenin、gambogenin、R-30-羟甲基藤黄酸和S-30-羟甲基藤黄酸等。
通过比较不同炮制品与生藤黄的相对峰面积比值,发现当加热时间大于2 h并进一步延长时,大部分化学成分的含有量降低,与是否加辅料关系不大,孔令东等[8,12]报道,炮制时间为5 h时,藤黄的毒性降低,推测炮制后成分含有量的降低可能是其炮制减毒的原因之一。
藤黄因其毒性及炮制品质量标准问题而不能迅速推广,仍不在《中国药典》2015年版收载范围之列。因历史原因,藤黄各种炮制方法所用的辅料类型、辅料量、加热时间、炮制程度等差别较大,解毒程度亦不一致,从而一定程度上限制了其现代临床应用[13]。本实验发现,是否加辅料对藤黄中的大多成分影响不大,随着炮制加热时间延长而呈降低趋势,但加热时间的长短对藤黄药理作用的影响未有深入研究。藤黄采用何种方法进行炮制,以及炮制时间多长比较合适,需要结合药效及毒理学进行研究,以规范藤黄的炮制方法和工艺参数,保证质量稳定,为扩大其在中医临床上的应用奠定基础。
在优选内标成分时,曾试用熊果酸、齐墩果酸,发现两者更适合负离子模式出峰,而样品中化合物在正离子模式下响应更高;试用地西泮、白术内酯Ⅰ、补骨脂素、异补骨脂素时,在所选的色谱条件下出峰时间均较早;五味子甲素稳定性好、响应强、色谱保留时间适合、无干扰,因此选择其作为内标。在优化UPLC-MS/MS测定方法时,曾用Acquity UPLC BEH C18色谱柱(2.1 mm×100 mm,1.7 μm),但R-藤黄酸与S-藤黄酸的分离效果及峰形较差,改用C8色谱柱后,不仅改善了分离度,而且缩短了分析时间。
化合物5~7通过其一、二级质谱信息,结合文献[9-10],推断其中两个成分为isogambogenin 和gambogenin,而另一成分有待用其他质谱及NMR手段作进一步确认。
对化合物6、7进行MS/MS扫描分析,在相同碰撞能量下,发现两者的主要子离子都有m/z491,m/z463,m/z367,通过其一、二质谱信息及保留时间结合文献参考[9-10],推断化合物6、7分别为isogambogenin和gambogenin。对化合物5进行MS/MS扫描分析,在相同碰撞能量下,发现主要子离子有m/z491(m/z615分子失去了-C9H16及m/z435,但未出现m/z463及m/z 367,推测化合物5结构与化合物6、7相似,其具体结构有待用其他质谱及NMR手段进一步确认。
参考文献:
[1] 孟昭泉,宋大庆,苑修太.实用急性中毒急救[M].济南:山东科学技术出版社,2009:687.
[2] 龚千锋.中药炮制学[M].第3版.北京:中国中医药出版社,2012:354.
[3] 沈海葆,叶定江,蔡宝昌,等.藤黄不同炮制品小鼠半数致死量的测定和比较[J].江苏中医,1995,16(12):41-42.
[4] 窦 娟,文红梅,郁红礼,等.藤黄炮制品对大鼠肠道组织病理学研究[J].中国实验方剂学杂志,2013,19(5):279-282.
[5] 叶定江,吴 皓,胡 永,等.藤黄及其炮制品中藤黄酸的含量比较[J].中国中药杂志,1995,20(10):601.
[6] 郭 戎,叶定江,俞 琏,等.炮制对藤黄中藤黄酸含量的影响[J].中成药,1994,16(6):23-24.
[7] 刘幸平,郭 戎,叶定江,等.炮制对藤黄中新藤黄酸含量的影响[J].中成药,1996,18(3):17-18.
[8] 王爱芳,华卫国,吴隘敏.藤黄炮制工艺的初步研究[J].中成药,1988(9):20-21.
[9] 周 安,李庆林,彭代银,等.高效液相色谱-质谱联用法鉴定中药藤黄中桥环类化合物[J].药学学报,2008,43 (8):838-842.
[10] Zhou Y,Liu X,Yang J,et al.Analysis of caged xanthones from the resin of Garcinia hanburyi using ultra-performance liquid chromatography/electrospray ionization quadrupole time-offlight tandem mass spectrometry[J].Anal Chim Acta,2008,629(1-2):104-118.
[11] Yang J,Ding L,Hu L L,etal.Rapid characterization of caged xanthones in the resin of Garcinia hanburyi usingmultiplemass spectrometric scanning modes:The importance of biosynthetic knowledge based prediction[J].J pharm Biomed Anal,2012,60:71-79.
[12] 孔令东,叶定江,王苏玲,等.藤黄炮制品急性毒性及抗炎作用的研究[J].中国中药杂志,1996,21(4):214-216.
[13] 张慧芳.浅谈不同炮制方法对藤黄的影响[J].云南中医中药杂志,2008,29(10):73-74.
Variations of chem ical constituents in Garcinia hanburyi before and after processing by UPLC-ESI-MS/MS
PAN Ling-yun1,2, XU Min1, WANG Yi1, XIU Yan-feng1*
(1.College of pharmacy,Shanghai University of Traditional Chinese Medicine,Shanghai201203,China;2.ExPeriment Center for Science and Technology,Shanghai University of Traditional Chinese Medicine,Shanghai201203,China)
ABSTRACT:AIM To establish an ultra performance liquid chromatography-electrospray ionization-tandem mass spectrometry(UPLC-ESI-MS/MS)method for studying the variations of chemical constituents in Garcinia hanburyi before and after being processed with high pressure,tofu,water and lotus leaf.METHODS The analysis was performed on an Acquity UPLC BEH C8column(2.1 mm×100 mm,1.7 μm),mobile phase was acetonitrile -0.1%formic acid solution with gradient elution,column temperaturewasmaintained at35℃,and flow ratewas 0.3 mL/min.Principal component analysis(PCA)and partial least squared discriminant analysis(PLS-DA)were adopted to analyze the differences in chemical constituents before and after processing.RESULTS Before and after processing,the kinds of chemical constituents in Garcinia hanburyi did not show obvious change.After being heated formore than two hours and being processed with tofu or lotus leaf,the contents of thirteen constituentswere decreased,especially for gambogenin.There were some differences among different processing methods,and the contribution valueswere in sequence of gambogenin >morellic acid >isomorellic acid >R-isogambogic acid >R-30-hydroxygambogic acid >compound 5(unknown)>isogambogenic acid >S-30-hydroxygambogic acid >isogambogenin >S-isogambogic acid >R-gambogic acid >gambogenic acid >S-gambogic acid.CONCLUSION Different processingmethods and heating time have effects on chemical constituents in Garcinia hanburyi,and the decrease of their contentsmay be one of the reasons for toxicity attenuation after processing.
*通信作者:修彦凤(1974—),女,副教授,从事中药炮制及制剂研究。E-mail:xiuyf@hotmail.com
作者简介:潘凌云(1989—),男,硕士生,从事中药炮制及制剂研究。Tel:(021)51322393,E-mail:kelley007@163.com
基金项目:上海市自然基金项目(13ZR1442000);上海市教委预算内课题资助项目(2014YSN20)
收稿日期:2015-10-04
doi:10.3969/j.issn.1001-1528.2016.05.028
中图分类号:R284.1
文献标志码:A
文章编号:1001-1528(2016)05-1098-06
