PVN微量注射Phoenixin对大鼠摄食及胃功能的影响
2020-04-29李文师
李 明 于 琪 李文师
1青岛大学基础医学院 山东青岛 266021 2沂南县人民医院检验科 山东临沂 276300 3临沂市人民医院核医学科 山东临沂 276000 4黔东南民族职业技术学院 贵州凯里 556000
0 引言
PNX 是2013年在下丘脑发现的参与生殖调控的内分泌肽[1]。在中枢PNX 神经元主要分布于下丘脑(如外侧区LHA,腹内侧核VMH,弓状核ARC,室旁核PVN 等)、杏仁核、丘脑未定带(ZI)、孤束核(NTS)等[2]。但PNX 神经元可发出纤维广泛投射至整个大脑(包括下丘脑诸核团、腹侧背盖区VTA、杏仁核等等),PNX 受体(Gpr 173)分布也与PNX 纤维投射部位基本一致[3]。近年研究发现,PNX 还参与摄食[4]、情绪[5]、学习记忆[6]等生理活动调控。
下丘脑位于大脑腹侧,丘脑的下方,是间脑的组成部分,虽然体积较小,但却是大脑皮层下调节内脏活动的高级中枢,包括多个神经核团,并接收来自多部位的神经传入信息,被认为神经系统和内分泌系统的调控中心。下丘脑可调节内脏活动与其他生理活动,不仅可通过神经和血管途径调节机体的激素水平,还可整体性的对自主神经系统如内分泌、水盐平衡、摄食、生物节律等重要的生理功能进行调控[28]。其中,PVN 是下丘脑重要的核团之一,可整合外周信号和神经通路的传入信息,对摄食及胃酸分泌胃运动等胃功能进行调控,并调节能量平衡。先前研究表明,侧脑室注射PNX,可显著促进大鼠摄食[4],但PVN 内PNX 阳性神经元信号如何对大鼠摄食及能量代谢过程进行调控还鲜有报道。
本研究拟观察PVN 注射PNX 对大鼠摄食、胃运动、胃酸分泌及胃排空的影响及潜在机制,目的是补充和完善PNX 对能量平衡调控理论,为临床治疗能量代谢相关疾病提供新的研究思路。
1 材料与方法
1.1 实验动物
8 周龄雄性Sprague Dawley(SD)大鼠,体质量在220-250 g,购于青岛市药物检验所,饲养于室温(25±1℃)、12 h:12 h 昼夜循环光照,自由饮水进食。实验开始前,大鼠禁食但不禁水24 h。所有动物遵循《青岛大学实验动物保护和和使用管理方法》。所有实验都按照青岛实验动物中心标准。
1.2 实验方法
1.2.1 PVN 核团置管
大鼠经腹腔注射10%水合氯醛(0.3ml/100g)麻醉,俯卧位固定于脑立体定位仪,头部备皮后沿正中做一切口,双氧水腐蚀皮下组织,充分暴露颅骨。以前囟为原点,参照Paxinos 大鼠脑图谱[42],在颅骨表面定位PVN(前囟后:1.7-1.9mm,旁开:0.2-0.4mm,深:7.9-8.1mm),并以牙科钻钻透颅骨,以眼科剪剪去硬脑膜及蛛网膜,暴露脑实质,将不锈钢套管(24 gauge,直径1.5mm)由液压推进泵缓慢推入LHA,并以502 胶及牙托粉固定,以长25mm,直径1.35mm 针灸针为套管内芯,防止堵塞。埋管结束后缝合大鼠头皮,术后连续3 天腹腔注射8 万单位青霉素预防感染,一周后进行后续实验。
为了检测核团或侧脑室定位是否准确,实验结束后经套管向大鼠PVN 内缓慢注射滂胺天蓝溶液,随后麻醉大鼠,经心脏灌注固定,断头取脑,制作50 μm 冠状冰冻切片,显微镜下观察药物注射的位置是否准确,位置不准确者弃去不用。
1.2.2 PVN 微量注射PNX 对大鼠摄食的影响
将PVN 核团置管大鼠随机分为4 组(n=7)。①NS组:PVN 微量注射0.5 μl NS;②PNX 组:PVN 微量注射0.5 μl 2 nmol PNX;③BMS193885 组,PVN 微量注射0.5 μl 5.0 nmol NPY 受 体1(NPY1R) 拮 抗 剂BMS193885;④PNX+BMS193885 组:PVN 微量注射0.5 μl 2 nmol PNX+5.0 nmol BMS193885。按照分组注射药物后,将大鼠单独放置在已知食物重量的测量笼中,立即给予大鼠定量普通食物、高脂食物或高糖食物,连续监测2 小时摄食量。摄食量=已知食物量—(剩余食物量+溢出残渣量)。
1.2.3 PVN 微量注射PNX 对大鼠胃运动的影响
大鼠腹腔注射10%水合氯醛(0.3 mL/100 g)麻醉,仰卧位固定,腹部备皮,于剑突下行一长约1cm 的正中切口,充分暴露胃部。自胃幽门部向上0.3cm 处,沿胃窦环形肌方向将应力传感器缝贴于胃窦的浆膜外层,应力传感器的导线由大鼠背部皮下绕至后颈部,通过后颈部皮肤切口穿出体外固定,并在体表留置2-3cm 导线以便与记录仪相连。逐层缝合腹壁肌肉、皮下组织以及皮肤。术后连续3 天腹腔注射8万单位青霉素预防感染,待大鼠恢复正常饮食并且无应激反应后进行后续实验。
将PVN 核团置管大鼠随机分为4 组(n=7)。①NS组:PVN 微量注射0.5 μl NS;②PNX 组:PVN 微量注射0.5 μl 2 nmol PNX;③BMS193885 组,PVN 微量注射0.5 μl 5.0 nmol NPY 受 体1(NPY1R) 拮 抗 剂BMS193885;④PNX+BMS193885 组:PVN 微量注射0.5 μl 2 nmol PNX+5.0 nmol BMS193885。核团注射PNX 等药物,观察在体胃运动变化。以胃运动指数(MI)对大鼠胃运动进行量化,MI(%)=(给药后曲线下面积)/(给药前曲线下面积)×100%。
1.2.4 PVN 微量注射PNX 对大鼠胃排空的影响
将PVN 核团置管大鼠随机分为4 组(n=7)。①NS组:PVN 微量注射0.5 μl NS;②PNX 组:PVN 微量注射0.5 μl 2 nmol PNX;③BMS193885 组,PVN 微量注射0.5 μl 5.0 nmol NPY 受 体1(NPY1R) 拮 抗 剂BMS193885;④PNX+BMS193885 组:PVN 微量注射0.5 μl 2 nmol PNX+5.0 nmol BMS193885。大鼠禁食18 h 后按照分组经PVN 置管给药,给药后大鼠经口灌胃1.5 mL 酚红,20 min 后大鼠经颈椎脱臼法处死,迅速剖开大鼠腹壁,结扎胃幽门及贲门,将胃完整取出。生理盐水冲洗胃体外部,剪开胃壁将胃及胃内容物置于100 mL NaOH(0.1 N)中,搅拌混匀后室温静置1 h,取5 mL 上清液加入0.5 mL 20%三氯乙酸,混匀后3000 g 离心20 min,取1 mL 上清液加入4 mL NaOH(0.5 N)混匀,倒入比色皿。采用分光光度计测量在560 nm 处的吸光值。标准品处理同上,仅不含胃及胃内容物。
胃排空率(%)=(1-样本A560/标准品A560)x 100%
1.2.5 PVN 微量注射PNX 对大鼠胃酸分泌的影响
空腹大鼠麻醉后仰卧位固定,上腹部备皮,剑突下沿腹正中线向下剪开,钝性分离肌层,再沿腹白线切开腹壁,长约1 厘米。充分暴露胃底,在胃食管交界处结扎食管(避免伤及迷走神经干)。然后在胃幽门与十二指肠交界处做一切口,将双腔导管从切口处插入胃内,固定导管同时结扎幽门。检查导管灌流的生理盐水流出顺畅后缝合腹部切口处肌肉、皮肤。每15 分钟用5ml 生理盐水灌流收集胃酸一次,共三次,分别测量体积和pH 值,取其平均值作为正常基础胃酸分泌量。按照分组经PVN 置管给予大鼠注射药物,药物刺激后共观察120分钟,每15 分钟用5ml 生理盐水灌流收集胃酸一次。将胃灌流液装入滴定管中,在自动滴定仪上用10 mmol/L的NaOH滴定,直至上清液先呈黄色再转为红色2 秒内不消失为终点,记录消耗的10 mmol/L 的NaOH 量,计算不同时间段胃酸分泌量,酸排出量以μEq/h 表示。
1.3 统计学分析
应用SPSS 18.0 和PPMS 1.5 软件分析数据,所有数据均以(±s D)表示,两组间采用t 检验或Mann-Whitney U 检验,两组以上实验数据采用Kruskal-Wallis 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 PVN 微量注射PNX 对大鼠摄食的影响
与NS 组相比,PVN 微量注射PNX 可显著促进大鼠摄食(P<0.05);与PNX 组相比,PNX+BMS193885 组大鼠摄食量显著下降(P<0.05);但与NS 组相比,PVN 微量注射BMS193885对大鼠摄食无显著影响(P>0.05)。

表1:PVN 微量注射PNX 对大鼠摄食的影响
2.2 PVN 微量注射PNX 对大鼠胃运动的影响
与NS 组相比,PVN 微量注射PNX 可显著促进大鼠MI%(P<0.05);与PNX 组相比,PNX+BMS193885 组大鼠MI%显著下降(P<0.05);但与NS 组相比,PVN 微量注射BMS193885对大鼠MI%无显著影响(P>0.05)。
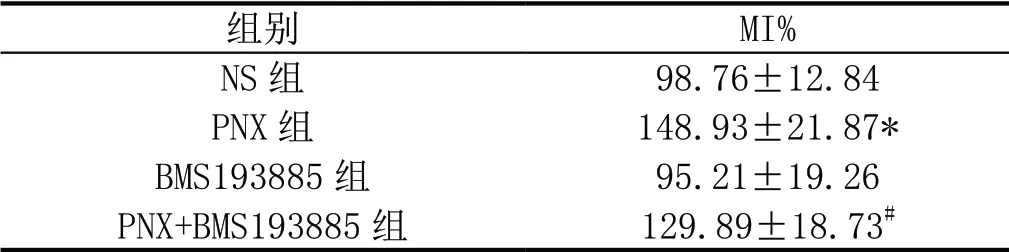
表2:PVN 微量注射PNX 对大鼠胃运动的影响(MI%)
2.3 PVN 微量注射PNX 对大鼠胃排空的影响
与NS 组相比,PVN 微量注射PNX 可显著促进大鼠胃排空(P<0.05);与PNX 组相比,PNX+BMS193885 组大鼠胃排空显著下降(P<0.05);但与NS 组相比,PVN 微量注射BMS193885对大鼠胃排空无显著影响(P>0.05)。

表3:PVN 微量注射PNX 对大鼠胃排空的影响(%)
2.4 PVN 微量注射PNX 对大鼠胃液及胃酸分泌的影响
PNX 注射NS 或BMS193885 大鼠基础胃酸分泌量无显著变化(P>0.05)。与NS 组相比,PVN 注射PNX 可诱导大鼠胃酸分泌(5.17±0.84 μEq/15min vs 9.81±1.26 μEq/15min,P<0.05);与PNX 组相比,PVN 微量注射PNX+BMS193885 混合液,PNX 对大鼠胃酸分泌的促进作用被部分抑制(7.49±0.63 μEq/15min vs 9.81±1.26 μEq/15min,P<0.05)。
3 讨论
本研究通过PVN 微量注射PNX,观察PNX 对大鼠摄食、胃运动、胃排空及胃酸分泌的影响,结果发现,大鼠PVN 微量注射PNX 可显著促进大鼠摄食、胃运动、胃排空及胃酸分泌,且NPY1R 信号通路参与PNX 对大鼠摄食、胃运动、胃排空及胃酸分泌的调控。
PNX 最初发现于下丘脑,参与调控生殖,而近年研究发现,PNX 还参与摄食[4]、情绪[5]、学习记忆[6]等生理活动调控。侧脑室注射PNX,可显著促进大鼠摄食[4]。但目前尚未有研究探究PNX 对摄食调控的机制,为了进一步确定PNX 促食效应的关键脑区,研究中向PVN 微量注射PNX,观察PNX 对摄食的调控,结果发现PVN 微量注射PNX 可显著促进大鼠摄食、胃运动、胃排空及胃酸分泌。
神经肽Y(neuropeptide Y,NPY)含36 个氨基酸,属胰多肽家族[7]。NPY 在调控摄食、体重等方面发挥着重要作用,是一种内源性促摄食因子[8]。NPY 受体有6 种亚型,中枢注射NPY 可显著促进大鼠摄食,主要通过NPY1R 和NPY5R。Icv 注射NPY1R 拮抗剂BMS193885 可减少大鼠摄食量。PVN 是参与摄食整合的重要脑区。促食欲肽能系统和厌食系统的信息可在PVN 中汇聚、整合。但PNX 对大鼠PVN 参与胃传入信息和摄食调控及机制仍不清楚。本研究发现,BMS193885 可部分阻断PXN 在PVN 对大鼠摄食、胃运动、胃排空及胃酸分泌的促进作用。提示NPY1R 信号通路参与PNX 对大鼠摄食、胃运动、胃排空及胃酸分泌的调控。
综上所述,大鼠PVN PNX 可促进大鼠摄食、胃运动、胃排空及胃酸分泌,其机制可能与NPY1R 信号通路相关。