氯沙坦通过HMGB1抑制热打击大鼠肝细胞炎症反应的作用观察
2020-04-28张明杨经文陈怀生李悦施学智梁泳欣童华生
张明,杨经文,陈怀生,李悦,施学智,梁泳欣,童华生*
1广州医科大学附属第六医院/广东省清远市人民医院重症医学科一区,广东清远 511500;2深圳市人民医院重症医学科,广东深圳 518020;3解放军南部战区总医院重症医学科/解放军热区损伤与组织修复重点实验室,广州 510010
中暑是一种可伴随多脏器损伤的致死性疾病,有研究显示其28 d和2年病死率可高达58%和71%[1]。肝损伤可继发于重症中暑,除替代及移植以外的治疗手段十分有限,常导致患者病情恶化甚至死亡[2]。迄今为止,热打击诱导肝损伤的致病机制仍不完全明确,除了热的直接作用外,炎症损伤可能是病情进展的主要原因[3]。进一步探索热打击诱导肝细胞炎症损伤的致病机制及干预手段是改善中暑患者预后的重要手段。本课题组前期研究发现,高迁移率族蛋白B1(high-mobility group protein B1,HMGB1)水平与中暑患者脏器损伤和死亡相关[4]。另外,HMGB1可通过激活炎症小体依赖的信号通路,上调热打击后肝细胞内白细胞介素(interleukin,IL)的表达,扩大炎症反应并造成肝损伤[5]。据此推断,HMGB1可能是控制该致病过程的潜在靶点。
氯沙坦是一种功能强大的血管紧张素受体拮抗剂,越来越多的证据显示,除了控制血压的作用外,氯沙坦还具有抑制炎症损伤的效用[6]。中暑大鼠的体内实验发现,血管紧张素系统紊乱可以促进炎症损伤[7]。还有研究证实,氯沙坦可以在炎症损伤的靶器官内下调HMGB1表达,改善预后[8]。然而,氯沙坦是否能通过HMGB1对热打击诱导的肝细胞炎症损伤起作用尚未见报道。本研究通过构建中暑大鼠肝损伤和热打击肝细胞系损伤两种模型,观察评估氯沙坦通过HMGB1对肝细胞炎症损伤的作用。
1 材料与方法
1.1 主要试剂 氯沙坦(losartan,LOS)购自美国Selleck公司,丙酮酸乙酯(ethyl pyruvate,EP)购自美国Sigma-Aldrich公司,重组HMGB1蛋白购自美国R&D Systems公司。谷丙转氨酶(alanine aminotransferase,ALT)、髓过氧化物酶(myeloperoxidase,MPO)检测试剂盒购自南京建成生物工程研究所。IL-1β、IL-18、HMGB1检测试剂盒购自武汉云克隆科技股份有限公司。活性氧簇(reactive oxidatespecies,ROS)、乳酸脱氢酶(lactate dehydrogenase,LDH)、CCK-8试剂盒、细胞核蛋白与细胞质蛋白抽提试剂盒购自碧云天生物技术公司。抗HMGB1、抗活化的半胱天冬酶-1(caspase-1)一抗购自英国Abcam公司。检测方法参照使用说明书严格执行。
1.2 中暑大鼠模型的构建 健康雄性SPF级SD大鼠,体重220~250 g,由南方医科大学动物实验中心提供(实验动物许可证编号:4400002100012396)。动物实验流程通过南部战区总医院实验动物伦理委员会审批(伦理审批编号:20170822001)。将大鼠随机分为对照组、中暑组、中暑氯沙坦组。对照组被置于未升温的人工气象舱中2 h,腹腔注射2 ml注射用水。中暑组和中暑氯沙坦组根据文献[5]提供的方案造模:将适应环境的大鼠置于(39.5±0.2) ℃温度及60%±5%湿度的人工气象舱中,允许大鼠自由活动,但不提供饮水和食物。当大鼠尾动脉血压上升至顶点并下降、核心体温超过42 ℃时,认定为造模成功。中暑组和中暑氯沙坦组大鼠分别在造模后接受复温、饲水,腹腔注射2 ml注射用水或50 mg/kg氯沙坦[8]。几乎全部中暑大鼠均能存活至热打击结束,但只有40%大鼠存活至造模后9 h。故在造模阶段两个中暑组大鼠各造模25只,留取存活超过9 h的大鼠血液和肝组织样本,随机抽取存活大鼠实验编号并接纳其样本入组,最终保证样本量每组9只。
1.3 热打击肝细胞模型构建 大鼠肝细胞系HBL3A购自中国科学院典型培养物保藏委员会细胞库。将培养传代后的细胞系随机分为对照组、热打击组和热打击氯沙坦组。对照组在正常环境下培养,不接受热打击。热打击组和热打击氯沙坦组按文献[5]提供的方案造模:将正常培养的HBL3A细胞系置于43 ℃、含5%二氧化碳的细胞培养箱中接受打击1 h后,在上清中分别加入空白培养基或氯沙坦(浓度至10 μmol/L)[8],并重新置入37 ℃、含5%二氧化碳培养箱静置9 h。每组细胞中取9个培养皿,收集上清及细胞。采用ELISA法测定细胞上清IL-1β、IL-18及HMGB1水平;热打击结束1 h后,分别添加梯度浓度的重组HMGB1(0.5、1.0、1.5 μg/ml)和H2O2(0.2 mmol/L)至氯沙坦干预的肝细胞上清中,并测定上清IL-1β、IL-18及HMGB1水平。
1.4 病理形态学观察 肝组织经甲醛固定、HE染色,病理科医师在不了解分组的情况下在光镜下观察肝组织切片并评分。评分方法按文献[5]提出的标准,根据肝组织各个视野中的红细胞滞留、胞质褪色、空泡化、核浓缩、核碎裂及核衰落等6个指标判定,取平均值后计算总和。
1.5 Western blotting检测HMGB1及caspase-1 p10表达水平 将每皿HBL3A细胞刮离皿壁,混匀后分装出完全等量的2份样本。其中一份在低温条件下按照碧云天公司出品的细胞核蛋白与细胞质蛋白抽提试剂盒的操作流程,提取胞质蛋白;另一份采用裂解液提取总蛋白。采用常规方法行总蛋白浓度测定和Western blotting检测,根据总蛋白β-actin表达量校正蛋白浓度,并最终测定细胞质HMGB1,caspase-1 p10及总HMGB1表达水平。采用ImageJ软件检测条带光密度(OD)值,计算各目的蛋白与内参β-actin的比值。
1.6 流式细胞仪测定细胞内ROS水平 按ROS检测试剂盒说明书装载荧光探针至肝细胞内,悬浮细胞并收集培养基,调配至相近的细胞密度并设定流式细胞仪荧光参数为488 nm激发波长、525 nm发射波长,分别测定阳性信号。
1.7 统计学处理 采用SPSS 18.0软件进行统计分析。计量资料先通过Kolmogorov-Smirnov检测正态性,符合正态分布的采用表示。多组数据间的比较采用单因素方差分析,两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 氯沙坦缓解热打击诱导的肝细胞损伤 体内实验中,大鼠血清ALT、肝组织MPO、肝脏病理形态分析显示:与对照组比较,中暑组和中暑氯沙坦组的ALT、MPO和病理组织学评分明显增高(P<0.05)。与中暑组相比较,中暑氯沙坦组上述指标明显下降,差异有统计学意义(P<0.05,图1)。体外实验中,与对照组比较,热打击组和热打击氯沙坦组上清LDH水平增高,细胞存活率显著下降(P<0.05)。同样,与热打击组比较,热打击氯沙坦组上清LDH水平下降,细胞存活率升高,差异均有统计学意义(P<0.05,图2)。
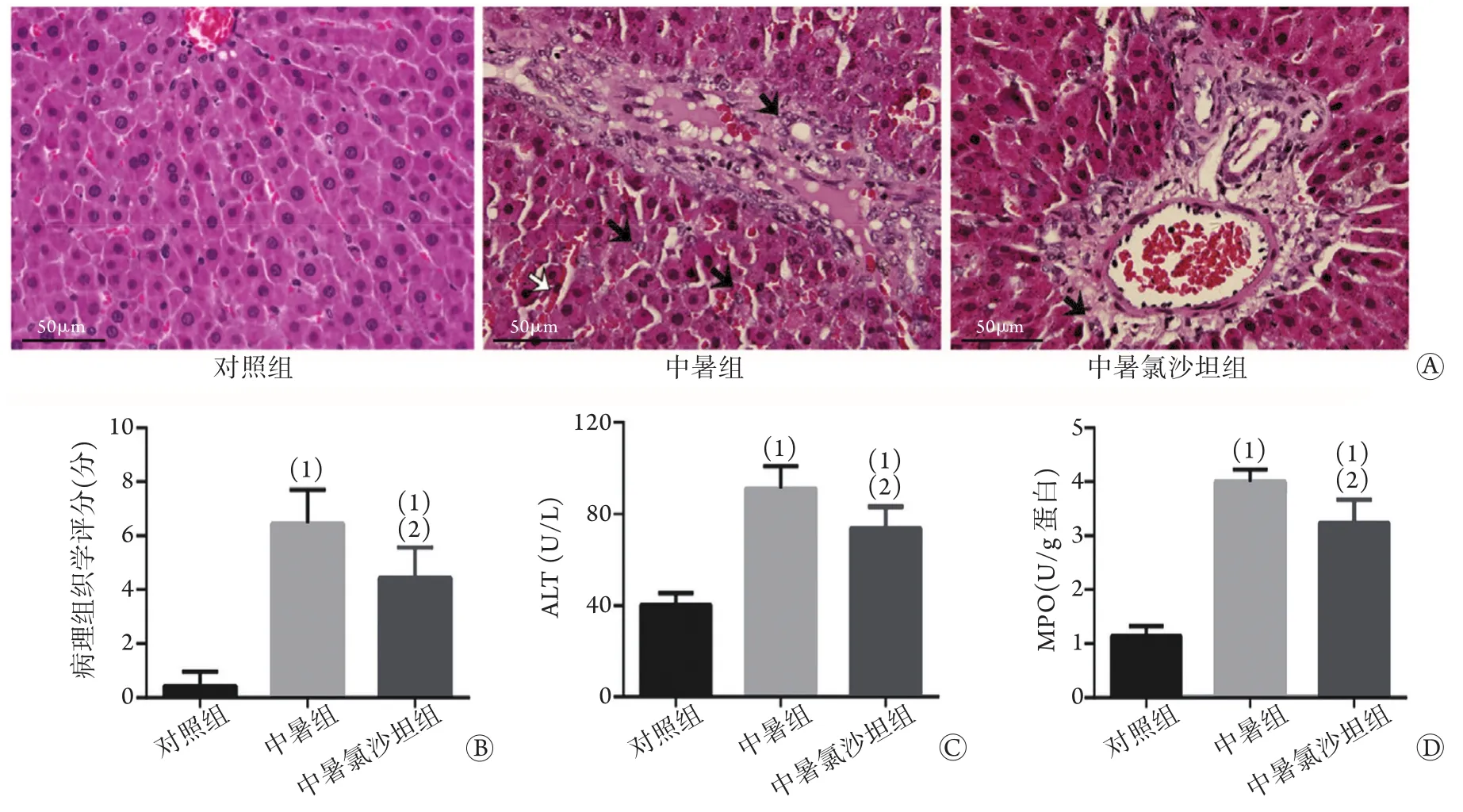
图1 氯沙坦对中暑大鼠肝脏损伤的缓解作用Fig.1 The protective effect of losartan on the damaged liver tissue of heatstroke rats
2.2 氯沙坦抑制热打击肝细胞HMGB1的转移和释放 在体内实验中,ELISA结果证实:与对照组比较,中暑大鼠血清HMGB1水平明显增高,而氯沙坦对其有抑制作用(P<0.05,图3A)。体外实验中,与对照组比较,热打击组肝细胞上清HMGB1水平明显增高,氯沙坦干预后,上清HMGB1水平与热打击组比较明显下降(P<0.05,图3B);同时,Western blotting检测结果显示,肝细胞质HMGB1占总HMGB1的比例在热打击后明显增加,而氯沙坦可以抑制该比例的增加,差异有统计学意义(P<0.05,图3D)。

图2 氯沙坦对热打击HBL3A细胞损伤的缓解作用Fig.2 Theprotective effect of losartan on the damaged HBL3A cell line exposed to heat stress
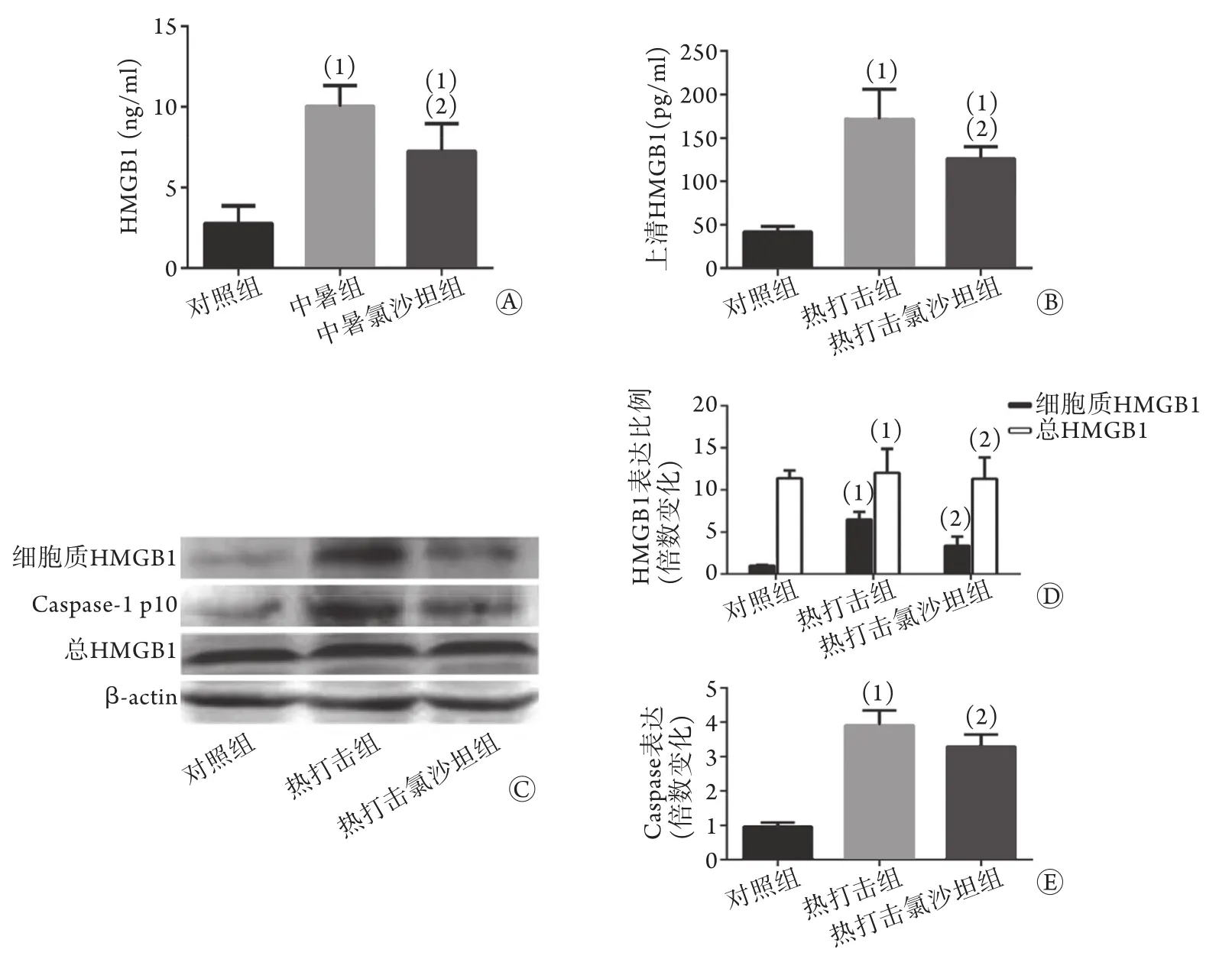
图3 氯沙坦抑制热打击肝细胞中HMGB1的转移和释放Fig.3 The inhibitory effect of losartan on the transfer and secretion of HMGB1 in rat's hepatocytes after heat stress
2.3 氯沙坦通过HMGB1抑制caspase-1、IL-1β、IL-18水平 体内实验中,中暑组大鼠肝组织IL-1β、IL-18的表达水平明显上调,加入氯沙坦后,抑制了上述促炎因子的水平(图4A,P<0.05)。体外实验中,肝细胞在接受热打击后,caspase-1表达随HMGB1的上调而上调,同时上清IL-1β、IL-18的表达明显增加,而氯沙坦干预对caspase-1和促炎因子的表达具有抑制作用(P<0.05,图3E,图4B)。HMGB1药物抑制剂EP(5 mmol/L)明显降低了热打击肝细胞上清IL-1β、IL-18的水平,增高了肝细胞存活率(图4C、D),补充重组HMGB1则抵消了氯沙坦对IL-1β、IL-18的抑制作用(图4E,P<0.05)。

图4 热打击肝细胞中氯沙坦通过HMGB1抑制IL-1β、IL-18表达Fig.4 Losartan inhibit the expression of IL-1β and IL-18 through HMGB1 in rat's hepatocytes after heat stress
2.4 氯沙坦通过抑制热打击肝细胞ROS水平调控HMGB1释放 热打击使肝细胞内ROS水平增高,而氯沙坦能够抑制ROS的增加(图5A,P<0.05)。补充0.2 mmol/L过氧化氢(hydrogen peroxide,H2O2)能够显著增高氯沙坦干预的热打击肝细胞上清中HMGB1水平,差异有统计学意义(图5B,P<0.05)。
3 讨 论

图5 氯沙坦对热打击HBL3A细胞内活性氧簇水平的影响Fig.5 Effect of losartan on the reactive oxygen species (ROS)in HBL3A cells stimulated by heat stress
HMGB1是一种高度保守的核蛋白,主要存在于真核细胞核内并参与转录的调控等过程[9]。当细胞受到刺激或死亡时,HMGB1能主动或被动地由细胞核内易位到胞质或释放到细胞外行使“促炎”功能[10-11],充当“损伤相关分子模式”诱导炎症对靶器官的损伤,该现象已经在很多感染或非感染疾病中被观察到[12-15]。还有研究证实,作为一种炎症损伤性疾病,中暑能诱导HMGB1向患者和动物血清中大量释放,并与患病个体预后相关[4,16]。并且,在原本即有大量HMGB1表达的肝脏中,热打击能够促进HMGB1的转移释放并成为肝细胞炎症损伤的重要介质[5]。本课题组的前期研究还发现HMGB1的特异性抗体能够缓解肝损伤,也从反面证明了HMGB1在热打击肝损伤炎症反应中的促炎作用[17]。和前人的研究相似,本研究也验证了原本主要存在于细胞核内的HMGB1,在热打击后转移释放到细胞质和细胞培养上清中,而且这种改变也伴随了周围细胞的炎症损伤。
研究发现,热打击后被大量释放的HMGB1会被晚期糖基化终产物受体和Toll样受体识别,通过NLRP3炎症小体依赖的炎症通路活化caspase-1,后者剪切活化IL-1β和IL-18引起扩散的炎症反应,成为热打击诱导肝脏损伤的重要机制[5,14]。相似结果也在其他以肝细胞构建的模型中出现[18]。本研究没有重复验证HMGB1被模式受体识别及诱导NLRP3炎症小体聚集的过程,但同样观察到热打击诱导释放的HMGB1及外源添加的HMGB1都能增加下游效应因子IL-1β和IL-18的水平,并引起炎症损伤;相反的,HMGB1抑制剂有利于控制IL-1β和IL-18水平。这意味着HMGB1在热打击肝细胞的炎症反应中起到促炎作用。当然,本研究亦不能排除HMGB1通过其他通路及效应因子共同诱导热打击肝细胞炎症损伤的可能性。
为了抑制HMGB1而减轻炎症损伤,除上述的HMGB1抗体外,Hagiwara等[16]也尝试采用非特异性的重组血栓调节蛋白下调HMGB1并发挥保护性作用。可遗憾的是,无论是HMGB1抗体还是血栓调节蛋白,都不是临床上容易获得的药物。为了寻找潜在有效的药物来治疗中暑肝损伤这种致命性疾病,本研究进行了进一步的干预实验。
氯沙坦是一种血管紧张素受体拮抗剂,是治疗高血压病的一线药物。越来越多的研究发现,氯沙坦及其同族药物还存在缓解炎症损伤的作用,能够抑制包括HMGB1在内的多种炎性因子的释放[19-20]。Hagiwara等[8]发现,氯沙坦能够抑制脓毒症HMGB1的上调,减轻靶器官损伤;Nair等[21]发现,氯沙坦能抑制肾小管上皮细胞中HMGB1的上调和炎症损伤;Kikuchi等[22]证实了该类药物在卒中疾病中抑制HMGB1的作用。另外,肝脏组织也存在血管紧张素受体,且能够由其引发炎症损伤,说明肝脏组织存在该类药物发挥抗炎作用的基础[23];同时,在热相关疾病中也存在着血管紧张素系统激活引起炎症损伤的证据[7,24]。但是,氯沙坦通过调控HMGB1干预热相关炎症损伤的假设未被实验评估过。本研究结果显示,氯沙坦对热打击肝细胞的保护作用伴随了HMGB1释放的抑制,补充HMGB1逆转了氯沙坦的保护作用,均提示氯沙坦在热打击肝损伤中通过抑制HMGB1发挥作用的可能性。
氯沙坦抑制HMGB1的分子通路仍不明确。Hagiwara等[8]认为,氯沙坦抑制了HMGB1上游的IκB磷酸化;而Nair等[21]则认为与NF-κB的激活受抑制有关。血管紧张素受体均是与异三聚体G蛋白相联系继而激活以ROS为主的第二信使,从而发挥效能,故血管紧张素受体拮抗剂的抗炎作用很可能与其对ROS的抑制有关[25]。有研究证实,血管紧张素系统在肝脏中发挥促炎作用也是以ROS作为媒介信使的[23]。同时,无论受到何种机制的调控,ROS都是调节HMGB1易位、释放和活化的共同机制[26]。本研究发现,氯沙坦可抑制热打击肝细胞内ROS水平并抑制HMGB1释放,而补充过氧化氢能够逆转氯沙坦对HMGB1释放的抑制作用,由此足以推测ROS是氯沙坦调控HMGB1机制中的关键点。
综上所述,作为临床上易获得的药物,氯沙坦能通过调控热打击肝细胞中HMGB1的释放抑制炎症反应,发挥保护作用,提示了其具有作为治疗中暑肝损伤潜在药物而被进一步研究开发的价值。
