肿瘤坏死因子-α和β1,4-半乳糖基转移酶-Ⅰ在膝关节滑膜炎中的表达及临床意义
2020-04-28郑舒凌张建华邹龙飞
郑舒凌,王 治,张建华,邹龙飞,薛 浩
骨关节是指骨与骨间连接的组织,而膝关节骨性关节炎是发生于膝盖处骨关节间的炎性反应[1]。膝关节炎是一种以关节软骨面的退行性病变和继发性骨质增生为主要改变的慢性关节病[2]。该病的发生一般与患者年龄、体重指数、创伤以及遗传因素相关,患有该疾病的患者常会出现关节僵硬、肿胀、疼痛及活动受限等症状,对人们的日常生活造成了较大的影响[3]。临床常误诊为类风湿性关节炎,而有相关研究显示,类风湿性关节炎与膝关节骨性关节炎发生炎性反应的环境极为相似,且滑膜发生炎症引起的软骨退变与膝关节骨性关节炎的病变具有紧密联系[4]。肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)和β1,4-半乳糖基转移酶-Ⅰ(β1,4-Galactosyltransferase-Ⅰ, β1,4-GalT-Ⅰ)是人体内最常见的炎性因子。有大量文献报道,上述两种因子对关节病变的发生具有重要意义[5]。本研究通过回顾性分析本院确诊的109例膝关节滑膜炎患者滑膜组织成纤维样滑膜细胞中的TNF-α、β1,4-GalT-Ⅰ表达变化情况,旨在分析上述因子水平与膝关节滑膜炎的相关性以及TNF-α是否会诱导滑膜组织β1,4-GalT-Ⅰ的分泌及表达。现报告如下。
1 资料与方法
1.1一般资料 选择2016年11月—2019年11月于本院就诊的膝关节滑膜炎109例作为研究组。纳入标准:所有患者均经X线等检查符合膝关节滑膜炎诊断标准[6];均未合并其他内科疾病或感染性疾病患者;临床资料均完整。排除标准:诊断为继发性骨关节炎或类风湿性关节炎患者;临床资料不完整者。选取同期进行膝关节探查各项结果均正常者57例作为对照组。2组年龄、性别等一般资料比较差异无统计学意义(P>0.05),具有可比性。见表1。

表1 2组一般资料比较
注:研究组为膝关节滑膜炎患者,对照组为行膝关节探查各项结果正常者
1.2仪器与试剂 4%甲醛溶液、石蜡、Trazol溶液、PCR仪(美国ABI-7500 Real-Time PCR)、鼠源性TNF-α抗体(美国BD公司)、羊源性β1,4-GalT-Ⅰ抗体(美国BD公司)、经FITC标记的驴抗鼠抗体(美国BD公司)、经TRITC标记的驴抗羊抗体(美国BD公司)、TNF-α检测试剂盒(武汉伊莱瑞特生物科技股份有限公司,货号:E-EL-H2104c)。
1.3检测方法
1.3.1PCR检测:经关节镜手术将膝关节滑膜组织取出,在5 min内将滑膜组织置于液氮中并放入-80℃的恒温箱中待检。于无菌环境下将滑膜组织进行剪碎和碾磨,由相关专业操作人员用Trazol溶液将滑膜组织样本和总RNA进行提取,并严格按照试剂盒说明合成cRNA。所需引物、探针及序列见表2。合成完毕后取2组cRNA 1.5 μl,将其作为模板,再分别加入至2.5 μl 10×buffer和1 μl dNTP中,并经过高温变性、循环,再进行PCR仪检测。

表2 PCR检测引物、探针及序列
1.3.2免疫荧光染色:抽取待检的滑膜组织标本,并置于4%甲醛溶液中固定浸泡24 h,予以石蜡包埋切片。在对其进行染色时,应加入鼠源性TNF-α抗体以及羊源性β1,4-GalT-Ⅰ抗体,再放置于4℃的恒温箱中进行孵育,时长约2 h,并应用磷酸盐缓冲液漂洗3次,每次10 min。待多余水分除去后,再加入经TRITC标记的驴抗羊抗体以及经FITC标记的驴抗鼠抗体,放置于4℃的恒温箱中孵育2 h,再用磷酸盐缓冲液漂洗3次,每次10 min。
1.3.3TNF-α水平检测:使用武汉伊莱瑞特生物科技股份有限公司生产的试剂盒并应用酶联免疫吸附双抗夹心法对TNF-α水平进行检测。
1.4观察指标 比较2组TNF-α及β1,4-GalT-Ⅰ表达情况,根据2组各指标表达情况,分析不同剂量、不同时长TNF-α对滑膜组织成纤维样滑膜细胞中的β1,4-GalT-Ⅰ表达的影响。不同剂量:在相同时长TNF-α的刺激下,分别予以2组成纤维样滑膜细胞0.1、1、3、5、7 ng/ml的TNF-α刺激,观察β1,4-GalT-Ⅰ表达的变化情况;不同时间:2组成纤维样滑膜细胞均予以5 ng/ml的TNF-α刺激,观察不同时间段β1,4-GalT-Ⅰ表达的变化情况。

2 结果
2.1TNF-α、β1,4-GalT-Ⅰ表达水平 研究组TNF-α、β1,4-GalT-Ⅰ相对表达水平高于对照组,差异有统计学意义(P<0.05)。见表3。

表3 2组TNF-α和β1,4-GalT-Ⅰ相对表达水平比较
注:研究组为膝关节滑膜炎患者,对照组为行膝关节探查各项结果正常者;TNF-α为肿瘤坏死因子-α,β1,4-GalT-Ⅰ为β1,4-半乳糖基转移酶-Ⅰ;与对照组比较,bP<0.01
2.2不同剂量、不同时长的TNF-α刺激对滑膜组织成纤维样滑膜细胞中的β1,4-GalT-Ⅰ表达的影响 不同剂量TNF-α刺激成纤维样滑膜细胞,随TNF-α剂量增加β1,4-GalT-Ⅰ表达水平不断升高,5 ng/ml时β1,4-GalT-Ⅰ达到高峰,与对照组比较差异有统计学意义(P<0.05),随后又下降。见图1。给予2组5 ng/ml TNF-α刺激,随刺激持续时间逐渐延长β1,4-GalT-Ⅰ的表达水平逐渐上升,直至4 h时达到高峰,与对照组比较差异有统计学意义(P<0.05),随后下降。见图2。
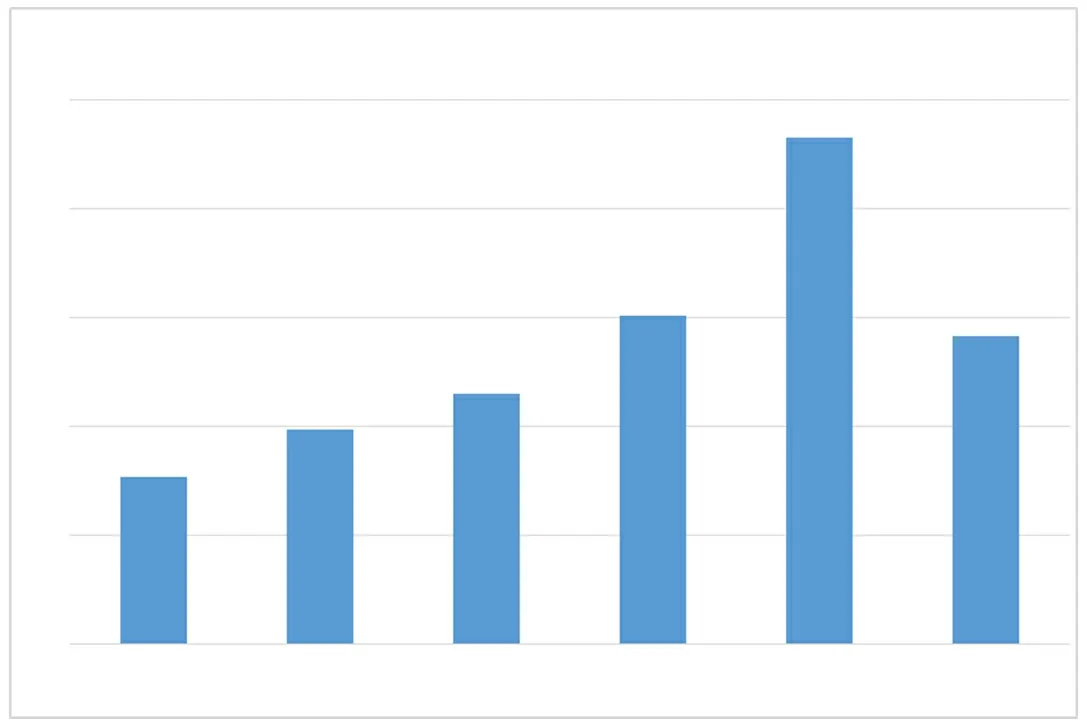
图1 不同剂量TNF-α刺激对滑膜组织成纤维样滑膜细胞中的β1,4-GalT-Ⅰ表达的影响
TNF-α为肿瘤坏死因子-α,β1,4-GalT-Ⅰ为β1,4-半乳糖基转移酶-Ⅰ,0.1、1、3、5、7 ng/ml为TNF-α剂量;与对照组比较,aP<0.05

图2 不同时长的TNF-α刺激对滑膜组织成纤维样滑膜细胞中的β1,4-GalT-Ⅰ表达的影响
TNF-α为肿瘤坏死因子-α,β1,4-GalT-Ⅰ为β1,4-半乳糖基转移酶-Ⅰ,0.5、2、3、4、5、6、8、12 h为TNF-α刺激时间;与对照组比较,aP<0.05
3 讨论
骨关节炎是一种以关节软骨的变性、破坏及骨质增生为特征的慢性进行性骨关节病,常见于老年群体[7]。有研究报道,目前我国的骨关节炎发生率随年龄增长呈上升趋势[8]。目前临床主要以缓解疼痛、延缓病情发展,保护关节功能为治疗目标[9]。
骨性关节炎病理特点主要表现为关节软骨的变性破坏、软骨下骨硬化、关节边缘骨质增生、滑膜增生等[10]。该病是由于各种炎性因子及炎性细胞作用于滑膜细胞组织,使其受刺激反应不断增殖,逐渐形成具有侵袭性的血管翳,血管翳与病变组织周围骨组织及软骨组织反应,导致关节结构发生破坏,关节功能丧失[11-12]。为减少骨关节结构、功能破坏对人体造成的不可逆损伤,引发骨性关节炎主要致炎相关细胞因子的研究一直是临床讨论的热点[13]。
有相关文献证明,滑膜细胞受炎症刺激分泌的炎性因子及细胞因子在骨关节炎发病及病情变化过程中具有促进作用,其中成纤维样滑膜细胞就是其中的一种[14]。该细胞表达水平直接影响机体内各生长因子、黏附分子、促炎因子及基质金属蛋白酶合成和表达[15]。β1,4-GalT-Ⅰ是由滑膜组织细胞分泌的炎性介质,其分泌位置不同发挥的生理学功能也不同[16]。有研究显示,β1,4-GalT-Ⅰ是目前研究发现的唯一一种位于高尔基体上既可与细胞膜反应产生黏附作用,又可参与糖链合成反应的细胞酶,并参与细胞运动和信号的识别过程[17]。人体内β1,4-GalT-Ⅰ具有介导糖基转移的作用,并参与机体的炎性应激和免疫调节过程[18]。
TNF-α是由单核细胞和巨噬细胞分泌的一种炎性反应介质[19]。有文献证实,TNF-α可诱导前列腺素E2胶原酶的分泌以及滑膜细胞的合成,促进炎性反应的发生[20]。本研究结果发现,膝关节滑膜炎患者滑膜组织内TNF-α、β1,4-GalT-Ⅰ表达水平增高,验证了上述研究结果,也在一定程度说明了TNF-α、β1,4-GalT-Ⅰ与膝关节滑膜炎发生有关。
在炎性反应中,TNF-α被证实可促进血管内皮细胞大量合成并分泌β1,4-GalT-Ⅰ,而是否具有诱导滑膜组织分泌β1,4-GalT-Ⅰ的作用仍需进一步探讨[21]。本研究对滑膜组织中纤维样滑膜细胞予以不同剂量及不同时长TNF-α刺激,研究发现,β1,4-GalT-Ⅰ表达水平随刺激时长和剂量增加不断上升,TNF-α刺激浓度达5 ng/ml时达到最高值,随后逐渐降低;TNF-α刺激时长达4 h时达到高峰期,随后也降低。与朱新辉等[22]研究结果一致。提示一定剂量和一定时长TNF-α刺激可诱导β1,4-GalT-Ⅰ分泌,并共同作用于滑膜组织,参与炎性反应。
综上所述,TNF-α与β1,4-GalT-Ⅰ在膝关节滑膜炎的病变过程中发挥着重要作用,临床可根据其表达情况进行有效地阻断,这为膝关节滑膜炎的治疗提供了可能性。
