两株小球藻培养基的优化及其产EPA性能的研究
2020-04-28叶青吴子健侯惠静赵培
叶青,吴子健,,侯惠静,赵培
(1.天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134;2.天津天狮学院食品工程学院,天津 301700)
二十碳五烯酸(eicosapentaenoic acid,EPA)属于ω-3 系列多不饱和脂肪酸,是人体必需脂肪酸之一。众多研究表明,EPA 对人体有着重要的调节功能,具有抑制血小板的凝集、降血脂及防动脉粥样硬化、抗肿瘤抑癌、抗炎症、抑制肥胖等作用[1-6]。目前EPA 主要来源于鱼油和海洋微藻[7],其中鱼油作为EPA 的传统来源存在诸多问题,如:鱼油的脂肪酸成分复杂,EPA 往往与其它的多不饱和脂肪酸(polyunsaturated fatty acids,PUFA)共存,难以分开,因此从鱼油中提取EPA的工艺复杂、成本高,且得率低,复杂的工艺也影响EPA 产品的稳定性[8-10]。而海洋微藻是多不饱和脂肪酸的初级生产者,通常产生EPA 的藻株细胞不产生二十二碳六烯酸(docosahexenoic acid,DHA)等多不饱和脂肪酸,EPA 含量也远高于鱼油,且产EPA 的海洋微藻的脂肪酸组成简单、产EPA 的得率高、纯化工艺也简单[11-13]。EPA 结构如图1所示。
图1 EPA 分子结构式Fig.1 Molecule structure of EPA
小球藻(Chlorella)为绿藻门、小球藻属的一类海洋微藻[14-15],其中小球藻C95 和小球藻C97 的EPA 含量很高,占总脂肪酸28%以上[16]。小球藻的生长不仅受温度、光照、pH 值等的影响,培养基中营养盐组成以及浓度对小球藻的生长具有显著影响[17-18]。而且众多研究发现[16,19],通常处于对数生长末期时小球藻的EPA 含量最高,可通过优化小球藻生长培养基培养加快藻种收获期的到来提高EPA 的产量。目前已有的普通基础培养基虽可适合大部分微藻的培养,但是难以准确应对不同小球藻株系间的生长繁殖差异性,因而需要对其进行优化。
本研究在f/2 培养基[15]的基础上,利用正交法优化适合于小球藻C95 和小球藻C97 生长繁殖的培养基,且进行了15 L 规模培养,测定了所收获的干藻粉的EPA 含量。
1 材料与方法
1.1 材料与试剂
小球藻C95 和C97 均来自中国海洋大学微藻种质库(Microalgae Culture Center,MACC)。
EPA 甲酯标准样品:Sigma 公司;其余试剂均为国产分析纯。
1.2 仪器与设备
CCA-1112A 旋转蒸发器:上海爱朗仪器有限公司;LRH-250-Ⅱ微电脑控制生化培养箱:广东省医疗器械厂;SPX-100B-D 型振荡培养箱:上海博迅实业有限公司医疗设备厂;JA4103A 电子天平:上海精天电子仪器有限公司;AIR TECH 型洁净工作台:苏净集团安泰公司;FDU-810 型EYELA 冷冻干燥机:日本东京理化公司;HVE-50 高压蒸汽灭菌锅:日本Hirayama 公司;YS100 尼康双目光学显微镜:日本Nikon 公司;AOC-20i 气相色谱仪:日本SHIMADZU 公司;DF-101S 集热式恒温加热磁力搅拌器:巩义市英峪高科仪器厂;SHZ-D(Ⅲ)循环水式真空泵:河南省予华仪器有限公司;UV5 紫外分光光度计:METTLER TOLEDO;A-vanti J-E 多用途高效离心机:美国Beckman 公司。
1.3 试验方法
1.3.1 f/2 培养基的配制
参照江怀真的方法[15]并做调整。人工海水(配置试剂及其浓度为:0.664 g/L KCl、0.003 g/L NaF、0.026 g/L H3BO3、3.917 g/L Na2SO4、1.102 g/L CaCl2、0.096 g/L KBr、0.024 g/L SrCl2·6H2O、4.981 g/L MgCl2·6H2O、0.192 g/L NaHCO3、23.476 g/L NaCl)中依次加入 6 种营养盐(营养盐浓度为:微量元素母液1 mL/L、维生素母液1 mL/L、NaH2PO4·2H2O 5.72 g/L、Na2SiO3·9H2O 11 g/L、NaNO374.8 g/L、FeC6H5O7·5H2O 3.9 g/L),1 L 海水中加每种营养盐母液1 mL,混匀备用。
1.3.2 藻种培养
藻种按照10%(体积分数)比例接种于f/2 培养基中,连续光照培养(22 ℃,光照强度 3 500 lx~4 500 lx),每天摇瓶3 次,每次摇动约100 下。
1.3.3 最佳培养基的确定
以6 种营养盐(微量元素母液、维生素母液、NaH2PO4·2H2O、Na2SiO3·9H2O、NaNO3、FeC6H5O7·5H2O)为考察因素,各取三水平,进行L18(37)正交试验设计,正交试验因素水平见表1。按照不同水平配置培养基,藻种按照10%(体积分数)比例接种于不同水平培养基中培养。按照方法1.3.2 进行藻种培养并定时测定OD 值,以对数末期的细胞密度(104个/mL)为考察指标,确定适合不同藻株的最佳培养基配方。
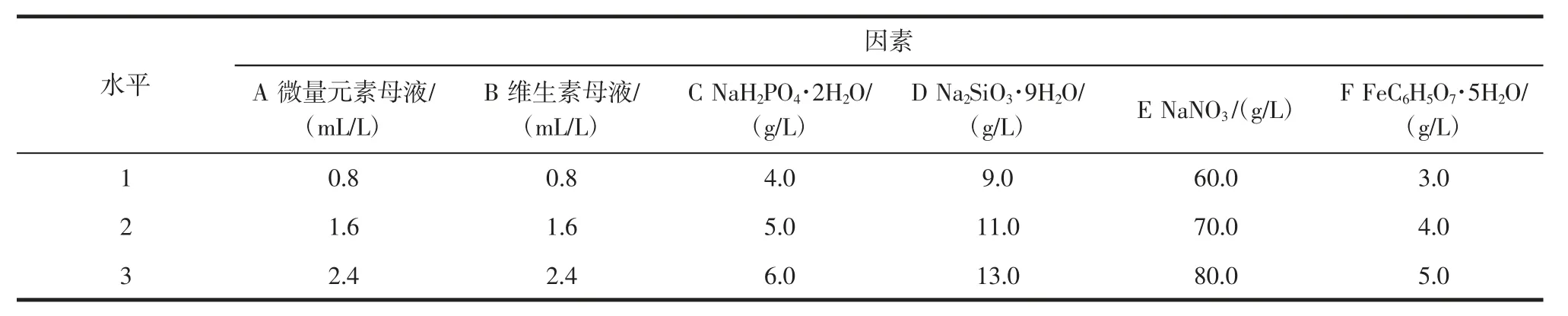
表1 L18(37)正交试验设计Table 1 L18(37)Orthogonal designation
1.3.4 15L 规模培养及藻的收获
将两株藻种按照10%(体积分数)比例分别接种于优化后的培养基中,于20 L 广口瓶中连续光照培养(22 ℃~25 ℃,光照强度 3 000 lx~4 000 lx,通气),定时取样,测定OD 值,换算成细胞密度。以时间(d)为横坐标,以细胞密度(104个/mL)为纵坐标,绘制两株小球藻的生长曲线。当生长曲线显示细胞密度趋于稳定时(已到达对数末期)停止培养,所得小球藻藻液再于4 ℃下离心(6 000 r/min)20 min,收获沉淀的藻泥进行冷冻干燥,最终得到干藻粉。
1.3.5 游离脂肪酸的提取
参考Molina 等[20]的方法提取小球藻干藻粉中的游离脂肪酸:取1.00 g 干藻粉用乙醇(96%)-KOH 溶液(乙醇76 mL,1.6 g KOH)进行处理,氮气保护下超声破碎20 min,然后60 ℃下皂化1 h,抽滤取滤液,滤饼再用20.0 mL 乙醇(96%)洗涤两次并抽滤,合并滤液;加20.0 mL 去离子水于滤液中,用正己烷(共200.0 mL)萃取 5 次去除不可皂化物质;用 HCl 溶液(HCl∶水=1∶1,体积比)调节下相pH 值至1.0,再用200.0 mL 正己烷分五次萃取得到游离脂肪酸,最后减压旋蒸除去正己烷。
1.3.6 脲素包埋法
参考吴明一等[21]的方法:将1.3.5 得到的游离脂肪混合物溶于脲素甲醇溶液(4.00 g 脲素,15 mL 甲醇),于65 ℃~70 ℃下搅拌溶解直至清澈,所得溶液于28 ℃下过夜结晶,过滤去除结晶,得到含有多不饱和脂肪酸的溶液。
1.3.7 脂肪酸甲酯化
参考Cao 等[22]方法并做调整:将试验1.3.6 制备得到的多不饱和脂肪酸溶液移至25 mL 具塞定糖管中,加入2 mL 硫酸甲醇溶液(4%,体积比),于75 ℃下甲酯化反应1 h。反应结束后分别加入2 mL 生理盐水和2 mL 正己烷,振荡,静置分层后取上层正己烷相,加入无水硫酸钠(预先105 ℃恒重),离心(6 000 r/min,10 min),并定容至10 mL,置于棕色瓶中-20 ℃下保存。
1.3.8 气相色谱测定EPA 含量
将1.3.7 得到的脂肪酸甲酯进行气相色谱分析测定EPA 含量。
参考Cao 等[22]方法并做调整:色谱柱:CBP20-25-50 毛细管柱(50 m×0.25 mm,0.25 μm);升温程序:初始温度为 180 ℃保持 1 min,6 ℃/min 升至 240 ℃,保持20 min;进样口温度:280 ℃,检测器温度:FID 280 ℃,检测器流速为1 mL/min,压强为173.4 kPa,毛细管柱流速1.00 mL/min,总流速14.0 mL/min;载气:高纯氮气,流速 30 mL/min,进样量为 1 μL;分流比为 5∶1。
1.4 数据分析
采用Excel 进行图的绘制,正交试验设计助手专业版v3.1 软件进行分析极差及方差分析。
2 结果与分析
2.1 正交试验设计优化培养基的结果
培养基的组成对海洋微藻的生长以及收获的生物量有着重要的影响,即培养基中营养盐的组成是微藻光合作用、合成有机物的物质基础,其适宜的浓度可以促进微藻的生长,比如:江怀真的研究[15]发现不同浓度的氮、磷元素对小球藻的生长速度和生物量影响是不同的;张丽君等[23]的研究发现镁离子浓度在1.0 g/L时最有利于小球藻的生长,所以生长培养基的适当优化有利于小球藻收获生物量的提高。
以藻密度为考察指标的正交试验结果见表2,两种小球藻的方差分析表见表3 和表4。
由表2 极差RC95值可知,各因素对小球藻C95 生长过程中藻密度的影响程度的大小顺序为C>B>A>D>F>E,即NaH2PO4·2H2O 对藻密度的影响最大,依次为维生素母液、微量元素母液、Na2SiO3·9H2O、FeC6H5O7·5H2O、NaNO3。通过表2、表3 分析可得出各因素理论上的最佳组合为A1B3C3D1E1F1,即微量元素母液0.8 mL/L,维生素母液 2.4 mL/L,NaH2PO4·2 H2O 6.0 g/L,Na2SiO3·9H2O9.0 g/L,NaNO360.0 g/L,FeC6H5O7·5H2O 3.0 g/L,其中微量元素母液、维生素母液、NaH2PO·42 H2O 的浓度对藻密度有显著影响。
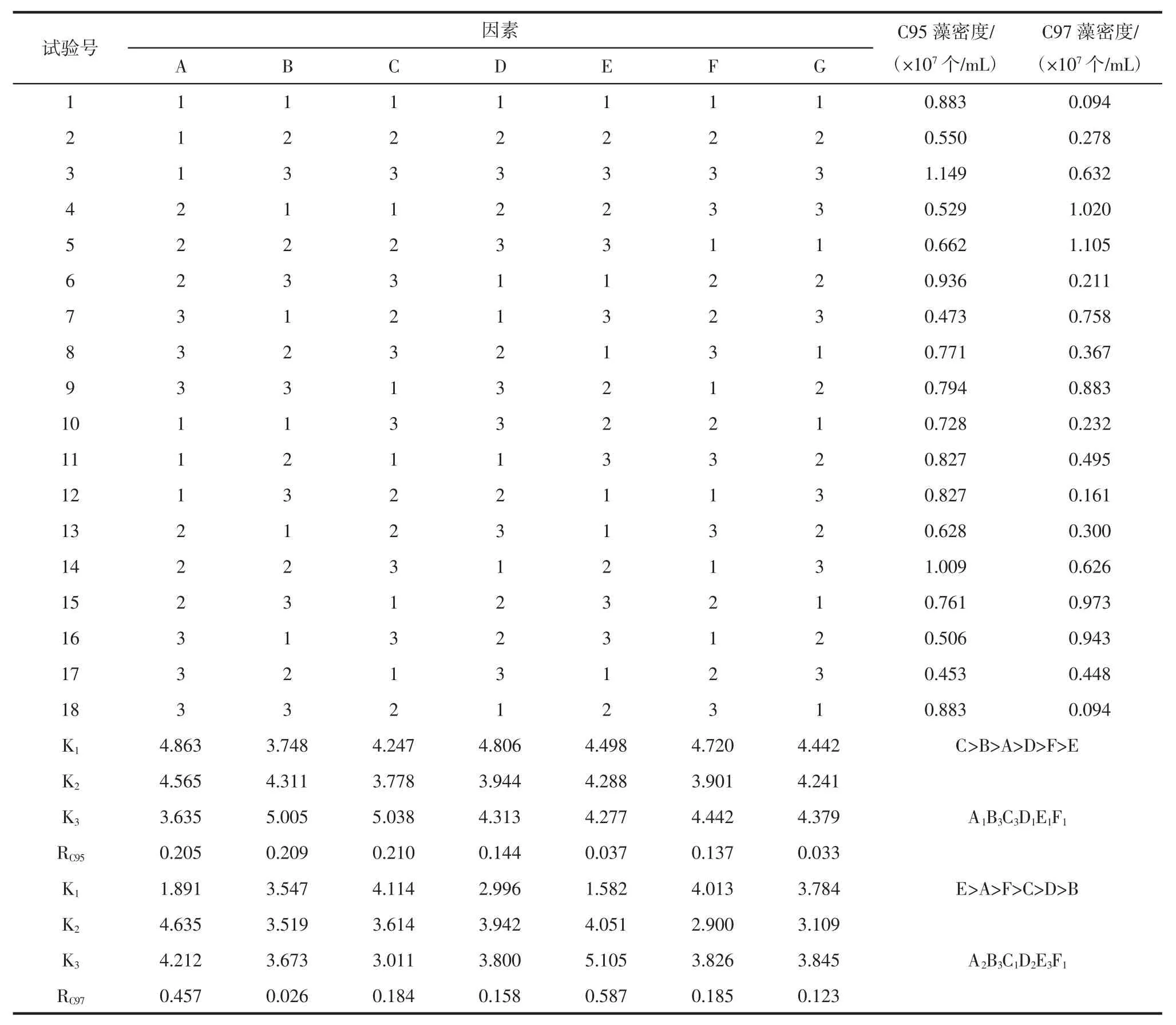
表2 L18(37)正交试验结果Table 2 Results of L18(37)orthogonal experiments

表3 小球藻C95 培养基优化正交试验方差分析Table 3 Analysis of variance of orthogonal experiment for Chlorella C95 medium optimized
由表2 极差RC97值可知,各因素对小球藻C97 生长过程中藻密度的影响程度的大小顺序为E>A>F>C>D>B,即NaNO3对小球藻C97 的密度影响最大,依次为 微 量 元 素 母 液 、FeC6H5O7·5H2O、NaH2PO4·2H2O、Na2SiO·39H2O、维生素母液。通过表2、表4 分析可得出各因素理论上的最佳组合为A2B3C1D2E3F1,即微量元素母液1.6 mL/L,维生素母液2.4 mL/L,NaH2PO4·2 H2O 4.0 g/L,Na2SiO3·9H2O 11.0 g/L,NaNO380.0 g/L,FeC6H5O7·5H2O 3.0 g/L,其中微量元素母液、NaNO3的浓度对藻密度有显著影响。由表2 极差RC95值和极差RC97值可知,NaH2PO·42H2O、NaNO3分别对小球藻 C95、小球藻C97 藻密度的影响最大,说明氮、磷元素对这两株小球藻的生长至关重要,这与李荷芳等[24]的研究结果一致。
对得出的分别适合小球藻C95 和小球藻C97 生长的最优培养基组合条件进行验证,最终测得小球藻C95 的藻细胞密度为 1.371×107个/mL,小球藻 C97 的藻细胞密度为1.263×107个/mL,藻细胞密度大于其他培养基组合藻细胞密度,说明正交优化得到的小球藻C95 和小球藻C97 最优培养基组合适合于小球藻的培养。

表4 小球藻C97 培养基优化正交试验方差分析Table 4 Analysis of variance of orthogonal experiment for Chlorella C97 medium optimized
2.2 两株小球藻的生长曲线
按照1.3.2 试验方法培养两种小球藻,以为时间(d)横坐标,细胞密度(104个/mL)为纵坐标制作生长曲线,如图2。从绘制的生长曲线不难发现两种小球藻的生长大致都分为3 个阶段,其中C95 在第1 天就开始进入对数生长期,在第5 天到达对数末期并开始进入稳定期;而小球藻C97 也是第1 天开始进入对数生长期,而其对数末期是在第6 天并开始进入稳定期。

图2 小球藻C95 与小球藻C97 的藻种培养生长曲线Fig.2 Growth curve of algae culture of Chlorella C95 and Chlorella C97
2.3 两株小球藻15L规模培养的生长曲线
研究发现,生长时期对小球藻脂肪酸含量和脂肪酸组成具有一定的影响。陈炜等[25]研究发现,小球藻在对数生长期时EPA 含量达到最高,占总脂肪酸的17.92%。所以按照1.3.4 试验方法15L 规模培养两种小球藻,并分别绘制生长曲线,见图3。

图3 小球藻C95 与小球藻C97 15L 培养生长曲线Fig.3 15L culture growth curve of Chlorella C95 and Chlorella C97
由图3 可以看出,15L 规模培养时,小球藻C95 第1 天就进入对数生长期,第4 天到达对数末期,然后进入稳定期。最高细胞密度达到9.53×107个/mL,于第4天收获小球藻C95。小球藻C97 也第1 天就进入对数生长期,第5 天到达对数末期,然后进入稳定期。最高细胞密度达到8.91×107个/mL,于第5 天收获小球藻C97。与彭爱红等[26]利用响应面优化法优化f/2 培养基,和丁丽欢等[27]利用单因子、正交试验优化兼养培养基获取的结果相比,其生物量要高于他们获取的生物量,可能与优化后的培养基组成不同有关。Cao 等[28]对30 株海洋绿藻进行研究时,其中包含C95 和C97 两株小球藻,小球藻C95 与小球藻C97 的研究结果均低于本试验获取的生物量的研究结果,可能与培养基是否优化以及光照强度不同有关。
2.4 两株小球藻EPA产量
将小球藻C95 与小球藻C97 甲酯化,用GC 法测定两种小球藻EPA 含量,得到两种小球藻EPA 甲酯与标准品EPA 甲酯的气相色谱图,见图4。
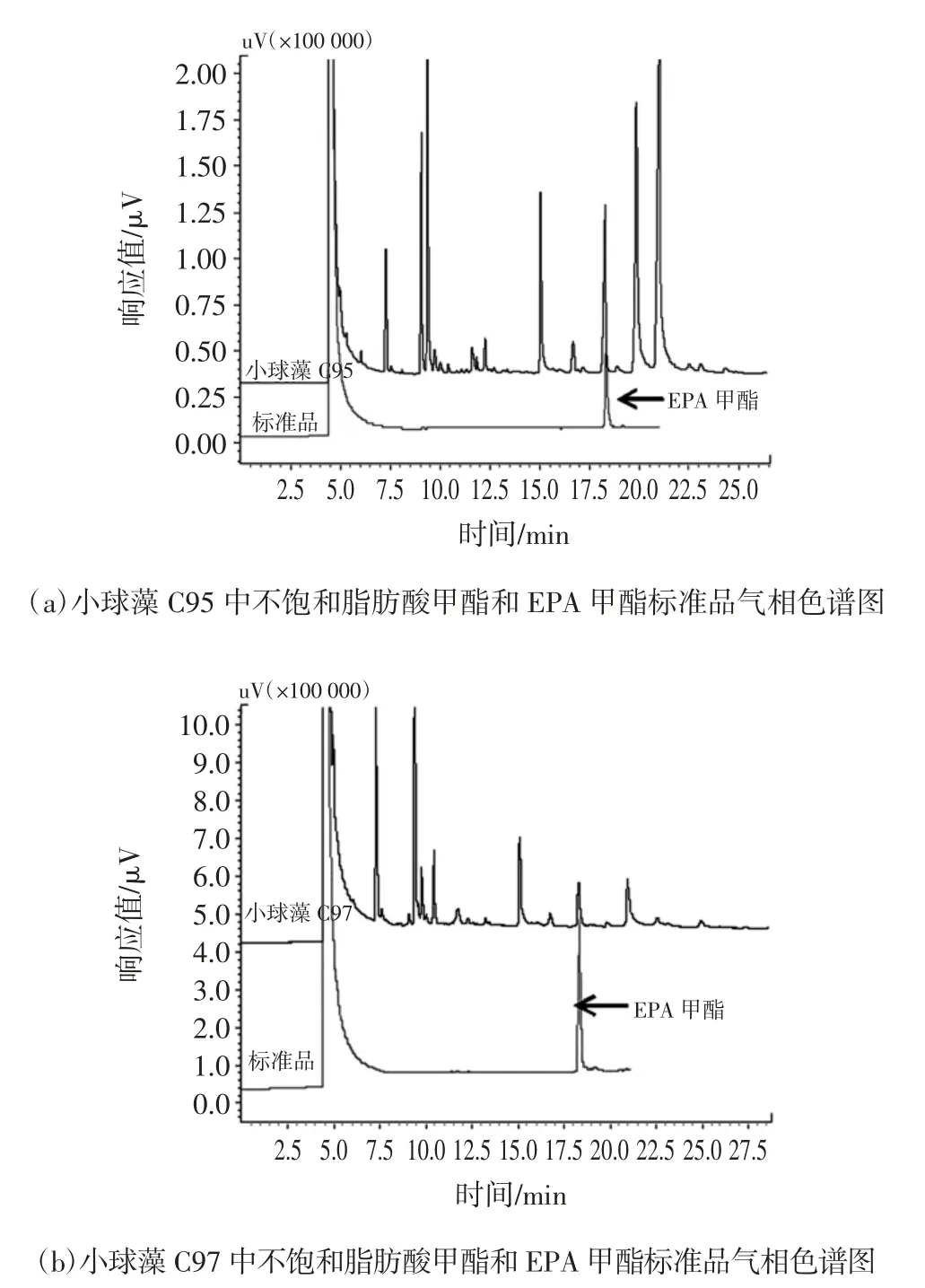
图4 两株小球藻中不饱和脂肪酸甲酯和EPA 甲酯标准品气相色谱图Fig.4 Gas chromatogram of fatty acid methyl esters in two strains of Chlorella and EPA methyl ester standard
从图4中(a)和(b)图可以发现,EPA 甲酯标准品在滞留时间5 min 附近有一个明显的峰,为溶剂正己烷的峰,18.345 min 处为标准品EPA 甲酯的峰。对照EPA 甲酯标准品的EPA 甲酯的峰,小球藻C95 滞留时间18.278 min 处及小球藻C97 滞留时间18.309 min处的峰为EPA 甲酯的峰。标准品的EPA 甲酯峰面积为 386 048.1;小球藻 C95 的 EPA 甲酯峰面积为759 248.7;小球藻C97 EPA 甲酯峰面积为112 844.6。标准品EPA 甲酯的浓度为974.878 31 mg/L,根据样品的EPA 甲酯峰面积与EPA 甲酯标准样品的峰面积计算两株小球藻的EPA 含量,得出小球藻C95 的EPA含量占总脂肪酸的30.2%,小球藻C97 的EPA 含量占总脂肪酸的29.5%。本研究中小球藻C95 与小球藻C97 得到的高含量EPA 与曹春晖[16]对这两株小球藻研究得到的高含量EPA 结果相一致且高于其研究结果,可能与优化后培养基组成有关。
3 结论
本研究得出如下结论,适合小球藻C95 生长的优化培养基组成为:微量元素母液0.8 mL/L,维生素母液2.4 mL/L,NaH2PO·42H2O 6.0 g/L,Na2SiO·39H2O 9.0 g/L,NaNO360.0 g/L,FeC6H5O·75H2O 3.0 g/L;适合小球藻 C97生长的优化培养基的组成为:微量元素母液1.6 mL/L,维生素母液 2.4 mL/L,NaH2PO4·2 H2O 4.0 g/L,Na2SiO3·9H2O 11.0 g/L,NaNO380.0 g/L,FeC6H5O7·5H2O 3.0 g/L。在优化的培养基条件下,小球藻C95 和小球藻C97 分别在第4 天和第5 天达到对数末期,其细胞密度分别为 9.53×107个/mL、8.91×107个/mL;其中小球藻 C95 的EPA 含量占总脂肪酸的30.2%,小球藻C97 的EPA 含量占总脂肪酸的29.5%,小球藻C95 的EPA 含量要高于小球藻C97 的含量。
