叶生小皮伞不同发酵产物中多糖含量比较
2020-04-26娄玲陈长宝赵天倚穆双双王欢王淑敏
娄玲,陈长宝,赵天倚,穆双双,王欢,※,王淑敏※
(1.长春中医药大学菌物药生物技术工程实验室,吉林 长春 130117;2.长春中医药大学人参科学研究院,吉林 长春 130117)
真菌多糖是自然界中存在种类较多、生物活性较高的一类活性多糖,是从真菌子实体、菌丝体、发酵液中分离出的,由10 个以上的单糖通过糖苷键连接而成的高分子多聚物[1]。现代研究表明,许多药用真菌因具有抗肿瘤、抗衰老、提高免疫力和抗感染等多种生理活性,越来越受到国内外科研工作者的关注[2]。
叶生小皮伞(Marasmius epiphyllus(Pers.)Fr.,隶属于蘑菇纲(Agaricomycetes)蘑菇目(Agaricales)小皮伞科(Marasmiaceae)小皮伞属(Marasmius),子实体小,菌盖坚韧,单生或散生,广泛分布于华北、华中、东北等地[3]。液体发酵和固体发酵培养[4],有利于叶生小皮伞工业大规模培养。本研究利用液体和固体发酵2种发酵方式对叶生小皮伞进行培养,同时测定不同发酵产物中多糖的含量,不仅可作为衡量叶生小皮伞质量指标之一,而且为其发酵产物的药效学研究奠定了基础。
1 材料与方法
1.1 材料
1.1.1 供试菌株 叶生小皮伞采于吉林省长春市净月潭国家森林公园,经长春中医药大学王淑敏教授鉴定为叶生小皮伞,分离纯化得到其菌株ME-1。
1.1.2 仪器 TYS-200 高速多功能粉碎机(浙江永康市红太阳机电有限公司);HH6 数显恒温水浴锅(常州市江南实验仪器厂);AUY220 万分之一分析天平(岛津国际贸易上海有限公司);AU2450 紫外分光光度计(岛津国际贸易上海有限公司);TGL16 高速冷冻离心机(湖南凯达科学仪器有限公司)。
1.1.3 试剂 D(+)无水葡萄糖标准品(上海源叶生物科技有限公司,纯度≥98%);甲醇为色谱纯(美国Fisher公司);麦芽糖、酵母粉、磷酸二氢钾和硫酸镁(北京化工厂)。
1.2 方法
1.2.1 ME-1 液体深层发酵培养 3%麦芽糖,2%酵母粉,0.15% KH2PO4,0.1% MgSO4·7H2O;发酵条件为:在温度为(27±1)℃,转速为 150 r/min,适宜的pH 值为5~6,最佳装量为 140 mL/500 mL,发酵天数为 10 d[5]。
1.2.2 ME-1 固体发酵培养 薏米∶麦麸=2∶1,含水量为80%、接种块数为6 块,pH值自然,发酵温度(27±1)℃,发酵天数为20 d,60 ℃烘干备用。
1.2.3 ME-1 菌丝、发酵液以及固体发酵产物中多糖含量测定
1.2.3.1 对照品的制备 参照徐德峰等[6]对照品的制备方法,称取无水葡萄糖适量,于105 ℃干燥至恒重后,精密称取无水葡萄糖适量,加适量水溶解并定容至100 mL容量瓶中,配制成浓度为1.018 mg/mL的葡萄糖对照品溶液。
1.2.3.2 样品的制备 称取发酵液5.04g、菌丝3.50 g、固体发酵产物5.00 g,分别加水80.0 mL,于沸水浴中加热 1 h 后,放冷,分别加水定容至 100.0 mL(v1),混匀后过滤,弃去初滤液,收集余下滤液,备用。
1.2.3.3 标准曲线的绘制 准确吸收葡萄糖标准使用液 0.6、0.8、1.2、1.6、1.8、2.0 mL 置于 25.0 mL 比色管中,补水加至2.0 mL,加入5%苯酚溶液1.0 mL,混匀,加 5.0 mL 的 H2SO4,混匀,沸水浴加热 15.0 min,冷却至室温,用分光光度计在492 nm波长处以试剂空白为参比,1 cm 比色皿测定吸光度。以葡萄糖质量(mg)为横坐标(X)、吸光度(A)为纵坐标(Y)绘制出标准曲线[7],得出回归方程为Y=0.4514X 0.0728(r=0.9993),在0.610 8~2.036 mg 范围内线性关系良好。
1.2.3.4 样品多糖含量的测定 准确吸取上述滤液10.0mL(v2),置于50.0mL离心管中,加入无水乙醇20.0mL,混匀,于4 ℃冰箱静止4 h 以上,以4 000 r/min 离心5.0 min,残渣用95%乙醇重复洗涤3 次。发酵液用水溶解定容至10.0 mL(v3)容量瓶中,菌丝用水溶解定容至5 mL(v3)容量瓶中,固体发酵产物定容至10.0 mL(v3)容量瓶中。分别精密吸取上述发酵液0.6 mL(v4)、菌丝 0.8 mL(v4)、固体发酵产物 0.7 mL(v4),按“1.2.3.3”的方法测定吸光度,并计算样品中粗多糖的含量,计算方法如下:

式中,X 为样品中粗多糖含量(mg/g);m1 为样品测定液中葡萄糖的质量(mg);m2为样品质量(g);v1为样品提取液总体积(mL);v2为沉淀粗多糖所用样品提取液体积(mL);v3为粗多糖溶液体积(mL);v4为测定用样品体积(mL);0.9 为葡萄糖换算为粗多糖的系数。
1.2.4 方法学考察
1.2.4.1 精密度试验 吸取发酵液、菌丝及固体发酵物的样品供试液,按照“1.2.3.3”项下的方法计算多糖含量,重复测定6 次。
1.2.4.2 稳定性试验 吸取发酵液、菌丝及固体发酵物的样品供试液,按照“1.2.3.3”项下的方法每隔5 min测定其吸光度。
1.2.4.3 重复性试验 吸取发酵液、菌丝及固体发酵物的样品供试液,按照“1.2.3.3”项下的方法计算供试液中多糖含量,重复测定6 次。
1.2.4.4 加样回收率试验 取已知多糖含量的供试品各6 份,精密加入葡萄糖对照品适量,按照“1.2.3.2”项下的制备方法得续滤液,按照“1.2.3.3”项下绘制的标准曲线计算供试液含量,计算加样回收率。
2 结果与分析
2.1 精密度试验
按照“1.2.4.1”项下的方法,精密度试验结果如表1 所示。结果发现,发酵液的吸光度平均值为0.589 3,RSD=1.62%;菌丝的吸光度平均值为 0.491 1,RSD=1.89%;固体发酵物的吸光度平均值为0.554 4,RSD=1.54%。RSD均小于2,表明该测量方法精密度良好。

表1 精密度试验结果Table 1 Precision test results
2.2 稳定性试验
按照“1.2.4.2”方法操作,稳定性试验结果如表2所示。结果发现,发酵液的吸光度平均值为0.574 2,RSD=0.62%;菌丝的吸光度平均值为 0.478 3,RSD=0.65%;固体发酵物的吸光度平均值为0.513 5,RSD=1.91%。RSD 均小于2,表明该测量方法稳定性良好。

表2 稳定性试验结果Table 2 Stability test results
2.3 重复性试验
按照“1.2.4.3”项下的方法,重复性试验结果如表3 所示。结果发现,发酵液的吸光度平均值为0.586 7,RSD=0.39%;菌丝的吸光度平均值为=0.478 3;RSD=1.05%;固体发酵物的吸光度平均值为0.557 2,RSD=1.28%。RSD 均小于2,表明该测量方法重复性良好。
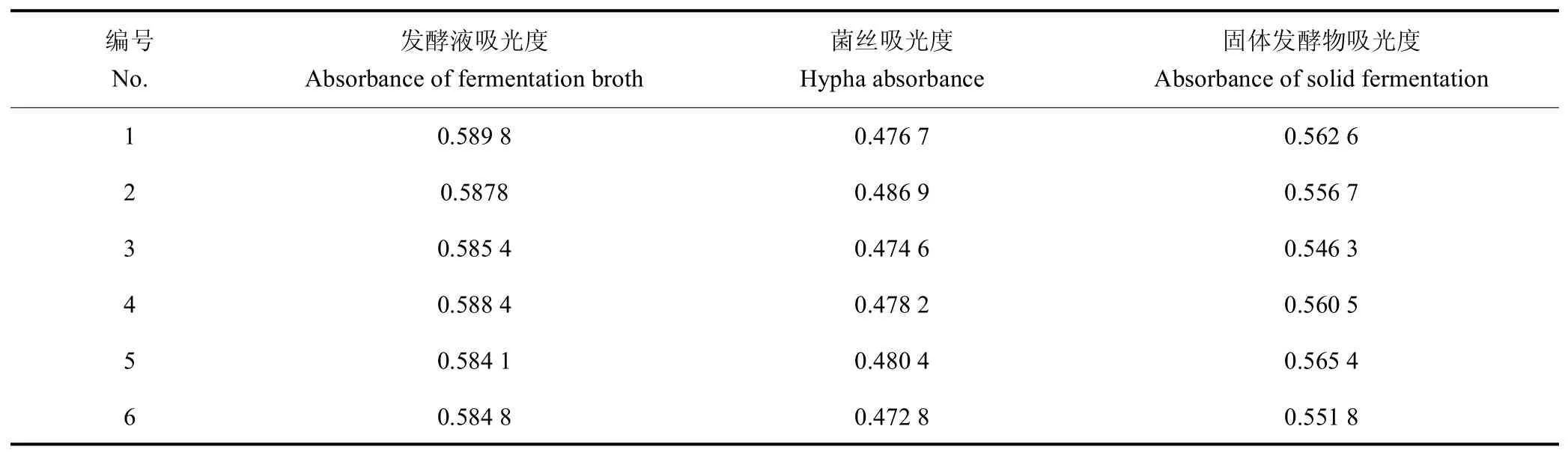
表3 重复性试验结果Table 3 Reproducibility test results
2.4 加样回收率试验
按照“1.2.4.3”项下的方法,结果见表4~6,计算得出发酵液的平均回收率为98.55%,RSD=0.89%;菌丝的平均回收率为99.08%,RSD=1.68%;固体发酵物的平均回收率为 99.63%,RSD=1.38%。回收率均在95%~105%,RSD均小于2,表明该测量方法准确性良好。

表4 发酵液加样回收率试验结果Table 4 Results of recovery rate tests of fermentation broth

表5 菌丝加样回收率试验结果Table 5 Results of recovery rate tests of mycelium

表6 固体发酵物加样回收率试验结果Table 6 Results of recovery rate tests of solid fermentation products
2.5 多糖含量的测定

?
按照公式(1)计算得出,叶生小皮伞发酵液中多糖平均含量为42.56 mg/g,固体发酵产物中多糖的平均含量为 33.43 mg/g,菌丝中多糖的平均含量为19.61 mg/g(表7)。发酵液多糖约为菌丝体多糖含量的2.2 倍,是固体发酵物中多糖含量的1.3 倍。
3 讨论
我国的真菌资源极其丰富,而目前大多数未被开发和利用,造成资源的浪费。越来越多的研究发现,真菌多糖是食药用菌中的主要活性成分之一,具有抗肿瘤、提高免疫力、抗氧化等多种药理作用[8],虽然近年来我国食药用菌多糖研究飞速发展,但真菌多糖制品与中药现代化还存在一定差距[9-10],因此,有必要对野生真菌资源进行深入挖掘,尤其是真菌多糖的构效关系,需要深入探究。
本研究对比了液体发酵和固体发酵2 种培养方式下,叶生小皮伞菌株ME-1 的发酵产物多糖含量,同时对方法进行了方法学考察,结果表明,叶生小皮伞发酵液中多糖平均含量为42.56 mg/g,菌丝中多糖的平均含量为19.61 mg/g,固体发酵产物中多糖的平均含量为33.43 mg/g,发酵液多糖约为菌丝体多糖含量的2.2倍,是固体发酵物中多糖含量的1.3 倍。本研究为进一步研究其多糖的结构、活性以及发开多糖相关的功能性食品、药品奠定基础。
