不同毒株犬瘟热病毒结构基因的通用扩增及序列测定
2020-04-26卜研史一珺薛向红赵传芳陈杰廉士珍朱言柱胡博
卜研,史一珺,薛向红※,赵传芳,陈杰,廉士珍,朱言柱,胡博
(1.中国农业科学院特产研究所,吉林 长春 130112;2.烟台市动物疫病预防与控制中心,山东 烟台 264003)
犬瘟热(canine distemper,CD)是由犬瘟热病毒(canine distemper virus,CDV)感染犬、狐、貉和水貂等多种肉食动物而引起的一种急性热性、高度接触性传染病[1]。该病发病率高,临床症状多样,感染后期容易继发混合感染,死亡率高达30%~100%。近年来,CDV自然感染宿主不断增多。随着人类对犬、猫等宠物拥有数量的增多,犬瘟热病毒在给动物养殖业、生物多样化带来极大损失和危害的同时,还威胁着社会公共安全[2-3]。
CDV是副黏病毒科麻疹病毒属成员,其基因组为单股负链不分节段RNA。从基因组3'到5'端依次为3'端前导序列、核蛋白(N)基因、磷蛋白(P)基因、基质蛋白(M)基因、融合蛋白(F)基因、血凝素蛋白(H)基因、聚合酶蛋白(F)基因和5'尾随序列[4-5]。其中,H基因是变异率最高的,是CDV 野毒株分子流行病学调查的主要靶基因[6]。基于H基因的多样性,CDV可分为Asia 1、Asia 2、Europe、European wildlife、America-2、Arctic和America-1 型(又称疫苗型)。不同基因型犬瘟热病毒均属于一个血清型。我国流行毒株主要是Asia 1,但不同犬瘟热病毒野毒对不同种属易感动物致病性差别较大,核苷酸序列存在较大差异,且同CDV-3、Lederle、Onderstepoort 等疫苗株的核苷酸序列同源率较低,为89%~90%。由于犬瘟热病毒野毒株难以适应Vero 细胞,且经过细胞传代后,存在毒力降低或丢失[7]。因此,学者们构建了稳定表达犬瘟热病毒受体-信号淋巴细胞激活因子(signalling lymphocyte activation molecule,SLAM)的Vero-SLAM细胞,大大提高了犬瘟热病毒野毒的分离效率,因此成为目前分离犬瘟热病毒的首选细胞[8-9]。但犬瘟热病毒野毒分离株在Vero-SLAM细胞上连续传代之后是否会发生毒力下降尚无报道。因此,为了快速、精准获得CDV 结构基因序列,及时准确地追溯犬瘟热发病病源和开展CDV 遗传进化分析,本研究设计6 对特异性通用引物,分别对应CDV 毒株的6 个结构基因区域,能够同时扩增CDV野毒和疫苗毒株,预测能够实现未知CDV结构基因的有效扩增。该扩增体系的建立,还有助于明确CDV 野毒分离株适应细胞前后,其结构基因核苷酸水平和氨基酸水平变异情况,为人们探究CDV 致病机制、寻找关键毒力位点提供基础,同时,也有望为核酸疫苗和亚单位疫苗研制,及反向遗传学系统建立奠定基础。
1 材料与方法
1.1 材料
1.1.1 毒株 犬瘟热病毒野毒HBF-1 株、SD14(7)株,犬瘟热病毒疫苗毒CDV-3株、OR12株、CDV/R-20/8株,均由中国农业科学院特产研究所疫病防控研究室保存。
1.1.2 主要试剂和仪器 GeneAmp PCR System 2700、Nanodrop 2000(ThermoFisher);RNeasy Mini Kit(Qiagen);SuperScriptⅢ First-Strand Synthesis Super-Mix(Invitrogen);质粒小量提取试剂盒(Axygen);2 TransStart®FastPfuPCRSuperMix(Transgen);DNAMarker 15 000、DNA Marker 2 000(TaKaRa)。
1.2 方法
1.2.1 引物设计 根据GenBank 中公布的23 个犬瘟热病毒全基因组序列,具体毒株和GenBank 号如下:01-2689(AY649446)、007Lm/B(AB490680)、Onderstepoort(AF378705)、CDV SY(KJ466106)、LN(10)1(KP765764)、98-2654(AY466011)、00-2601(AY443350)、SD(14)7(KP765763)、HLJ1-06(JX681125)、98-2646(AY542312)、98-2645(AY445077)、CDV2784-2013(KF914669)、A75 17(AF164967)、Hebei(KC427278)、CDV-3(EU726268)、M25CR/H(AB490681)、50CBI/H(AB490678)、011C/H(AB490674)、PS(JN896331)、Snyder Hill(GU138403)、164071(EU716337)、CDVRD-JL(KJ848781)、CDV-ZC(KJ994343)。对上述所有毒株的各个结构基因序列进行比对分析,利用软件Primer Premier 5.0 共设计6 对特异性通用引物(序列见表1),用于不同毒株犬瘟热病毒各个结构基因的扩增和序列测定,预期6 个目的条带大小分别为1 620、1 614、1 048、2 009、1 894、6 600 bp。
1.2.2 不同毒株犬瘟热病毒RNA提取 根据RNeasy Mini Kit 操作说明,对不同毒株犬瘟热病毒的总RNA进行提取。具体操作如下:取犬瘟热病毒Vero 细胞培养液200µL,加入350µL RLT 使其充分裂解。之后加入等体积的70%乙醇,吹打混匀。取700µL加入到RN-easy spin column 中,置于 2 mL 收集管中,10 000 r/min 离心 15 s,弃流出液。700 µL Buffer RW1 到 RNeasy spin column 中,10000r/min离心15s,弃流出液。500µL Buffer RPE 到 RNeasy spin column 中,10 000 r/min 离心 15 s,弃流出液。500 µL Buffer RPE 到 RNeasy spin column中,10 000 r/min 离心 15 s,将 RNeasy spin column 置于新的2 mL 收集管中,全速离心1 min。将RNeasy spin column 置于新的1.5 mL 收集管中,在滤膜中间加入40 µL RNase free water 10 000 r/min 离心 1 min,洗脱获得病毒细胞悬液的总RNA。

表1 犬瘟热病毒6 个结构基因扩增用通用引物序列Table 1 Universal primer sequences for amplification of six structural genes of CDV
1.2.3 不同毒株犬瘟热病毒cDNA合成 利用Super-ScriptⅢFirst-Strand Synthesis SuperMix试剂盒反转录合成cDNA。以“1.2.2”中获得的总RNA为模板5µL,50 mmol/L Oligo(dT)1 µL,50 ng/µL Random Hexamers 1µL,Annealing Buffer 1µL,混匀之后在 65 ℃孵育5 min,立即放冰上1 min。之后加入2 First-Strand Reaction Mix 10 µL 和 SuperscriptⅢ RNaseOut Enzyme Mix 2µL 吹打混匀,短离心,在50 ℃孵育50 min。
1.2.4 不同毒株犬瘟热病毒各个结构基因扩增 根据普通 PCR 试剂盒 2 TransStart®FastPfu PCR SuperMix的说明操作,进行PCR 扩增。PCR 反应总体系50 µL包含以下组分:2 TransStart®FastPfu PCR SuperMix 25µL,上游引物 1µL,下游引物1µL,病毒cDNA2µL,ddH2O补齐至 50 µL。设定 PCR 程序:95 ℃ 2 min;95 ℃ 20 s,实际退火温度(参照表1 中预先摸索好的不同引物对的退火温度)20 s,72 ℃ 30 s,40 个循环;72 ℃ 7 min。取不同毒株犬瘟热病毒的N、P、M、F、H 和L 基因的PCR产物5µL进行1%琼脂糖凝胶电泳,判断条带大小,同时验证引物的特异性、通用性。
1.2.5 犬瘟热病毒结构基因序列测定 将野毒HBF-1株和疫苗毒CDV-3 株的6 个PCR 扩增片段进行凝胶回收后,所有片段连接至平端载体pEASY-Blunt,利用双酶切鉴定出正确的重组子,送上海生工进行片段序列测定,最后利用SeqMan进行全长拼接。将HBF-1 株的各个结构基因序列与GenBank 公布的Hebei 株序列进行同源性比对;将CDV-3 株的各个结构基因序列与GenBank 公布的CDV-3 株序列进行同源性比对。
1.2.6 各个基因扩增用引物对的特异性 为了明确各个基因扩增用的引物对是否只能针对犬瘟热病毒扩增,对其他种类的犬源病毒(如犬细小病毒和犬II 型腺病毒)能否实现扩增,以犬细小病毒和犬II 型腺病毒DNA 为模板,用之前摸索好的相同条件进行PCR扩增。扩增产物用1%琼脂糖凝胶电泳鉴定。
2 结果与分析
2.1 犬瘟热病毒各个结构基因的PCR扩增结果
利用特异性通用引物(表1),对犬瘟热病毒野毒HBF-1 株、SD14(7)株和犬瘟热病毒疫苗毒CDV-3 株、OR12 株、CDV/R-20/8 株的 cDNA 进行扩增。取 5 µL扩增产物进行1%琼脂糖凝胶电泳,结果显示,筛选的6 对特异性通用引物能够实现对不同毒株的N、P、M、F、H 和L 基因特异性扩增,而且获得目的条带大小,与预期一致(图1~6)。
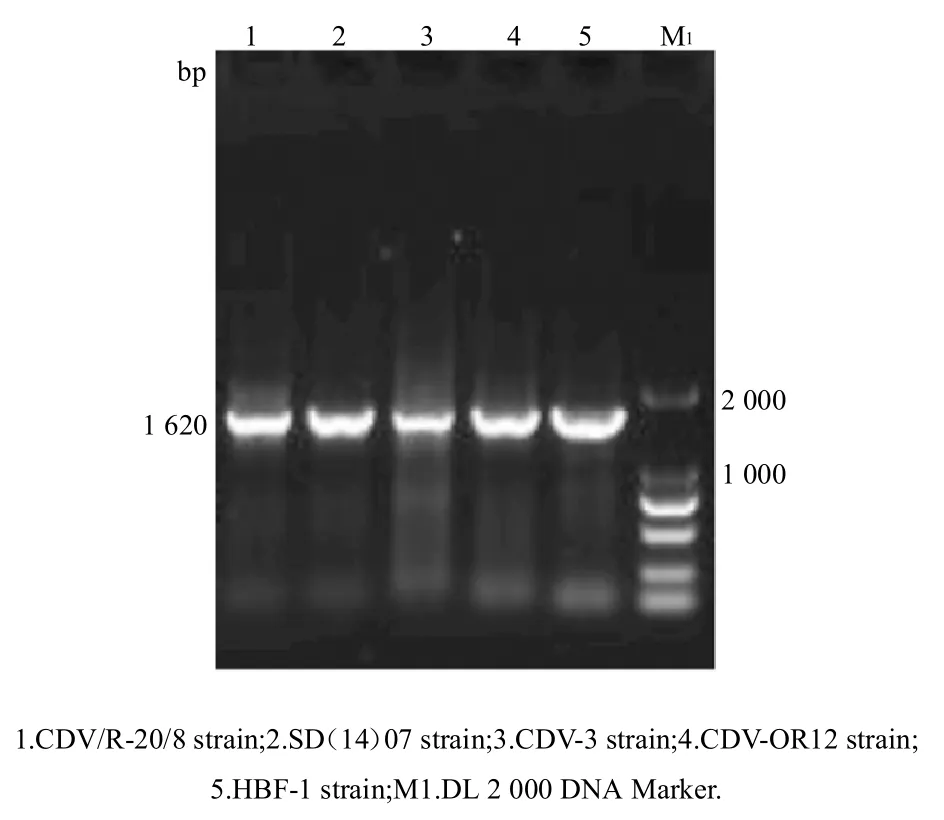
图1 犬瘟热病毒不同毒株N 基因的扩增结果Fig.1 Amplification of N gene for different strains of CDV

图2 犬瘟热病毒不同毒株P 基因的扩增结果Fig.2 Amplification of P gene for different strains of CDV

图3 犬瘟热病毒不同毒株M 基因的扩增结果Fig.3 Amplification of M gene for different strains of CDV
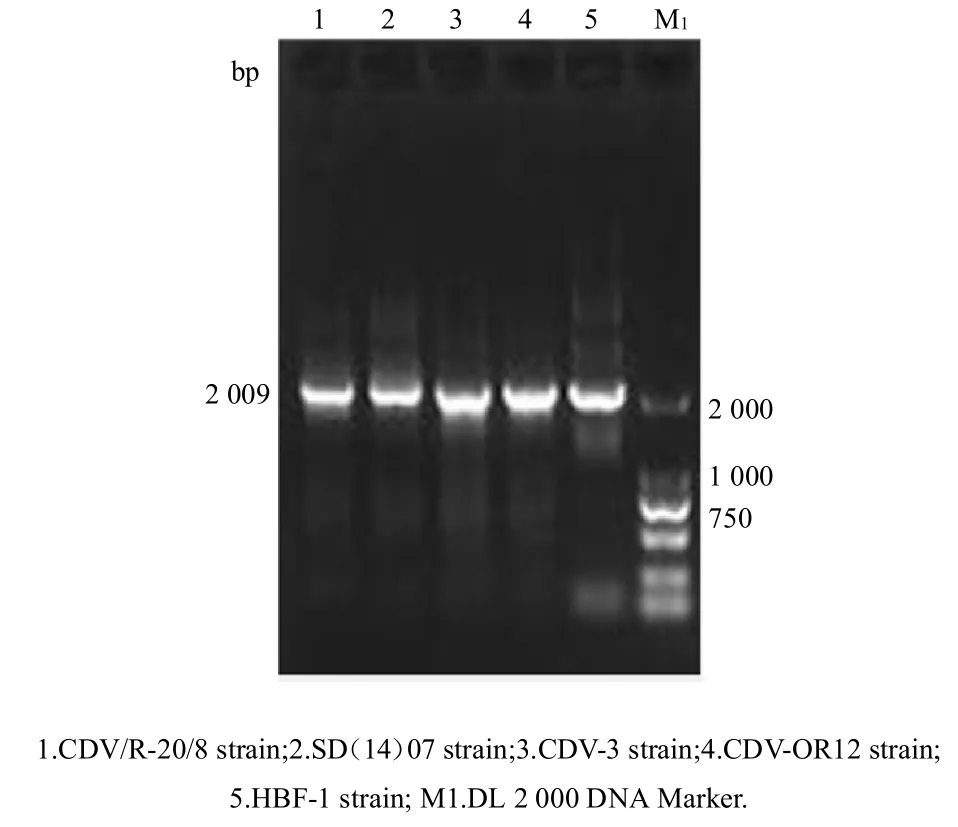
图4 犬瘟热病毒不同毒株F 基因的扩增结果Fig.4 Amplification of F gene for different strains of CDV

图5 犬瘟热病毒不同毒株H 基因的扩增结果Fig.5 Amplification of H gene for different strains of CDV

图6 犬瘟热病毒不同毒株L 基因的扩增结果Fig.6 Amplification of L gene for different strains of CDV
2.2 犬瘟热病毒野毒HBF-1株各个结构基因的序列测定
对犬瘟热病毒野毒 HBF-1 株扩增获得的6 个结构基因片段,琼脂糖凝胶电泳后,进行胶回收纯化。将片段连接至平端载体pEASY-Blunt 上,挑取阳性克隆子送上海生工进行序列测定,每个碱基至少测序6 次以上,确保序列的准确性。HBF-1 的各个结构基因序列与2012 年 GenBank 公布的 Hebei 株的对应的结构基因序列进行比对,由于HBF-1 是Hebei株在Vero-SLAM细胞上的适应株,因此两者的同源率高达99.8%~100%。此外,CDV 核苷酸序列具有高变性[10]。本研究设计的6 对引物,能针对犬瘟热病毒野毒株HBF-1 的各个结构基因进行准确扩增,获得6 个结构基因的准确序列。
2.3 犬瘟热病毒疫苗毒CDV-3株各个结构基因的序列测定
对CDV-3 株病毒扩增获得的6 个结构基因片段,琼脂糖凝胶电泳后,进行胶回收纯化。将片段连接至平端载体pEASY-Blunt 上,挑取阳性克隆子送上海生工进行序列测定,每个碱基至少测序6 次以上,确保序列的准确性。最后,获得CDV-3 株的全基因组序列。与2012 年GenBank 公布的CDV-3 株各结构基因序列进行比对,发现同源率高达99.3%。证实,本研究设计的6 对引物,能针对犬瘟热病毒疫苗毒CDV-3 株的6 个结构基因进行准确扩增,获得其准确序列。
2.4 各个基因扩增用引物对的特异性
以犬细小病毒和犬II 型腺病毒DNA 为模板,用之前摸索好的相同条件进行PCR 扩增。扩增产物用1%琼脂糖凝胶电泳鉴定,结果如图7 所示。图1~6 与图7,互为阴阳性对照。
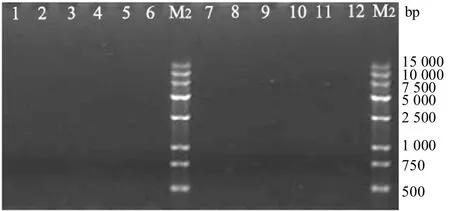
图7 6对引物对犬细小病毒和犬II型腺病毒基因组的扩增结果Fig.7 Genome amplification of canine parvovirus and canine adenovirus type II by six pairs of primers
3 讨论
近年来,犬瘟热病毒自然感染宿主扩大,多种野生动物,甚至珍稀野生动物有报道感染CDV 而发病、死亡[11]。学者们利用细胞传代适应法获得了多株犬瘟热病毒分离株,但是犬瘟热病毒分离株在Vero 或Vero-SLAM细胞上连续传代之后是否会发生毒力位点的突变,这些突变是否会影响病毒毒力下降尚无明确报道。因此,准确获得犬瘟热病毒野毒株的6 个结构基因序列,对寻找关键毒力位点至关重要。另外,及时准确地获取不同毒株(甚至未知毒株)犬瘟热病毒结构基因序列,有利于分析犬瘟热病毒遗传进化规律,追溯犬瘟热病毒的可能来源。同时,可为核酸疫苗、亚单位疫苗和反向遗传平台的建立奠定基础。
目前,针对犬瘟热病毒各个结构蛋白的基因扩增有一些报道[12-13],均是针对一种毒株的。犬瘟热病毒可以感染很多宿主,实现跨种属感染与传播,犬瘟热病毒野毒株与疫苗株基因序列变异率较大,尤其是H 和F 基因序列。因此,为了提高科研效率、节省科研时间和避免资源浪费,本研究设计并筛选出6 对特异性通用引物,一次性精确地实现了犬瘟热病毒野毒和疫苗毒株6 个结构蛋白基因的通用扩增,对犬细小病毒和犬腺病毒均无扩增,证明了6 对引物的通用性和特异性。扩增过程中,可能因为病原模板量的不同,存在扩增亮度的稍微差异,可以通过增加扩增体系,实现大量扩增。HBF-1 是狐源犬瘟热病毒野毒分离株[14],OR12是犬瘟热病毒貉体适应株,可见,本研究设计的6 对通用引物能够实现不同宿主来源的犬瘟热病毒结构蛋白基因的有效扩增。这大大提高了获得不同毒株犬瘟热病毒结构基因序列的效率,缩短了获得其他犬瘟热病毒未知毒株结构基因序列的时间。这有助于我们明确犬瘟热野毒适应细胞前后病毒各个结构蛋白核苷酸序列变异情况,追溯CDV 变异来源和规律,有助于人类认识犬瘟热病毒野毒的致病机制,为寻找犬瘟热病毒野毒关键毒力位点提供分子依据。同时,6 对引物的通用扩增,为CDV结构基因的重组构建和反向遗传平台中辅助质粒的构建提供了便利。
