复方黄芪降糖颗粒对四氧嘧啶致高血糖小鼠的降糖作用研究
2020-04-26张亚楠赵琼玥岳可心宋凤瑞刘志强皮子凤
张亚楠,赵琼玥,岳可心,宋凤瑞,刘志强,皮子凤※
(1.中国科学院长春应用化学研究所,吉林 长春 130022;2.吉林大学药学院,吉林 长春 130021)
糖尿病,中医谓之“消渴”,临床具有阴津亏损、饮食不节、体形肥胖等表现。在西医理论中,糖尿病是一种以高血糖为特征的常见代谢性内分泌疾病。根据糖尿病的发病机制进行划分,主要有I 型糖尿病和II 型糖尿病。由于糖尿病具有发病率高、并发症多的特点,已成为危害人类健康的高发疑难疾病。复方黄芪降糖颗粒(FFHQ)是中国科学院长春应用化学研究所自主研发的中药复方,由黄芪和白芍等中药组成。黄芪中主要含有三萜皂苷类、多糖类和黄酮类三大类成分,此外还含有亚油酸、亚麻酸、绿原酸和微量元素等多种化学成分。三萜皂苷类为黄芪中主要的有效成分,黄芪甲苷含量最高[1]。Jiang等[2]研究发现,黄芪甲苷通过诱导脂肪细胞的TNF分泌,降低3T3-L1 脂肪细胞的脂解作用,改善胰岛的耐受性。此外,吕琳[3]研究表明,黄芪甲苷可以通过抑制肝脏中糖原磷酸化酶和葡萄糖-6-磷酸酶的活性,进而减少肝糖原的分解和葡萄糖的氧化,从而发挥其降糖作用。宋恩峰等[4]在黄芪提取物降糖作用的研究中给予STZ所致的糖尿病大鼠灌胃给药黄芪注射液(5 mg/kg),发现黄芪注射液可以显著改善大鼠蛋白尿、肾脏肥大、肾脏病变等症状,说明黄芪提取物对糖尿病并发症有一定的疗效。张利[5]通过对白芍(Paeonlae Radix Alba)药理作用的研究进展进行总结发现,白芍提取物的主要成分为萜类及苷类、黄酮类、多糖类和鞣质类化合物,而白芍总苷(total glucosides of paeony,TGP)是其中主要的有效成分,以单萜苷类化合物为主[6]。张蔷等[7]研究发现,TGP可以从提高胰岛素敏感性、改善脂质代谢和降低尿蛋白排泄等几个方面发挥保护糖尿病动物肾脏的作用。研究发现以TGP 灌胃给药8 周后,糖尿病大鼠肾组织中的 p38 MAPK磷酸化、NF-Bp65 的表达均下降,表明TGP可能是通过抑制p38 MAPK 信号通路和激活NF-B 来实现对糖尿病肾脏的保护作用[8]。TGP 可以降低糖尿病大鼠24 h尿白蛋白排泄率,且该作用呈剂量依赖性;Western-blot 结果表明TGP 给药8 周可显著下调肾组织中 p-JAK2、p-STAT3 和 1(IV)型胶原蛋白的表达,表明TGP可能通过抑制肾脏JAK/STAT信号通路的激活发挥改善糖尿病大鼠早期肾损害的作用[9-10]。
本研究旨在通过糖尿病小鼠模型和体外 HepG2细胞胰岛素抵抗试验,考察FFHQ 对糖尿病小鼠空腹血糖(GLU)、糖耐量(GT)、糖原水平、血清胰岛素水平、胰岛素抵抗等各项糖尿病相关指标的影响,进而评价复方黄芪降糖颗粒的降糖作用,同时对其作用机制进行初步探讨。
1 材料与方法
1.1 材料与试剂
1.1.1 试验材料 复方黄芪降糖颗粒(FFHQ)由中国科学院长春应用化学研究所自制,每1 g 颗粒相当于饮片0.84 g,其中含黄芪0.21 g、白芍0.21 g。
1.1.2 实验动物 试验用小鼠为雄性昆明小鼠,体重为18~22 g(吉林大学实验动物中心提供)
1.1.3 试剂 四氧嘧啶(ALX)(Sigma 公司);阿卡波糖(德国拜耳公司);胰岛素(Insulin,Ins)、二甲双胍(Aladdin 公司);高糖改良的 eagle 培养基(Dulbecco’s modified eagle medium,DMEM)、胎牛血清(fetal bovine serum,FBS)(美国 Life 公司);糖原含量测定试剂盒、小鼠胰岛素ELISA 检测试剂盒(南京建成生物工程研究所有限公司);葡萄糖测定试剂盒(上海荣盛生物药业有限公司);柠檬酸、柠檬酸钠(上海前尘生物科技有限公司);血糖仪、血糖试纸(北京怡成生物电子技术股份有限公司);HepG2 细胞系(中国科学院上海细胞库)。
1.2 仪器与设备
TECAN GENios 酶标仪(瑞士 Tecan 公司);Centrifuge 5810R 型冷冻离心机(德国Eppendorf 公司);HX-200A型中药粉碎机;SanoriusBSl10S分析天平(北京赛多利斯有限公司);96 孔板(美国Corning 公司);BB15 CO2细胞培养箱(美国Thermo 公司)。
1.3 方法
1.3.1 四氧嘧啶型糖尿病小鼠模型的构建 试验用小鼠禁食38 h 后,尾静脉注射ALX 75 mg/kg,给予普通饲料,饲养84 h 后,禁食12 h,剪尾取血,测定血糖值,若测定值大于16 mmol/L,则造模成功,给予普通饲料喂养。
1.3.2 小鼠分组及给药 试验动物共分为7 组,每组10 只分别为模型组、空白组、高剂量组、中剂量组、低剂量组、阳性对照组、空白给药组。FFHQ 按成人每日推荐食用量20 g,体重以60 kg 计,相当于0.33 g/kg,扩大 5、10、20 倍,给药量分别为 1.65、3.30、6.60 g/kg,依次作为FFHQ-L、FFHQ-M、FFHQ-H 组,灌胃给药;阳性对照组灌胃二甲双胍溶液(0.0025 g/kg);空白组和模型组以蒸馏水灌胃(0.02 mL/g);空白给药组以FFHQ 高剂量灌胃(5.6 g/kg)。各组小鼠给药剂量见表1,每日 1 次,连续给药 30 d。
1.3.3 HepG2 细胞胰岛素抵抗试验[11-12]HepG2 细胞在DMEM 高糖培养基(含10%FBS、1%双抗)中培养,置于饱和湿度为5%、温度为37 ℃的CO2细胞培养箱中,细胞贴壁长满后,用胰蛋白酶消化,传代。将细胞(处于对数生长期)以5 104cells/孔接种于96 孔板,置于培养箱中孵育24 h,待细胞贴壁后弃去培养液,以其中6 个细胞孔作为正常对照,其余细胞孔用于造模。
将HepG2 细胞分为模型组、阳性对照组(二甲双胍)、FFHQ 降糖颗粒提取物组每组6 个复孔。空白组细胞孔内加入5%FBS的高糖DMEM培养液200L,模型组细胞孔内加入含10 6 mol/L胰岛素、1%FBS的高糖DMEM 培养液200L,培养 48 h 弃去培养液,待胰岛素抵抗模型成功,根据分组情况加入相对应的培养液200L,置于培养箱中培养24 h 后,测定上清中葡萄糖的含量,计算消耗量,另用MTT 比色法检测细胞的增殖情况。分组如下:
1.4 指标测定
1.4.1 小鼠GLU 和GT 给药30 d 后,禁食12 h。末次灌胃给药30 min 后,小鼠进行剪尾采血,用血糖试纸和血糖仪测定GLU,以此为GT0 min 血糖值。葡萄糖以2.0 g/kg灌胃各组小鼠,于30、60、120 min测定血糖值。记录各时间点的血糖值,并计算血糖曲线下面积(AUC)。
血糖曲线下面积(AUC)=0 min(血糖测定值)0.25+30 min(血糖测定值)0.5+60 min(血糖测定值)0.75+120 min(血糖测定值)0.5
1.4.2 小鼠血清胰岛素、肝糖原、肌糖原含量 各组小鼠在末次给药后,禁食(不禁水)12 h,摘眼球取血,低温静置30 min后离心10 min(3 000 r/min),分离血清,采用小鼠胰岛素试剂盒测定血清胰岛素的含量。摘眼球取血后,处死动物,迅速取出肝脏、右侧大腿后肢肌肉,采用糖原试剂盒测定肝糖原、肌糖原含量。

1.4.4 HepG2 细胞MTT 测定 弃去待检测MTT 细胞的原培养液,每孔加入20L5mol/LMTT 溶液,37℃孵育240min后弃去孔内溶液,加入100LDMSO,37℃振荡培养10 min,测定570 nm 处吸光度。
1.5 数据统计
数据均以x ± SD 表示,组间比较用t 检验,所得数据经SPSS10.0 统计软件进行统计分析。
2 结果与分析
2.1 FFHQ对四氧嘧啶诱导糖尿病小鼠的影响
2.1.1 FFHQ 对GLU 和 GT 的影响 经FFHQ 给药30 d 治疗后测定各组小鼠的GLU,结果见表1。在30 d试验中,空白组、空白给药组的GLU相比较,无统计学意义,说明FFHQ 对正常动物血糖无影响。给药30 d中,模型组一直保持高GLU 水平,总体呈现略有上升的趋势;给药30 d 后,高剂量组(FFHQ-H)、中剂量组(FFHQ-M)、低剂量组(FFHQ-L)、阳性对照组的小鼠GLU 与模型组相比均显著降低(P <0.01 或 P <0.05)。同时,空白组、空白给药组GLU 比较无显著性差异,说明FFHQ 对正常动物血糖无影响。

表1 FFHQ 对小鼠 GLU 和 GT 的影响Table 1 Effects of compound Huangqi hypoglycemic granules on fasting blood glucose and glucose tolerance in mice
糖耐量试验需要测定0、30、60、120 min 血糖值,其中 0 min 血糖代表 GLU,30、60、120 min 3 个时间点的血糖测定值可以反映出药物对GT 的影响。曲线下面积(AUC)如表1 所示,糖耐量曲线见图1。由图1 可知,各治疗组小鼠以葡萄糖溶液(2 g/kg)灌胃后60、120 min 时的血糖值均明显低于模型组,AUC 明显降低(P <0.01),表明 FFHQ 能够有效提升GT,各治疗组作用效果相当。
2.1.2 FFHQ 对血清胰岛素、肝糖原和肌糖原含量的影响 ALX 通过对胰岛B 细胞的不可逆性损伤导致Ins分泌绝对不足,从而使得血清中胰岛素水平显著降低,血糖升高。各组小鼠血清胰岛素测定结果如表2 所示,与空白组相比,模型组小鼠血清中胰岛素含量明显降低,符合ALX型糖尿病疾病模型特征。各治疗组中,高剂量(FFHQ-H)、中剂量(FFHQ-M)组血清中胰岛素含量显著高于模型组(P <0.05),而低剂量组血清中胰岛素含量与模型组相比并未显著升高,说明FFHQ在低剂量下,并不能促进血清中胰岛素分泌。

图1 不同给药组GT 曲线Fig.1 Sugar tolerance curve of different group
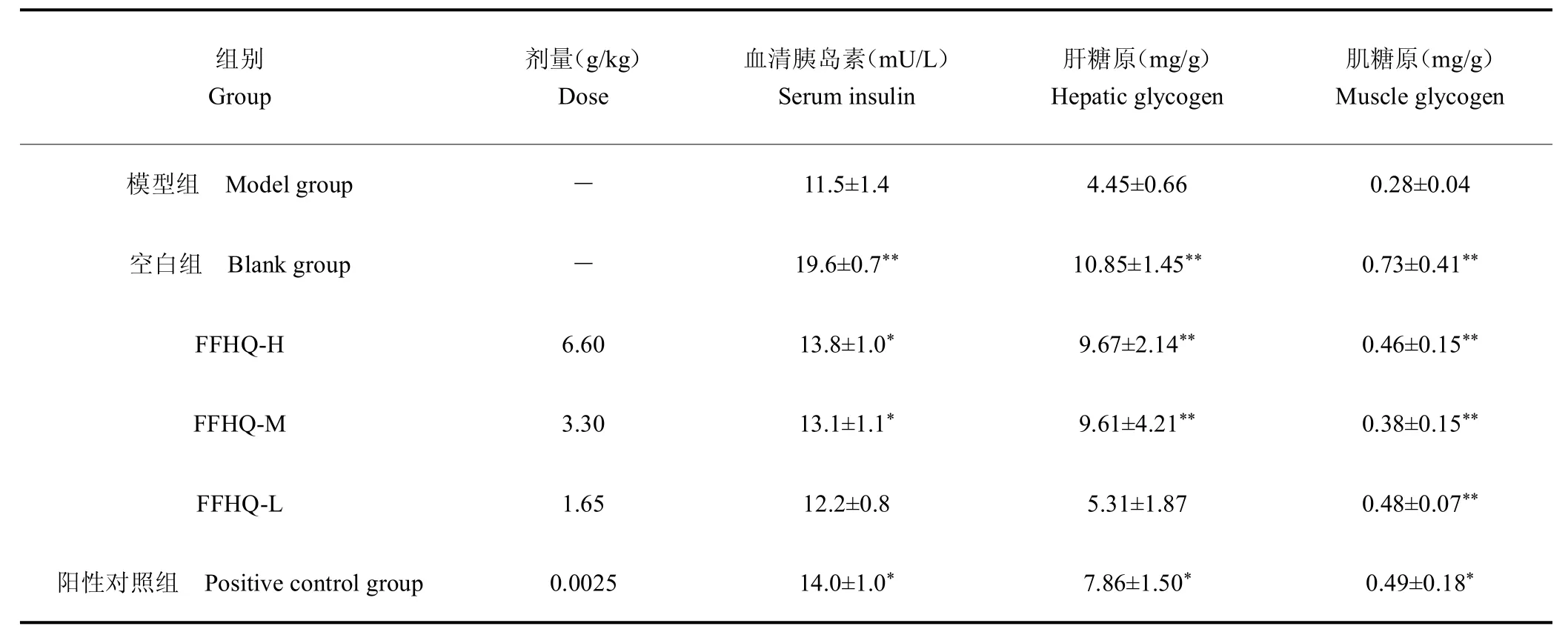
表2 FFHQ 对血清胰岛素、肝糖原和肌糖原含量的影响Table 2 Effects of compound Huangqi hypoglycemic granules on content of serum insulin,liver glycogen and muscle glycogen in mice
糖原的合成对于血糖的稳定具有重要的意义,肝糖原、肌糖原的含量可以说明FFHQ 是否经过此途径发挥降血糖的作用。各组小鼠肝糖原、肌糖原的含量测定结果如表2 所示。模型组肝脏和肌肉中的糖原含量与空白组相比显著降低;经FFHQ治疗后的高、中剂量组,阳性对照组肝糖原、肌糖原含量显著增加(P<0.01或P<0.05),而低剂量组虽略有增加但不具有统计学意义。
四氧嘧啶通过选择性破坏动物胰岛 细胞,阻断胰岛素分泌,使血糖升高,常用来建立糖尿病小鼠模型。造模成功的小鼠会出现不同程度的多饮、多食、多尿、体重减轻等症状,经过30 d 的治疗,各治疗组上述症状均有好转。试验结果表明,各治疗组均表现出良好的降血糖效果。高、中剂量组均能够显著地下调GLU、提升GT、增加肝糖原和肌糖原含量、促进胰岛素分泌。而低剂量组虽能够显著地下调GLU、提升GT,但在增加肝糖原和肌糖原含量、促进胰岛素分泌方面作用效果较弱。
2.2 HepG2胰岛素抵抗试验结果
各给药组对HepG2 胰岛素抵抗的影响如表3 所示。

表3 FFHQ 对HepG2 胰岛素抵抗的影响Table 3 Effects of compound Huangqi hypoglycemic granules on insulin resistance of HepG2
HepG2 胰岛素抵抗体外细胞试验是目前应用较广泛的研究胰岛素抵抗机制的模型,可用于筛选和研究改善胰岛素抵抗作用的药物。本试验采用MTT比色法对最终细胞的增殖情况进行了检测,测定结果见表3。由表3 可知,各试验组测定结果没有明显差异,表明各试验组虽然在诱导、给药阶段的细胞培养液成分存在差异,但细胞数目和细胞生长活力相对一致,从而保证了采用该胰岛素抵抗模型对药物进行筛选的准确性、客观性和有效性。
由HepG2 胰岛素抵抗模型试验结果可知,模型组由于胰岛素抵抗的产生,在24 h 内,对于低浓度水平胰岛素(10 9 mol/L)刺激下的葡萄糖消耗量明显低于空白组,而其他各组的葡萄糖消耗量明显增加,胰岛素抵抗状态的HepG2 细胞对葡萄糖的消耗量恢复至正常水平。表明,FFHQ具有改善胰岛素抵抗的作用。
3 结论
本研究利用四氧嘧啶诱导建立糖尿病小鼠模型和高浓度胰岛素诱导的HepG2 细胞的胰岛素抵抗模型,对复方黄芪降糖颗粒的降血糖药效及作用机制进行研究。结果表明,灌胃给药治疗(30 d)后,FFHQ 能明显降低糖尿病小鼠的GLU,改善GT,具有明显降血糖的作用;通过对其作用机制的研究,结果表明FFHQ通过提高GT、促进胰岛素分泌、增加肝糖原和肌糖原含量、改善胰岛素抵抗来发挥药效。
