人参膳食纤维的营养成分和多糖结构及热稳定性研究
2020-04-26华梅李珊珊曲迪陈建波李志满孙印石
华梅,李珊珊,曲迪,陈建波,李志满,孙印石
(中国农业科学院特产研究所,吉林 长春 130112)
膳食纤维(dietary fiber,DF),被誉为能够平衡人体营养状况的“第 7 类营养素”[1]。世界卫生组织(WHO)和联合国粮农组织(FAO)将膳食纤维定义为:在小肠内不能消化吸收,聚合度≥10 的碳水化合物聚合物,由食物中固有的可食性碳水化合物聚合物或者食品原料中以酶、物理、化学方法测得的或人工合成的碳水化合物组成[2]。根据水溶性可将其分为水溶性膳食纤维(soluble dietary fiber,SDF)和非水溶性膳食纤维(insoluble dietary fiber,IDF)两大类。SDF 是一类植物细胞内的果胶、部分半纤维素等亲水性胶体,它参与了人体的各种生理代谢活动;IDF一般包括纤维素、木质素以及部分半纤维素等成分,它在肠道内起到机械蠕动的作用,两者按照一定比例在人体肠道中共同发挥作用,促进人体健康[3]。
人参(Panax ginseng C.A.Meyer)是我国传统名贵中药材,也是药食同源的滋补佳品。2012 年,人参被认定为“新资源食品”,其功能性食品的开发也随之成为研究热点。人参药渣是人参原料的主要部分,不仅含有大量的膳食纤维、淀粉、蛋白质等营养成分,还含有未被提取到的人参皂苷、多糖和氨基酸等有益成分,作为食品原料具有极高的利用价值[4-5],其营养价值和加工性质对于功能性食品开发具有重要的研究价值。人参药渣目前普遍被作为工业垃圾处理,主要的再利用方式局限于饲料研制或对人参皂苷等微量成分的再提取[6]。人参药渣中蕴含的丰富膳食纤维亟待深入研究。
本研究参照国标GB 5009.88-2014《食品中膳食纤维的测定》方法,对人参药渣中的水溶性膳食纤维(GSDF)和非水溶性膳食纤维(G-IDF)成分进行提取,并对所得产物进行了较为系统的营养组成、结构和热稳定性研究,为人参膳食纤维在功能性食品领域中的开发应用提供理论依据。
1 材料与方法
1.1 材料与试剂
人参购自吉林省抚松县,经中国农业科学院特产研究所许世泉研究员鉴定为五加科植物人参干燥根;热稳定-淀粉酶、碱性蛋白酶、淀粉葡萄糖苷酶(Macklin公司);单糖标准品(Sigma-Aldrich公司);其他试剂均为国产分析纯。
1.2 仪器与设备
TG16-WS台式高速离心机(湖南湘仪实验仪器开发有限公司);FD-1A-50 低温冷冻干燥机(北京博医康技术有限公司);SHZ-CA 恒温水浴震荡器(常州诺基仪器有限公司);QD8J/BL 单煎机(青岛达尔电子机械销售有限公司);高效液相色谱仪、SPD-M20A 紫外检测器、LC-16 溶剂输送泵、CTO-16 柱温箱(日本岛津仪器有限公司);XL-30 ESEM FEG 扫描电子显微镜(美国 FEI 公司);VERTEX 70 FT-IR 红外光谱仪(德国Bruker Optics 公司);Pyris Diamond TGA/DTG 热重分析仪(美国PerkinElmer公司);自动检测氨基酸分析仪(日本日立公司)。
1.3 方法
1.3.1 提取工艺 酶解按照国标GB 5009.88-2014《食品中膳食纤维的测定》方法进行。
1.3.2 营养成分、糖及氨基酸的测定方法
1.3.2.1 营养成分测定方法 水分含量参考 GB 5009.3-2016《食品中水分的测定》测定;蛋白质含量参考GB 5009.5-2016《食品中蛋白质的测定》中的凯氏定氮法测定;脂肪含量参考GB 5009.6-2016《食品中脂肪的测定》中的索氏抽提法测定;淀粉含量参考GB 5009.9-2016《食品中淀粉的测定》中的方法测定;灰分含量参考GB 5009.4-2016《食品中灰分的测定》中的方法测定。
1.3.2.2 糖的测定方法 苯酚―硫酸法测定总糖含量[7];间羟基联苯法测定糖醛酸含量[8];参考Xu等[9]方法测定纤维素、半纤维素和木质素含量。
单糖组成采用PMP 衍生高效液相色谱法[10]。色谱条件:ODS Hypersil 色谱柱,250 mm 4.6 mm,粒径5m;流动相A:82%磷酸钠缓冲液(0.1 mol/L,pH 值7.0);流动相B:18%乙腈,等梯度洗脱;检测波长:245 nm;柱温:35 ℃;流速:1.0 mL/min;进样量:20L。
1.3.2.3 氨基酸的测定方法 氨基酸组成采用Mokhtar等[11]方法,使用配有4.6 mm(ID)60 mm 离子交换柱的L-8900 自动检测氨基酸分析仪进行检测。
1.3.3 理化性质
1.3.3.1 持水性 参照Mokhtar 等[11]方法,称取0.50 g样品(m0)与10 mL蒸馏水于50 mL 离心管(空管质量为m1)充分混匀,室温下密封24 h,4 000 r/min 离心15 min,弃上清,称量含样品离心管的质量(m2)。持水性按公式(1)计算:

1.3.3.2 持油性 参照Mokhtar 等[11]方法,称取0.50 g样品(m0)与20mL玉米油于50mL离心管(空管质量为m1)充分混匀,室温下密封 24h,4000r/min离心 15min,弃上清,称量含样品离心管的质量(m2)。持油性按公式(2)计算:
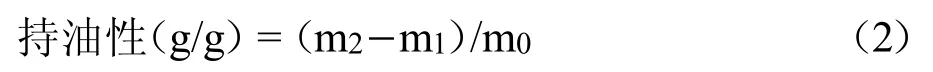
1.3.3.3 溶胀性 参照Mokhtar等[11]报道的方法,称取0.25g干燥样品(m)于10 mL量筒中,记录体积(V1),加入5 mL 蒸馏水并充分搅拌、振荡除气泡,室温静置24 h,记录吸水膨胀后样品的体积(V2)。溶胀性按公式(3)计算:

1.3.3.4 水溶性 参照刘锐雯[12]报道的方法,称取0.50 g样品(m0),加入5 mL蒸馏水中并充分搅拌,室温静置24 h,冷冻干燥后称质量(m)。水溶性按公式(4)计算:

1.3.3.5 堆积密度 参考Mokhtar 等[11]方法,称取0.50 g样品(m)于10 mL 量筒中,轻击量筒外壁至样品不再下沉,记录此时样品体积(V)。堆积密度按公式(5)计算:
1.3.4 扫描电子显微镜分析 参照Kahwa 等[13]的方法,将样品干燥至恒质量,取适量进行黏台、镀金,对样品进行不同倍数微观结构观察并拍照。
1.3.5 傅里叶红外光谱分析 参照杨夏等[14]的方法,称取样品10 mg 与KBr 粉末200 mg 于研钵中,充分混匀,研磨,制片。波数为围400~4 000 cm1,升温速度10 ℃/min,进行红外光谱扫描。
1.3.6 热重分析 参照佘志刚等[15]方法,温度为40~600 ℃,升温速度20 ℃/min,氮气保护下进行热重分析。
1.4 数据处理
每个样品设3 次平行,测定结果以平均值±标准差表示,使用SPSS 18.0 软件进行分析。
2 结果与分析
2.1 营养成分
由表1 可见,人参药渣(ginseng medicine residue,GMR)含有丰富的营养成分,蛋白质含量为14.24%,总糖含量为26.56%,总膳食纤维含量达70.01%,其中G-SDF含量达到10.24%,是理想的膳食纤维提取来源。G-SDF中的膳食纤维由水溶性糖类(51.36%),糖醛酸(18.04%)和半纤维素(9.86%)组成,该糖醛酸含量接近精制红参多糖的水平(23.9%)[16]。糖醛酸中的伯羟基可氧化成为羧基,从而使多糖表现出特殊的性质,总糖及糖醛酸含量与膳食纤维的抗氧化活性呈正相关性[11,14,17]。G-IDF是人参膳食纤维的主要成分,人参药渣中的G-IDF含量达到60.77%。G-IDF的膳食纤维中纤维素含量最高(34.26%),另外还有一定量的半纤维素(18.13%),这暗示着通过酸碱处理或者生物酶解,还能够将这部分半纤维素水解,以提高水溶性膳食纤维的含量。G-IDF 中还保留了部分糖类(15.21%)和糖醛酸(4.26%)。此外,G-SDF和G-IDF中均含较丰富的蛋白质和微量淀粉,且未检出脂肪成分,暗示其可以作为高营养低热量食品原料。
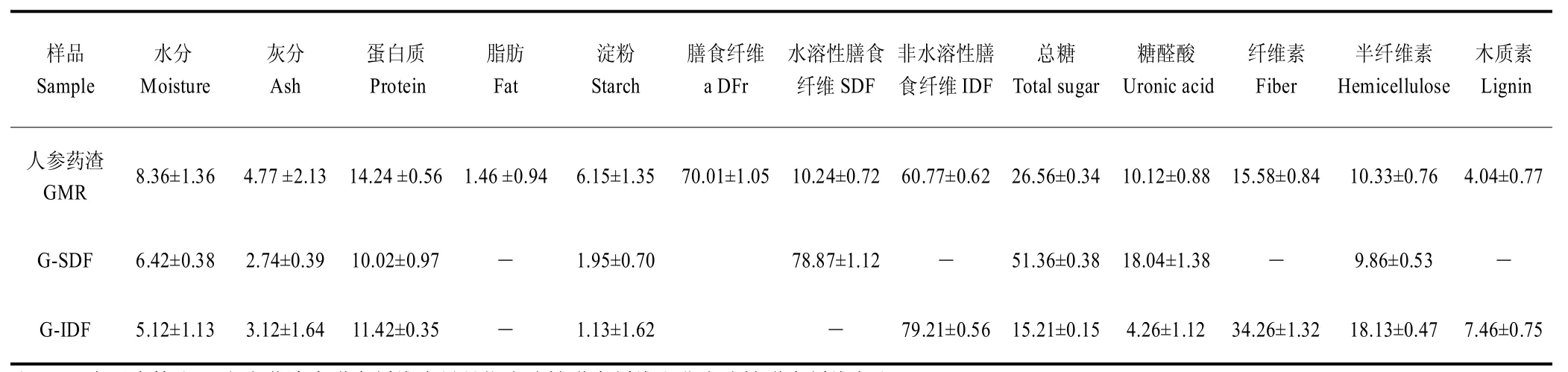
表1 人参药渣及人参膳食纤维的营养成分含量Table 1 Nutritional ingredient of ginseng medicine residue and ginseng dietary fiber (%)
由表2 可见,人参膳食纤维中含有极为丰富的氨基酸成分,其中包括9 种人体必需氨基酸和8 种非必需氨基酸,必需氨基酸占总氨基酸比例接近50%,是木瓜皮膳食纤维氨基酸含量的3 倍以上(15.68%)[3],也远高于海带不溶性膳食纤维(36.2%)[18]和酸浆果渣的氨基酸含量(30.79%)[11]。FAO/WHO 将必需氨基酸含量占总氨基酸含量40%的蛋白质定义为理想蛋白,这表明人参膳食纤维具有成为优质蛋白补充剂的潜力[19]。
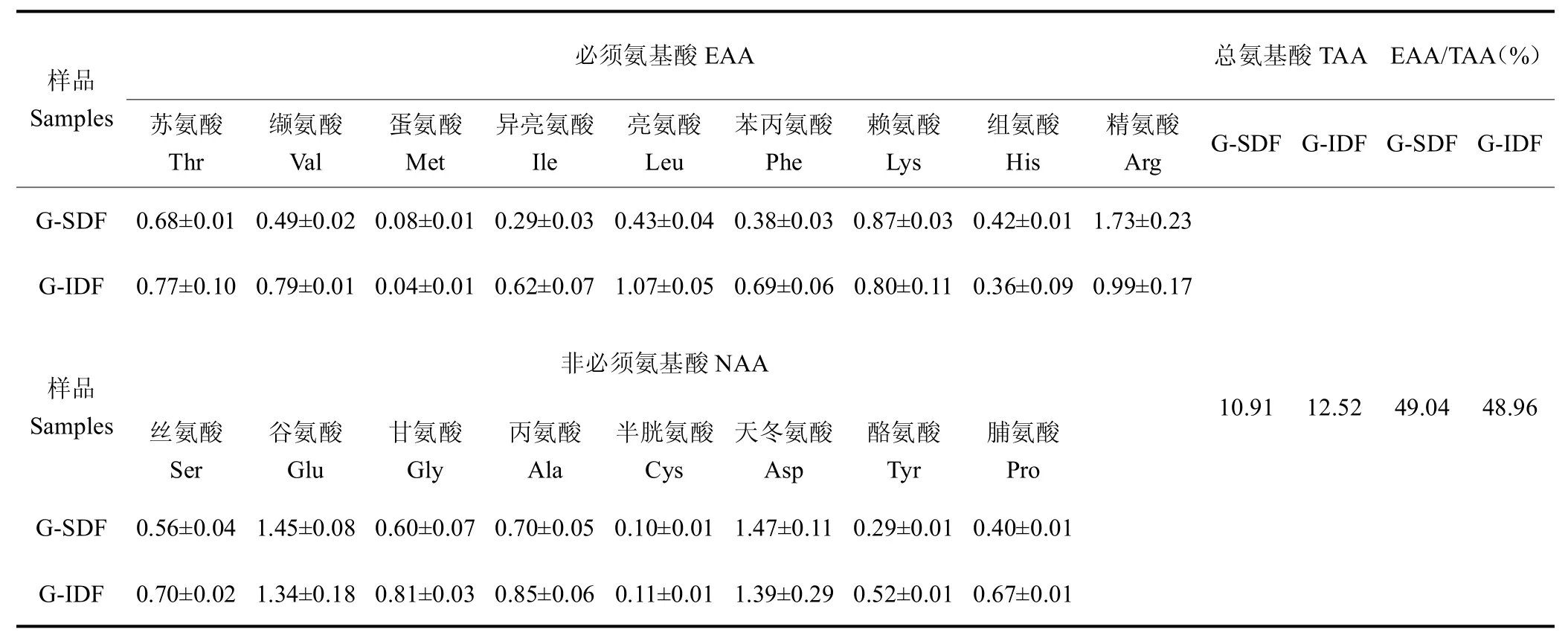
表2 人参膳食纤维提取物的氨基酸组成分析Table 2 Amino acid composition analysis of ginseng dietary fiber (g/100g)
2.2 单糖组成
由表3 可见,G-SDF 和G-IDF 的单糖组成均以中性糖为主,但具体组成不同;酸性糖则均为半乳糖醛酸(galacturonic acid,GalA)。G-SDF 中葡萄糖(glucose,Glc,54.85%)的含量超过总量的50%,表明其中可能含有大量葡聚糖结构。另外G-SDF 中还含有少量GIDF中未见的阿拉伯糖(arabinose,Ara,8.43%)和鼠李糖(rhamnose,Rha,1.20%);G-IDF中出现G-SDF中未见的木糖(xylose,Xyl,19.10%)和岩藻糖(fucose,Fuc,15.21%),这与其含有一定量的半纤维素(如木葡聚糖)有关[20]。

表3 人参膳食纤维的单糖组成Table 3 Monosaccharide composition of ginseng-SDF and ginseng-IDF (%)
2.3 理化性质
由表4 可见,人参膳食纤维具有较好的理化性质。G-SDF因具有较高的水溶性(96.21%),故未检测到溶胀性。G-SDF 具有较好的持油性(2.37 g/g),远高于米糠水溶性膳食纤维(0.99 g/g)[21]和花生壳膳食纤维(1.12/2.03 g/g)[22]。G-IDF 的持油性(7.37 g/g)明显高于 G-SDF;持水性(8.68 g/g)和溶胀性(12.14 mL/g)也远高于脱脂椰蓉膳食纤维[10]。高持水性和高持油性的膳食纤维可以应用于焙烤、肉类和油炸食品中,以提供水合保鲜作用,改善口感,增加原料粘度和高脂肪食物的稳定性[23]。

表4 人参膳食纤维的理化性质Table 4 Physicochemical properties of ginseng dietary fiber
2.4 扫描电镜分析
由图1 可见,酶解导致G-SDF 表面出现明显空洞,呈类似蜂窝状结构,其100 和10m标尺电镜图分别见图1a 和图1b,这一结构可以增加G-SDF 的比表面积,促进其对水分的吸收,增加机体饱腹感,提高GSDF 的水合作用和吸附能力[24]。G-IDF 表面呈浅层空穴结构,其100 和20m标尺电镜图分别见图1c和图1d。这一结构同样增加了G-IDF 的比表面积,同时提高了其对水、油、金属离子的吸收能力[25]。

图1 人参膳食纤维的SEM 电镜图Fig.1 SEM photographs of ginseng dietary fiber
2.5 红外光谱分析
由图2 可见,G-SDF 和G-IDF 的主要多糖基团组成基本一致。在3 413.77 和3 415.49 cm 1 处出现的大吸收峰,由羟基O-H 伸缩振动引起,表明人参膳食纤维中存在着较多的羟基及结合水分子[23]。在2933.48 和2 927.64 cm 1 处的尖锐吸收峰,由果胶和半纤维素中-CH3、= CH2等的C-H 伸缩振动引起。它们连同1 419.35 和1 422.85 cm 1 处由O-H 的明显吸收峰一同代表了典型的碳水化合物骨架结构[26];在1 200~1 800 cm1,尤其是 1 616~1 634 cm 1 处的吸收峰,如图2 中的1 628.36 和1 629.98 cm 1 处,常被认为是来自果胶和半纤维素的糖醛酸酯化和离子化羧基C=O的特征吸收峰[3]。在1 200~1 350 cm 1 的吸收峰,是多糖的特征吸收峰[23]。900~1 200 cm1的吸收峰,包括1 074.97 和1 029.79 cm 1 处的吸收峰,是由木质素C-O-C 糖环醚键的C-O 基伸缩振动和半纤维素中酰基单元 CO-OR 的伸缩振动引起的[27]。619.59 和623.37 cm 1 处的吸收峰被认为是碳水化合物的指纹骨架结构[26]。G-SDF 和 G-IDF 在 1 740 cm 1 附近均没有酯化羧基引起的吸收峰,表明其含有的果胶为低甲氧基果胶,这种果胶可在较低糖浓度甚至无糖条件下形成优质凝胶,制成低热量食品以满足肥胖和糖尿病人群的需要[23,28]。以上结果表明G-SDF 和G-IDF 适合应用到低糖、低热量、高营养、高纤维的加工食品中。
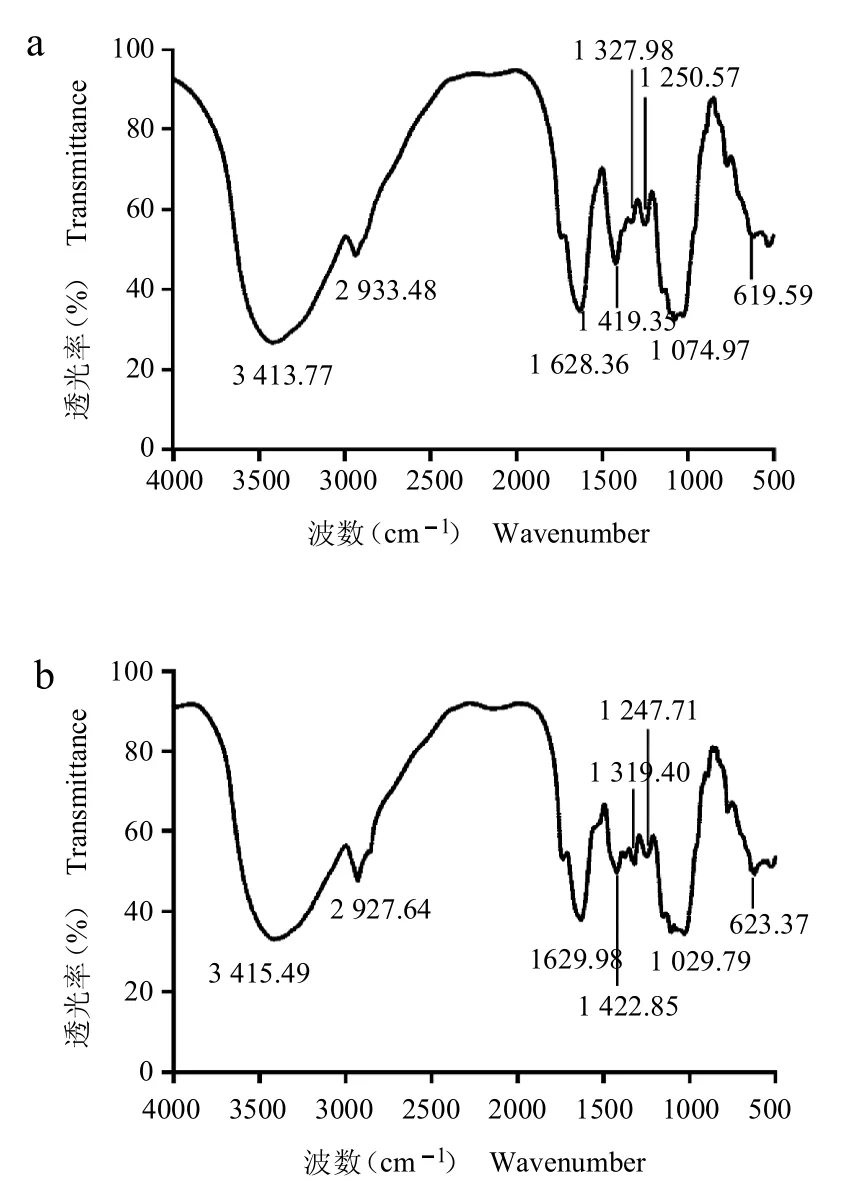
图2 G-SDF(a)和 G-IDF(b)人参膳食纤维的傅里叶红外光谱检测Fig.2 FT-IR spectrum of G-SDF(a)and G-IDF(b)ginseng dietary fiber
2.6 热稳定性分析
如图3 所示,G-SDF 和G-IDF 的热解过程大致可分为3 个质量变化阶段:①初始温度-200 ℃,样品表面结合水脱水阶段。这一阶段质量损失为10%~20%,在171 ℃出现分别为3.890%/min 和3.396%/min 的最大失重速率,这部分损失重量与样品水合性质呈正相关性[23]。②200~300 ℃,样品受热分解阶段。这一阶段中样品质量损失最多,约为30%。在274 ℃出现分别为7.593%/min和6.527%/min的最大失重速率。这一阶段的明显失重可归因于G-SDF 和G-IDF 中果胶和可溶性半纤维素的受热分解,也可认为是G-IDF 中纤维素成分的预碳化过程[3]。③300~600 ℃,样品受热分解碳化阶段。这一阶段质量损失在20%左右,最高温度600 ℃下样品剩余质量均在30%以上。在325 和336 ℃分别出现5.845%/min和7.093%/min的最大失重速率。G-SDF 在此时进入燃烧阶段,质量物质主要为碳和灰分。G-IDF 在该阶段中的明显失重可以归因为其纤维素和木质素成分的碳化过程[3]。这些成分因含有致密有序的骨架结构(如纤维素),故受热分解缓慢。因此观察到的曲线下降趋势明显减缓,表现出一定的热稳定性。比较而言,G-SDF 的热解主要发生在200~300 ℃阶段,是多糖类物质的常见热解温度[29];而G-IDF 的热解贯穿了200~600 ℃,这与其含有热解温度广、热解抗性高的木质素有关[30]。G-SDF和G-IDF的热重曲线与鲍鱼多糖和石榴皮渣膳食纤维热重曲线相近,都是一个分解吸热的过程,可概况为3 个热解阶段:表面失水阶段、热分解阶段和热稳定阶段[15,23]。在200℃之前,G-SDF 和G-IDF 失重较少,能保持较好的热稳定性,表明人参膳食纤维适合应用在200 ℃以下的食品热加工中。
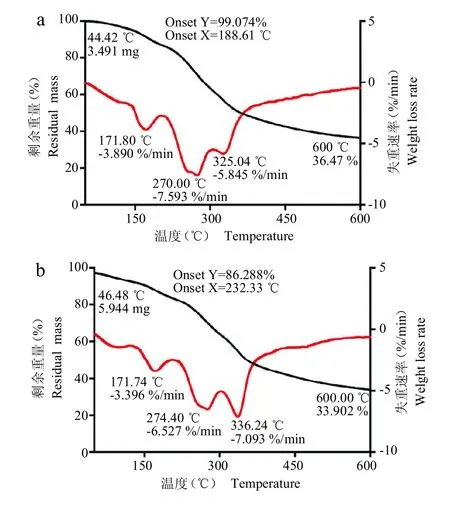
图3 G-SDF(a)和 G-IDF(b)人参膳食纤维的热重曲线Fig.3 Thermogravimetric curves of G-SDF(a)and G-IDF(b)ginseng dietary fiber
3 结论与讨论
本研究利用人参药渣成功制备了人参水溶性膳食纤维(G-SDF)和非水溶性膳食纤维(G-IDF)。人参药渣中总膳食纤维含量达70%,G-SDF含量在10%左右,G-IDF 含量达60%。G-SDF 和G-IDF 中均含有丰富的营养成分,包括糖类、糖醛酸、蛋白质、多种单糖和微量淀粉,可以作为高营养低热量的食品原料。此外,GSDF 和G-IDF 中还含有丰富的人体必需氨基酸,具有成为优质蛋白补充剂的潜力。G-SDF 和G-IDF 具有较好的持水性和持油性等理化性质,具有典型的碳水化合物热解特征,能够耐受200 ℃以下的热加工处理。G-SDF 和G-IDF 还具有典型的疏松孔洞结构,利于对水分和油脂等物质的吸附;具有特征性多糖官能基团,这些官能团与其多糖和纤维素等组成性质相符,是其具有理想理化性质的结构基础。以上研究结果揭示了人参膳食纤维的营养价值、多糖结构和热加工稳定性,为其成为功能性食品原料提供了必要的理论依据。
由于人参等药食同源中药材在食品、保健品和农林日化产品等领域的广泛应用,伴随产生的药渣利用问题成为人们关注的焦点。在当前大力倡导绿色发展的背景下,对人参药渣的新用途和新价值进行深度挖掘,对于提高资源产品的价值和产业化效益、延伸和拓展人参食药两用资源产业链同样具有深远意义。
