光照强度·温度·湿度和二氧化碳对人参光合速率的影响
2020-04-26张正海张亚玉雷慧霞邵财吴晨钱佳奇
张正海,张亚玉,雷慧霞,邵财,吴晨,钱佳奇
(中国农业科学院特产研究所,吉林 长春 130112)
人参为五加科植物,被称为“百草之王”,在我国的栽培历史距今约有1 700 年,于1842 年由俄国学者C.A.迈耶尔(Meyer)正式定名为 PanaxginsengC.A.Mey.[1]。作为典型的阴生药用植物,对其光环境的研究主要集中于20 世纪80、90 年代,以指导园参栽培为目的,围绕可见光区的光照强度和光质特征展开,以光环境静态调查及光照强度日动态、光质颜色对人参生理影响为主要研究内容[2]。研究认为30%透光率阴棚下人参叶片光合作用速率呈单峰曲线型变化,上午叶片净光合速率较高[3],整个生育期光合速率有2 个高峰,绿果期净光合速率最高[4],同时,绿果期的叶片光合速率对温度变化敏感,适宜温度为15~28 ℃[5],为保证测量数据的准确性,本研究选择生长在透光率30%条件下的绿果期人参为研究对象,测量时间在温度适宜的晴天上午进行,通过分别控制光合仪叶室的光照强度、温度、湿度和二氧化碳浓度变化,测定大田环境下绿果期人参叶片的光合速率,获得人参生长的饱和光照强度、适宜温度、湿度和二氧化碳浓度,并以饱和光照强度、适宜温度、湿度和二氧化碳浓度为测定条件对人参不同叶位叶片光合速率进行比较。叶片的光合作用是影响人参产量的主要因素,但开放环境中生长的人参容易受到大气环境、致病真菌、不均匀光照以及棚下高温的影响,同时为防止致病真菌造成叶片早衰而大量使用的农药又导致农药残留,这些因素严重影响人参的质量,进行温室栽培成为解决这种复杂问题的可能选项[6],但目前关于温室栽培人参的报道较少,本文通过研究大田人参对环境因子的反应特性,为温室栽培人参环境因子控制和栽培管理提供参考。
1 材料与方法
1.1 试验材料
试验地点在中国农业科学院特产研究所药用植物栽培试验园(126°05′E,44°03′N),选取大小一致的3 年生无病虫害人参种苗,于2019 年5 月初斜栽在高25cm、宽140 cm 南北走向参床上,覆土6 cm,铺稻草保湿,用无色单透膜搭拱形棚,棚高150 cm,黑色遮阴网遮阴,遮阴度 70%,于 7 月中旬晴天 09:00-12:00,选长势一致的绿果期人参进行测量,测量仪器为德国WALZ 公司生产的GFS-3000光合仪,测量时棚下平均温度约28℃。
1.2 试验方法
白光源由蓝(400~500 nm)、绿(500~600 nm)和红(600~700 nm)3 种LED 组成,蓝光:绿光:红光比列为4∶10∶11,气体流速为750mol/s,气体混匀器风扇速度7 级,叶室面积为3 cm2。控制参数分别为光合有效辐射〔PAR,mol(/m2s)〕、叶室温度(Tcuv,℃)、叶室相对湿度(RH,%)和叶室二氧化碳浓度(CO2abs,mol/mol);光响应曲线测定过程中PAR梯度为0、10、30、60、150、210、280、360、450、550mol(/m2s),在每个光照强度梯度下等待15 min,所有测量过程中叶室下方光照强度为0;湿度、温度和二氧化碳响应曲线测定过程中的光照强度均为280mol(/m2s)的饱和光照强度;温度响应曲线测定过程中叶室温度梯度为20、23、26、29、32、35、38 ℃;湿度响应曲线测定过程中叶室温度为28℃,RH 梯度为0、10%、20%、30%、40%、50%、60%、70%、80%、90%,在每个湿度梯度下等待30min;二氧化碳响应曲线测定过程中二氧化碳浓度梯度为0、100、300、500、700、900、1 100、1 300、1 500mol/mol,每设定一个二氧化碳浓度必须进行一次分析器调零和气路调零,否则会由于基线漂移造成光合速率无限增加而测不到饱和点。测量指标为光合速率〔Amol(/m2s)〕、蒸腾速率〔E,mmol(/m2s)〕、水汽压亏缺(VPD,Pa/kPa)、气孔导度〔GH2O,mmol(/m2s)〕和胞间二氧化碳浓度(Ci,ppm),每个处理 3 个重复。
以饱和光照强度、温度、湿度和二氧化碳浓度为测量条件,随机选取棚内6 株人参,每株选取3 枚掌状复叶,测定每枚掌状复叶的中央小叶、单侧中间小叶和近叶轴小叶的光合速率,分别将3 枚掌状复叶的中央小叶、中间小叶和近叶轴小叶的平均值作为各叶位的测定值。
1.3 数据分析
试验数据用Excel 2016 进行初步整理,用SAS 6.0进行差异显著性和相关性分析,单因素方差分析采用最小显著差异法(LSD)分析,双方面方差分析采用Duncan's 新复极差法,相关性分析用Pearson 系数双边检验。
2 结果与分析
2.1 光照强度对光合速率的影响
在只控制PAR 的情况下,绿果期人参PAR 补偿点在4~10mol(/m2s),光合速率随PAR 增加而快速增加,在PAR 大于280mol(/m2s)时光合速率差异不显著,达到饱和状态(图1)。由表1 可知,光合速率与光照强度、蒸腾速率、水汽压亏缺极显著正相关,与相对湿度和胞间二氧化碳浓度极显著负相关,与温度和气孔导度正相关但相关性不显著。这说明在饱和PAR 和自然温度条件下,光合速率达到饱和后的限制因素是非气孔性的。
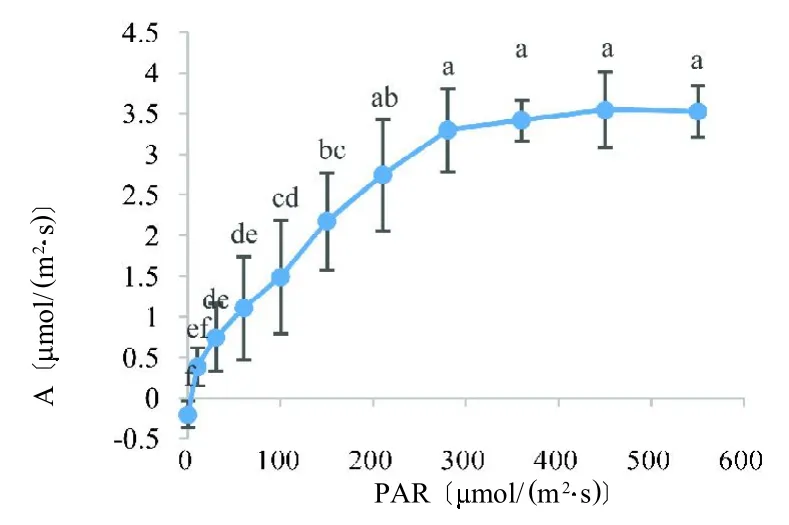
图1 温度对光合速率的影响Fig.1 Effect of light intensity on photosyntheticrate

表1 不同光照强度下光合参数相关性分析Table 1 Correlation analysis of photosynthetic parameters under different light intensities
2.2 温度对光合速率的影响
在饱和PAR条件下,光合速率随着温度变化分为3 个阶段(图2),在20~26 ℃时光合速率随着温度升高而显著升高,在26~29℃时光合速率差异不显著,但显著高于其他温度处理,在29~38 ℃时光合速率随着温度升高而显著降低。由表2 和表3 可知,在20~29 ℃时光合速率与温度显著正相关,与蒸腾速率和水汽压亏缺不显著正相关,与相对湿度、气孔导度和胞间二氧化碳浓度不显著负相关;在29~38 ℃时光合速率与温度显著负相关,与水汽压亏缺和胞间二氧化碳浓度不显著负相关,与气孔导度显著正相关,与相对湿度和蒸腾速率不显著正相关。这说明在饱和光照条件下,20~29 ℃时光合速率变化主要受温度影响,在29~38 ℃时光合速率变化除受温度影响外还受气孔导度的影响,可能是高温导致气孔关闭影响气体交互进而影响光合作用。
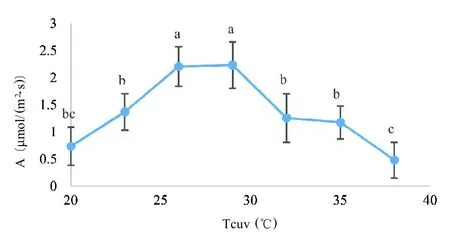
图2 温度对光合速率的影响Fig.2 Effect of temperature on photosynthetic rate

表2 20~29 ℃时光合参数相关性分析Table 2 Correlation analysis of photosynthetic parameters in the range of 20-29 ℃
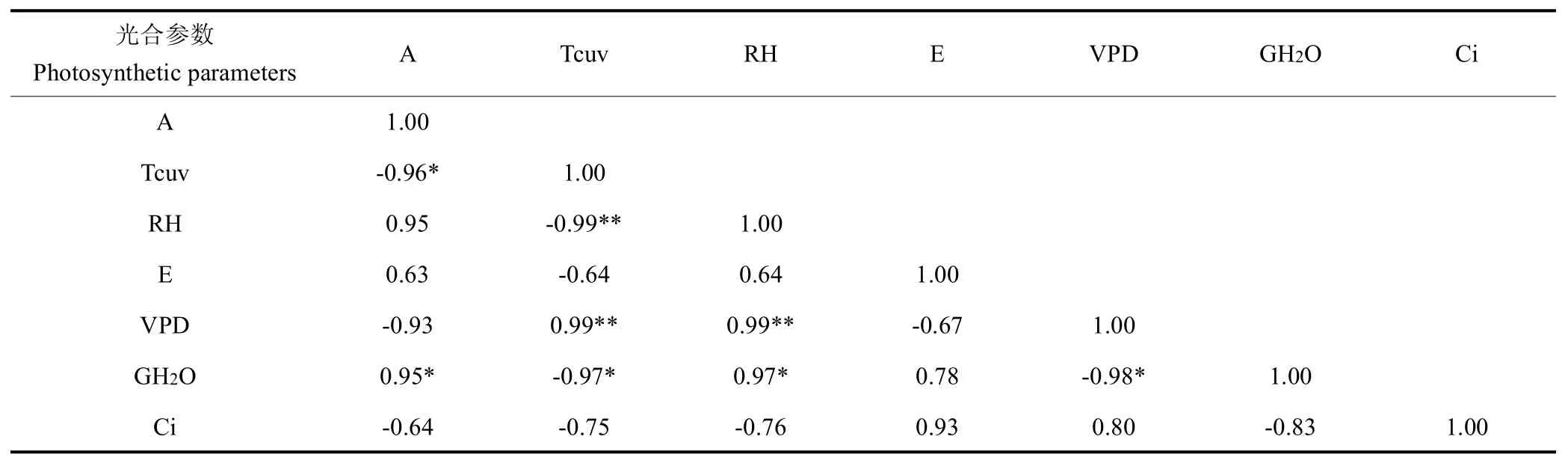
表3 29~38 ℃时光合参数相关性分析Table 3 Correlation analysis of photosynthetic parameters in the range of 29-38 ℃
2.3 相对湿度对光合速率的影响
在饱和PAR和恒定温度条件下,光合速率随相对湿度增加而缓慢增加,在相对湿度大于40%时光合速率差异不显著,相对湿度50%时达到最大值(图3)。由表4 可知,光合速率与相对湿度极显著正相关,与蒸腾速率、水汽压亏缺和胞间二氧化碳浓度极显著负相关,与气孔导度负相关但差异不显著,这说明在饱和PAR和恒定温度条件下,空气湿度通过影响水汽压亏缺和蒸腾速率进一步影响气体交换从而影响光合速率。
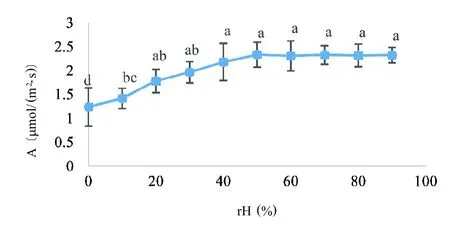
图3 相对湿度对光合速率的影响Fig.3 Effect of relative humidity on photosynthetic rate
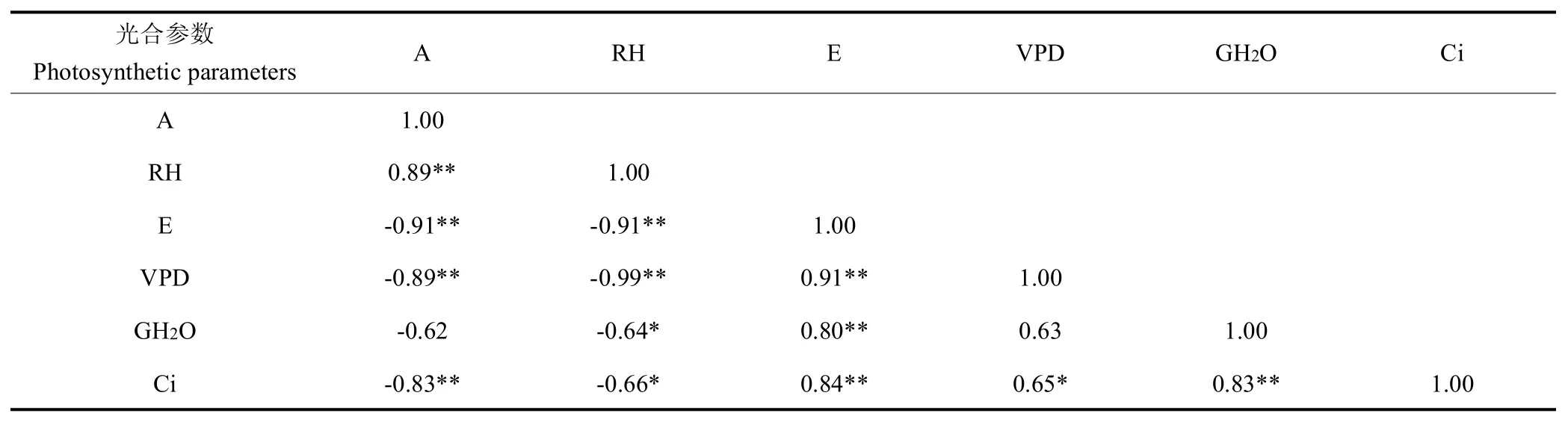
表4 不同湿度下光合参数相关性分析Table 4 Correlation analysis of photosynthetic parameters under different humidities
2.4 二氧化碳对光合速率的影响
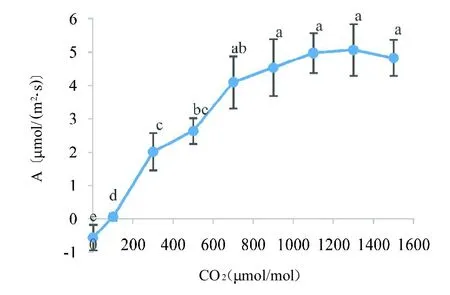
图4 二氧化碳浓度对光合速率的影响Fig.4 Effect of carbon dioxide concentration on photosynthetic rate
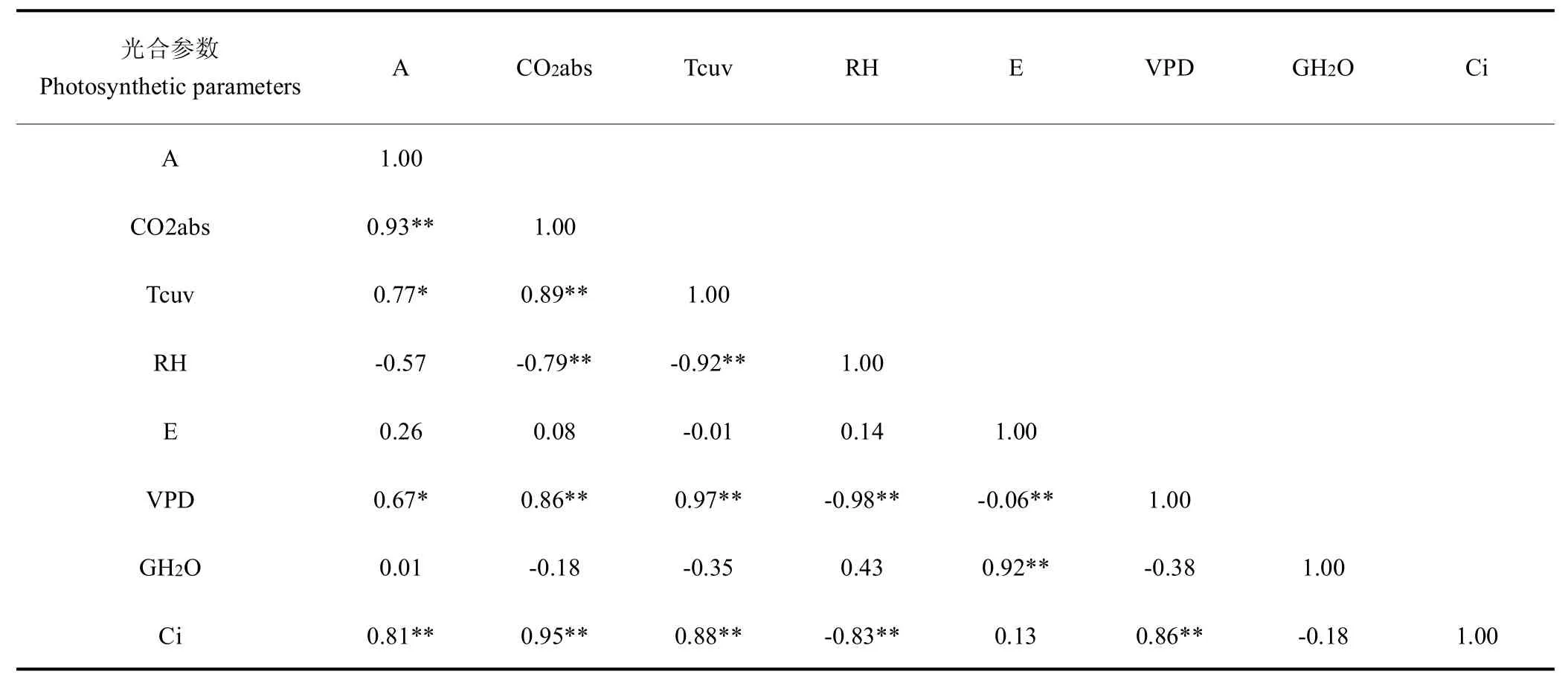
表5 不同二氧化碳浓度下光合参数相关性分析Table 5 Correlation analysis of photosynthetic parameters under different carbon dioxide concentrations
2.5 叶位间光合速率比较
在饱和PAR、温度、湿度和二氧化碳条件下,植株间光合速率存在显著差异,植株内叶位间无显著差异,但中间小叶光合速率略高(表6)。在理想的光合条件下,由于个体对光合环境的适应性不同而表现出差异,但同一植株由于轮生复叶生长状态相同,各叶位间光合速率无显著差异。
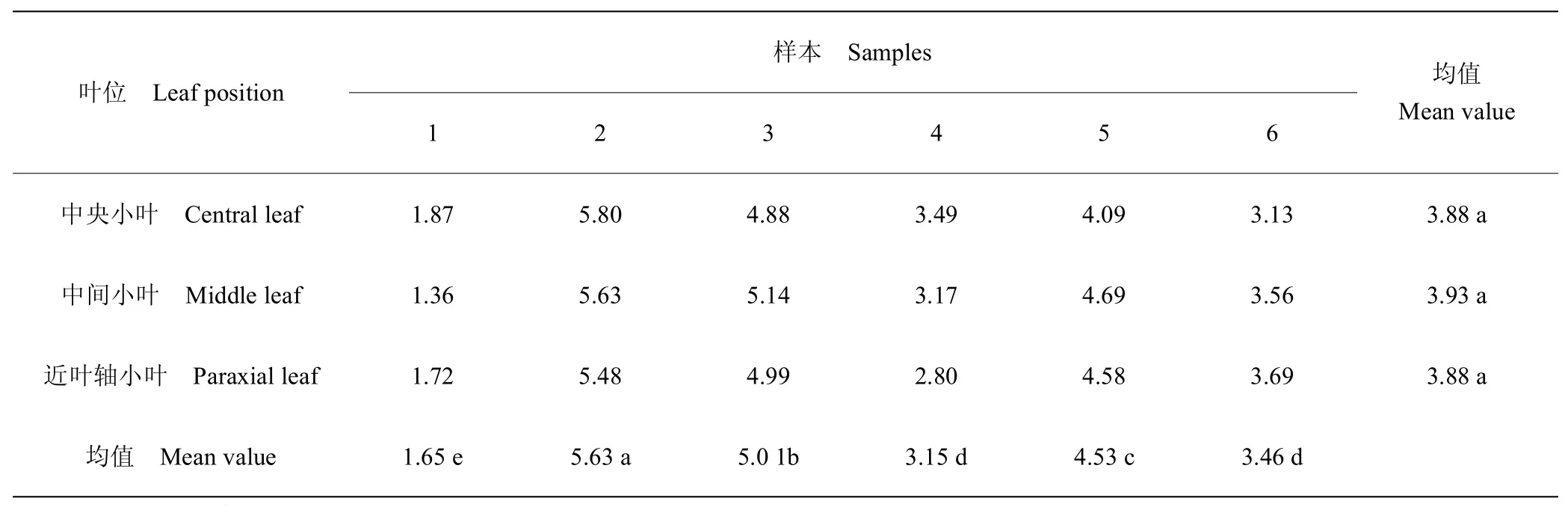
表6 植株和叶位间光合速率比较Table 6 Comparison of photosynthetic rate between plants and leaves
3 讨论
本研究在单独控光条件下测得绿果期人参 PAR补偿点在4~10mol(/m2s),饱和点在280mol(/m2s),比已报道的林下参光补偿点4~6mol(/m2s)和光饱和点150mol(/m2s)高[7]。研究表明,生长在75、150和300mol(/m2s)光照条件下盆栽人参,其中生长在高光照条件下的人参具有较高光补偿点〔13mo(l/m2s)〕、光饱和点〔330mol(/m2s)〕和光合速率〔3.3mol(/m2s)〕[8],这可能是大田高光照环境下人参光饱和点有所提高,说明通过适当提高光照强度能增加人参光合速率。
在自然条件下,环境温度主要来源于太阳光辐射,光与温度对人参光合作用存在交互作用[9]。本研究在饱和PAR条件下,光合速率随着叶室温度升高呈先升后降趋势,最适光合温度在26~29 ℃,高于已报道的温度20~25 ℃[10]。徐克章等[8]研究表明,在低温条件下生长的叶片,其光合作用的最适温度偏低;在高温条件下生长的叶片,其光合作用的最适温度偏高。这可能是园参其最适光合温度偏高的原因,在栽培过程中可以通过调节环境温度使光合速率维持在较高的水平。
在饱和PAR 和恒定28 ℃条件下,人参光合速率随空气相对湿度增加而增加,当空气相对湿度达到40%后光合速率差异不显著。非控光控温条件下空气相对湿度对人参光合速率的分时段研究表明,人参光合速率在13:00~14:00 与空气相对湿度(20%~30%)变化趋势一致,其他时间段空气相对湿度变化不决定净光合速率变化趋势,认为温度高导致空气相对湿度低,会在一定程度上影响光合作用效率[11],因此根据环境温度,适当提高空气相对湿度有利于人参光合作用。
在饱和PAR 和单独控制叶室二氧化碳浓度条件下,测得人参二氧化碳补偿点接近100mol/mol,与已报道3 年生绿果期人参二氧化碳补偿点92.5mol/mol接近[12],二氧化碳补偿点受叶片生理年龄、水分、光照和温度的影响,叶片衰老、受干旱胁迫或温度升高时二氧化碳补偿点升高[13];本研究测定大田环境下二氧化碳饱和点在900mol/mol,二氧化碳浓度大于900mol/mol后光合速率增加不显著,但远高于饱和光照强度、相对湿度、适宜温度条件下测得的光合速率,由于光合速率与气孔导度相关性不显著,这可能是高浓度胞间二氧化碳显著提高RuBP羧化酶活性的原因,因此,适当提高环境二氧化碳浓度是提高人参光合潜力的有效措施。
人参是阴生植物,通过轮状分布复叶,使每个小叶片尽量水平伸展而不相互遮挡,既降低了对风雨的阻力又获得了最大截光面积,同时,人参还通过让所有叶片光合速率一致而使复叶成为一个整体,使光能利用率达到最大化,这是人参对弱光环境长期适应的结果,人参叶片过少或者过多都不利于人参生长和有效成分积累[14-15],因此,生产中既要防止病虫害对人参叶片的伤害,同时也要合理密植来达到最大光能利用率。
在温室条件下,可以根据环境光照条件动态调节温室透光率,延长适宜光照强度的时间,同时调节温度、湿度和补充空气二氧化碳浓度来提高人参光合速率,根据人参年龄调节栽培密度,提高群体有效光合面积来提高产量,本研究以大田栽培人参为试验材料,但大田环境和温室环境有差异,人参生长状态也不同,因此需要进一步在温室条件下对环境因子进行优化。
