2018年福建省永安及南平监测点致泻性大肠埃希菌流行及耐药情况
2020-04-25郑恩惠林杰柯自立谢芳钦徐海滨
郑恩惠 ,林杰 ,柯自立 ,谢芳钦 ,徐海滨
(1.福建省疾病预防控制中心,福建 福州 350001;2.福建省人兽共患病研究重点实验室,福建 福州 350001)
致泻性大肠埃希菌(iarrheagenic E coli,DEC)是引发感染性腹泻常见的的肠道致病菌,根据其所携带的毒力因子、致病机制及流行病学特征等通常分为5类:肠致病性大肠埃希菌(EPEC)、肠产毒性大肠埃希菌(ETEC)、肠出血性大肠埃希菌(EHE C)、肠侵袭性大肠埃希菌(EIEC)和肠聚集性大肠埃希菌(EAEC)[1]。
DEC引发的腹泻病是全世界范围内备受关注的一个公共卫生问题,特别是在发展中国家,DEC是引起婴幼儿腹泻的一种主要致病菌[2],在临床诊断难以鉴别,并且容易获得耐药基因。所以,能快速检出DEC,并指导临床经验性用药具有重要意义。为此我省开展对致泻大肠埃希菌的病原学监测,以掌握其流行情况及耐药性特征。
1 材料与方法
1.1 菌株 2018年从福建省南平市延平区和福建省永安市两个监测哨点分离的初步鉴定为大肠埃希菌的菌株共300株。参考菌株:EAEC、O157:H7 EDL933、EIEC、EPEC、ETEC、 ATCC 25922 为本实验室保存的菌种。
1.2 试剂和仪器 五种致泻大肠埃希菌多重荧光PCR检测试剂盒 (深圳市生科原技术有限公司)。rTaq DNA,聚合酶dNTPs购自大连宝生物工程有限公司,琼脂糖为BioAsia进口分装品,PCR扩增仪为 G-Storm(英国 Gene Technologies公司),实时荧光定量PCR仪为CorbettRotor-Gene6000,凝胶成像分析系统为Molecular Imager Gel Doc XR System(美国Bio-Rad公司),电泳仪为北京六一仪器厂生产的DYY-6C型。
1.3 方法
1.3.1 模板制备 将分离的菌株在普通营养琼脂上37℃,培养18h~24h,刮取接种环一满环的菌量于100μl灭菌双蒸水中混匀,煮沸 10min~15min,离心,取上清直接用于PCR扩增。
1.3.2 PCR操作方法 提取可疑菌落的DNA,运用多重实时荧光PCR进行初筛,筛查出阳性基因的标本挑取单克隆进行单重PCR方法进行确认。五种致泻大肠杆菌的相关检测基因有:EAEC的aggR,pic和 astA基因、ETEC的 elstb和 elt基因、EPEC的 escV和 bfp、EHEC的 stx基因、EIEC的ipaH和virA基因[3,4]。多重荧光及单重PCR的反应体系及扩增程序严格按照试剂盒操作说明书进行。单重PCR引物及扩增条件参见文献[4]。
1.3.3 药敏试验 采用北京天坛的的15种抗生素纸片,包括阿米卡星(AK)、氨苄西林 (AMP)、氨苄西林/舒巴坦(AMS)、头孢唑啉(CFZ)、头孢吡肟(CEF)、头孢哌酮(CFP)、头孢噻肟(CTX)、头孢西丁(FOX)、头孢他啶(CAZ)、头孢曲松(CRO)、环丙沙星(CP)、庆大霉素(GEN)、美罗培南(MER)、哌拉西林/他唑巴坦(TZP)、复方新诺明(SXT)。结果判定根据 CLSI指南(2018版)标准解释,按CLSI推荐的ESBLs纸片筛选法和酶抑制剂增强纸片确证法标准测定大肠埃希菌中的产ESBLs株。
2 结果
2.1 致泻性大肠埃希菌(DEC)检测结果
2.1.1 DEC分离 从300例腹泻粪便标本中通过多重荧光PCR方法筛查出致泻大肠杆菌毒力基因阳性标本28例,这28例标本经过单重PCR方法分离出致泻性大肠杆菌20株。
2.1.2 DEC分型结果 2018年5-11月共收到腹泻粪便标本300份,分离出20株致泻性大肠杆菌,检出率为6.67%株,其中7株aggr基因阳性,4株astA基因阳性,1株pic阳性,判定为EAEC;4株escV基因阳性,判定为aEPEC;3株estlb基因阳性,1株elt基因阳性,判定为ETEC;未分离出EHEC和EI EC,见表 1。
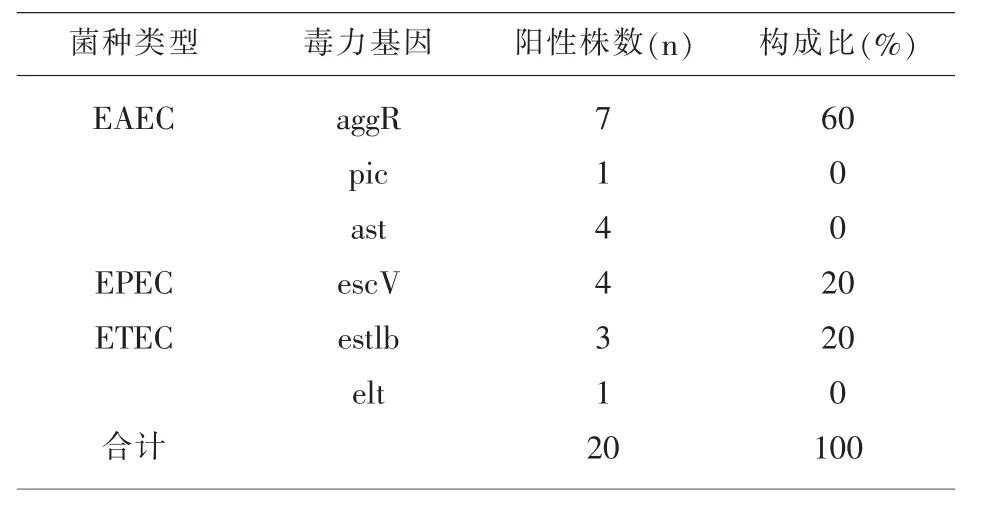
表1 2018年福建省监测点DEC毒力基因分布情况
2.1.3 DEC的感染特征 6-9月为检出高峰,共分离出19株;致泻性大肠杆菌在5岁以下儿童和60岁以上老人中检出率较高,两个年龄组内均分离出7株。
2.1.4 药敏试验 对20株分离株进行了15种常见抗菌药物敏感性检测。其中氨苄西林的耐药率相对较高,为 55%;其次是头孢唑啉,耐药率为 40%;头孢噻肟、头孢曲松、复方新诺明耐药率均为 30%,其余测试的抗菌药物敏感性较高。见表2。
2.1.5 产ESBLs菌株 判定为ESBLs表型的大肠埃希氏菌共有6株,耐药率为30%(6/20),均为EA EC。对氨苄西林、头孢唑啉、头孢哌酮、头孢噻肟、头孢曲松的耐药率均高达100%,对复方新诺明的耐药率为50%。
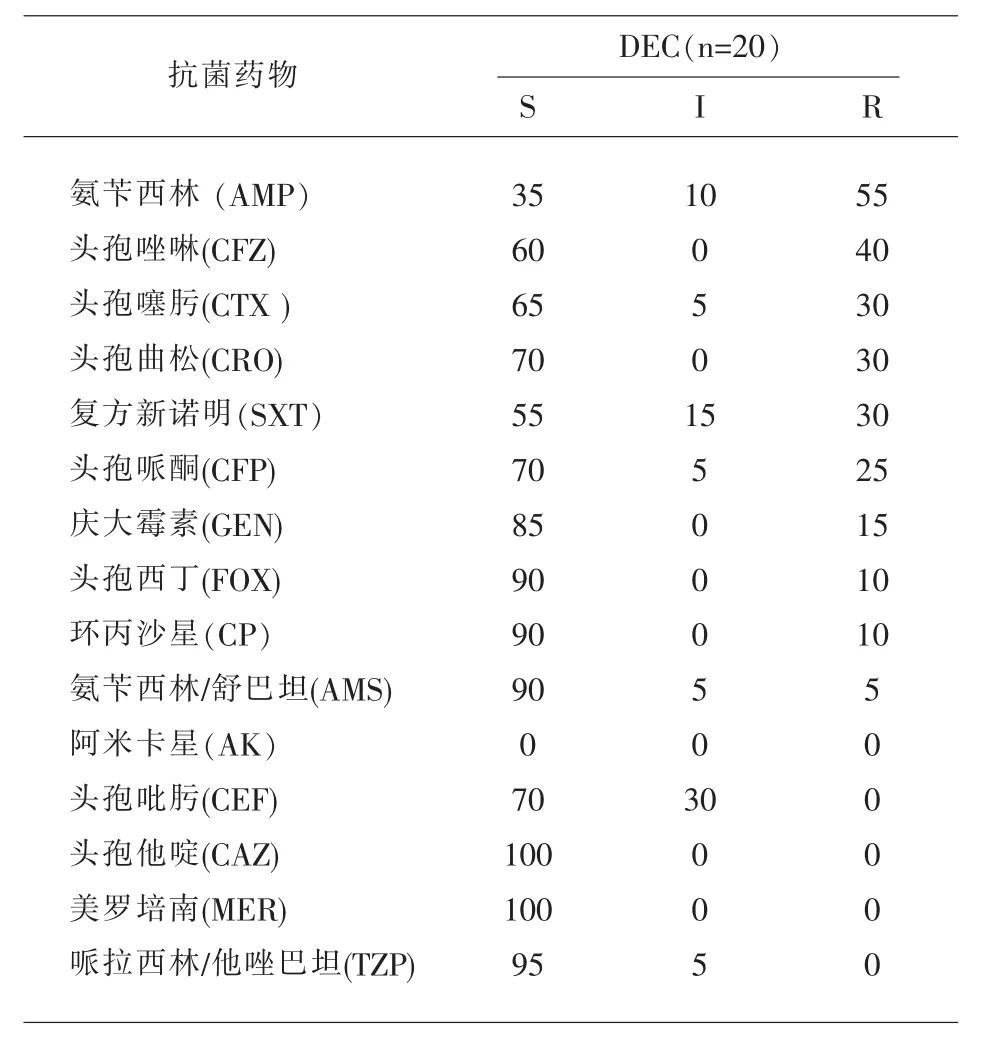
表2 20株DEC对15种抗菌药物的药敏结果(%)
3 讨论
传统大肠埃希菌的检测与鉴定方法需通过一系列繁复的增菌,生化,血清鉴定等过程,且不能区分出是否为DEC。福建省近年来建立起多重普通PCR和多重实时荧光PCR方法来进行DEC毒力基因的初筛,胡安妥[5]建立多重实时荧光检测方法检测5种致泻性大肠埃希氏菌,一次性鉴别出多种致泻性大肠,PCR后无需再进行凝胶电泳,操作简单、高特异性、低漏检率使其在微生物检测和分子分型诊断上有重要的地位和应用前景[6]。
2018年从福建省两个监测哨点中分离出20株单克隆阳性菌株,检出率为6.67%,与近年来我省DEC检出率相持平[7,8],张彦春等对北京顺义区201 3-2016年腹泻病例中DEC的检测,分离率为7.91%,以ETEC为主[9];刘文娟对山东烟台市2014-20 17年腹泻病患者中致泻性大肠埃希菌的检测,检出率9.32%,以EAEC为主[10]。我省近年来以 EAEC为优势种群,其次是 aEPEC,其中原因与EAEC的检出率相关。有文献报道astA毒力基因可在细菌间转移,不仅存在于 EAEC菌中,也存在于EPEC、ETEC等其他致病性大肠埃希氏菌中,当与其他毒力基因同时检出,astA基因不作为型别判定依据[11,12],也有同行[13]认为仅检出astA基因时可判定为EAE C。虽然astA的判定仍存在争议,在本次实验中,根据购买的PCR试剂盒使用说明书,将仅astA毒力阳性菌株暂时判定为EAEC,在本文中相较于aggR,pic,astA基因均阳性的典型EAEC,把仅astA阳性归为非典型的EAEC,有利于进一步检测其他相关基因。过去采用普通PCR分离出ast基因条带位置与引物二聚体的位置十分接近而被误判漏检,现采用荧光PCR对ast基因直接判定,提高EAEC的检出率。总检出率相对其他某些省份偏低,可能原因是监测哨点样本采集大多来自医院和卫生院,病人就诊前已服用药物。另外与当地经济,环境卫生条件、饮食习惯相关。
本文研究数据显示,DEC具有明显的季节性流行特征,6-9月份为检出高峰,5岁以下儿童和60岁以上老人为DEC的易感人群,与肠道腹泻病传染的流行规律相吻合。DEC在5岁以下儿童急性肠道感染的病原中占有重要地位。主要引起肠炎、出血性结肠炎和溶血性尿毒症综合征等[12],故应加强对易感人群的预防工作,做好相关疾病防控。
药敏结果显示DEC对青霉素类、磺胺类及三代头孢菌素类等药物均表现出较强的耐药率,对碳青霉烯类、氨基糖苷类药物敏感。与往年福建省数据相比较耐药模式差别不大,但多重耐药菌明显增多[14]。产ESBLs大肠埃希菌是由质粒介导,使耐药基因在细菌之间传递造成耐药菌株的流行[15],随着广谱抗菌药物广泛应用,致泻性大肠杆菌的多重耐药现象日趋严重,在临床上要加大重视,加强病原学与耐药的监测,为临床合理用药提供依据,减少耐药菌的产生与播散。
