外泌体miRNA-21对非小细胞肺癌风险预测价值的研究
2020-04-25何鑫荣昊任伟宏李延卿李文博冯倩冯慧洁刘朝阳
何鑫 ,荣昊 ,任伟宏 ,李延卿 ,李文博 ,冯倩 ,冯慧洁 ,刘朝阳
(1.郑州大学第五附属医院检验科,河南 郑州 450000;2.河南中医药大学第一附属医院检验科,河南 郑州 450000;3.河南中医药大学,河南 郑州 450000)
肺癌是全球癌症相关死亡的主要原因,严重危害人类公共卫生健康[1]。尽管当今社会诊断技术日益进步、新型药物不断研发,但肺癌的总体生存率仍然不尽人意[2,3]。2012年全球肺癌死亡人数高达1.59亿,占所有癌症死亡人数的19.4%。非小细胞肺癌(non small cell lung cancer,NSCLC)是肺癌的主要类型,占肺癌总发病率的85%。迄今为止,绝大多数NSCLC患者在初诊时就已经处于中晚期,而现有的治疗往往只是暂时控制症状,5年生存率仅为15.9%[4]。然而,如果NSCLC患者能够做到早发现、早治疗,其生存质量以及生存周期都会得到显著改善,因此,基于外周血的生物诊断标志物正在变得越来越有前景。
外泌体是一种直径范围在30~100nm之间的极微小的纳米级囊泡结构。在体内,外泌体存在于大多数体液中,包括脑脊液、母乳、血液、尿液、唾液、羊水和胸腹水积液。在外周血中,外泌体浓度约为3×106/μl。外泌体从多种细胞中排出,包括红细胞、血小板、淋巴细胞、树突细胞和癌细胞,但癌细胞具有高度活跃的生物学活性,因此其外泌体分泌量远超其它正常细胞。某些研究已经证明外泌体可以与受体细胞细胞膜融合,从而将外泌体内容物插入受体细胞。在外泌体的分泌过程中,母体细胞的类型和生理病理状态决定了外泌体的组成和结构[5]。外泌体是多种生物分子的载体,包括蛋白质、肽、脂质、DNA、mRNA和microRNA。尤其重要的是,mRNA和microRNA等基因材料作为外泌体内容物可被翻译并调节受体或靶细胞中的基因表达[6]。现研究表明,microRNA通过调节基因表达的转录过程在许多慢性疾病以及癌症的发病机制中起着关键作用[7]。人体内的循环microRNA之所以可以在外周血中稳定存在,是因为被微泡、外泌体等囊泡包裹,或者与蛋白质结合形成复合物,免于受到血液中核糖核酸酶(Rnase)的降解以及温度、酸碱度等不利因素的干扰[8-10]。正是因为NSCLC患者外周血中含有大量肺癌细胞来源的外泌体,本研究通过检测外泌体中的特异性microRNA来对NSCLC进行早期预测。
EGFR基因是ERBB家族中的一员,对细胞的生长、增殖和分化等生理过程发挥重要作用[11]。如果EGFR基因过表达或者发生突变,将导致信号传导通路的异常,进一步导致胞核DNA过度复制和细胞过度分裂,最终引起细胞恶化,形成肿瘤[12]。EGFR基因突变不仅导致NSCLC的发生,且影响整个病程的进展,具有促进肿瘤生长、分化、浸染的作用。在所有NSCLC患者中,组织EGFR基因突变与外周血EGFR基因突变一致率为70~80%,这与肿瘤细胞在组织中的分布以及取样位置有很大关系,而来源于坏死肿瘤细胞的ctDNA会不可避免地进入人体外周血,因此可以很好地反映整个病灶的完整信息[13]。本研究将就外周血EGFR基因突变是否具有预测NSCLC风险的能力做出评估。
目前临床上应用最为广泛的具有肿瘤监测能力的血清学标志物是肿瘤标志物,其中,与NSCLC相关的是癌胚抗原(CEA)、鳞细胞癌抗原(SCCA)和细胞角蛋白19片段(CYFRA21-1)[14]。CEA由内胚层分化而来,是细胞膜的结构蛋白,形成于胞浆,并通过细胞膜释放入血液。CEA是一种非特异性血清肿瘤标志物,在许多实体瘤中表达异常,在肿瘤的诊断和疗效评估中具有重要参考价值[15]。SCCA是一种来自于鳞状上皮细胞的糖蛋白,主要用于诊断鳞状上皮细胞癌[16]。CYFRA21-1是一种细胞角蛋白,存在于上皮细胞和来自这些细胞的恶性肿瘤细胞,是常用的NSCLC诊断标志物[17]。CEA、SCCA、CYFRA21-1是当下诊断NSCLC敏感度、特异度相对较好的血清学标志物,本文即通过ROC曲线来对比研究CEA、SCCA、CYFRA21-1及其三项联合在NSCLC诊断中的效能。
1 资料与方法
1.1 一般资料 2017年6月至11月,于河南省肿瘤医院呼吸肿瘤内科收集30例确诊为NSCLC患者的EDTA-K2抗凝血液标本;对照组中的30例EDTA-K2抗凝血液标本均来源于河南中医药大学第一附属医院体检中心体检正常人员。
1.2 仪器与试剂 ABI7500实时荧光定量PCR分析仪,微滴式数字PCR仪,Luminex流式细胞点阵仪,超净工作台,低温高速离心机;外泌体提取试剂盒 PureExo Exosome Isolation Kit(P101),外泌体RNA提取试剂盒SeraMir Exosome RNA Amplification(140710-002),逆转录试剂盒 miRcute Plus miRNA First-Strand cDNA Syntesis Kit(KR211-02),荧光PCR扩增试剂盒miRcute Plus miRNA qP CR Detection Kit(SYBR Green),人 EGFR 基因T79 0M突变检测试剂盒,CEA定量测定试剂盒,SCCA定量测定试剂盒,CYFRA21-1定量测定试剂盒。
1.3 方法
1.3.1 分离血清外泌体 取每例受试者血清样本400μl,共计60例,按照外泌体提取试剂盒说明书提取血清外泌体;将分离出的外泌体重悬于PBS溶液中,置于4℃冰箱以备下一步操作。
1.3.2 Western Blot检测外泌体膜蛋白 取上步得到的外泌体悬液,经总蛋白提取、转膜、封闭、抗体孵育、显影等步骤,验证所提取外泌体的膜蛋白。
1.3.3 提取外泌体RNA 按照外泌体RNA提取试剂盒seraMir Exosome RNA Amplification说明书要求提取血清外泌体中RNA;每例样本应当获得30~40μl外泌体RNA;每份外泌体RNA中加入1L外参。
1.3.4 逆转录miRNA-21取出逆转录试剂盒,解冻 2×miRNA RT Reaction Buffer并混匀,miRNA RT Enzyme Mix放于冰盒上备用;按照说明书要求逆转录miRNA-21。
1.3.5 扩增miRNA-21待试剂盒室温融化后置于冰盒上,按照说明书配制反应体系,体系配制完成后将所有PCR反应管上机扩增。扩增所涉及的引物序列见表1。
1.3.6 PCR结果分析 分析PCR结果时,miRNA-21与外参阈值线均取0.01,阈值线与每条扩增曲线的交点所对应的横坐标即为相应的Ct值。基因水平采用2-ΔΔCt法计算,ΔΔCt=(实验组CtmiRNA-21-实验组Ct外参)-(对照组 CtmiRNA-21-对照组Ct外参)。
1.3.7 EGFR突变基因检测 取出DNA提取试剂盒TIANamp FFPE DNA Kit提取血清中EGFR基因,以此作为PCR反应模板进行扩增。扩增完成后将反应完成的体系置于微滴读取仪中读取结果。
1.3.8 血清肿瘤标志物 CEA、SCCA、CYFRA21-1检测 将CEA、SCCA、CYFRA21-1检测试剂盒和Lminex机器准备好,室温下融化血清,混匀后立即离心;分别在96孔反应板上依次加入:A液25μl/孔,样本或校准品 10μl/孔,B 液 25μl/孔;加样完成后按照说明书要求在37℃恒温箱中避光温浴,然后加入C液25μl;最后把96孔板置于多功能流式细胞点阵仪读取结果。
1.4 统计学处理 采用SPSS22.0统计学软件进行统计学分析,外泌体miRNA-21、肿瘤标志物数据结果以(x±s)表示,因实验结果均不符合正态分布,两组间计量资料比较采用秩和检验,多组间计量资料比较用KW检验,行受试者工作特征(ROC)曲线对诊断效能进行分析。
2 结果
2.1 Western Blot对外泌体膜蛋白的检测 外泌体表面最具有特异性的膜蛋白是CD63和CD81,根据本次实验结果显示,所提取外泌体含有表面蛋白CD63和CD81,如图1所示。

图1 外泌体富含CD63和CD81
2.2 miRNA-21在NSCLC组与正常人组中的表达水平 PCR扩增结果如图2、3所示。采用秩和检验分析可知,NSCLC组血清外泌体miRNA-21较正常人组表达明显上调,上调倍数为3.06倍,差异具有统计学意义(P<0.05),见表 2。
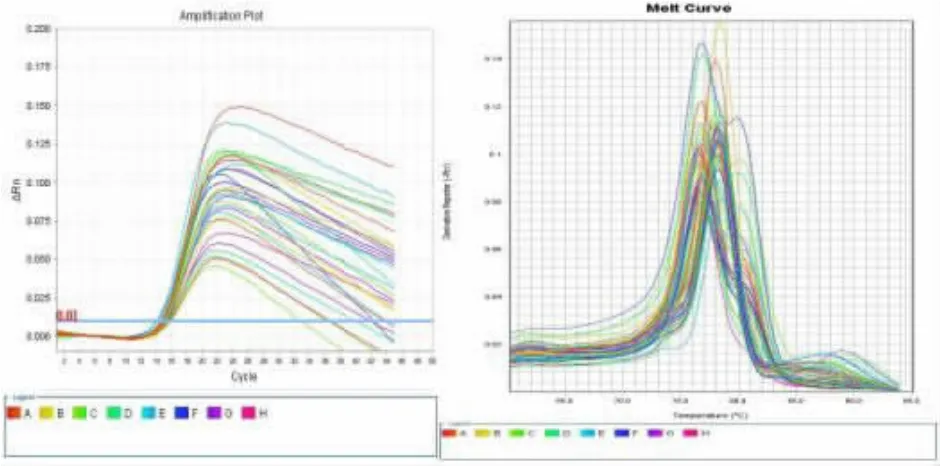
图2 NSCLC组外泌体miRNA-21扩增曲线(左)和溶解曲线(右)
2.3 外泌体miRNA-21对NSCLC的诊断价值分析对外泌体miRNA-21表达水平进一步行ROC曲线分析,结果表明外泌体miRNA-21预测NSCLC风险价值高,曲线下面积为 87.6%(P<0.05),95%置信区间为0.784~0.968。当miRNA-21表达水平为54.71时,可得出最佳敏感度(80%)和特异性(86.7%)。 见图 4。

图3 正常人组外泌体miRNA-21扩增曲线(左)和溶解曲线(右)

表2 NSCLC组与正常人组外泌体miRNA-21对比分析

图4 外泌体miRNA-21预测NSCLC风险的ROC曲线
2.4 肺癌驱动基因EGFR突变检测结果 30例NSCLC患者中EGFR基因突变共13例,其中,18号外显子突变2例,19号外显子突变6例,20号外显子突变1例,21号外显子突变3例,19、20号外显子联合突变1例,总突变率为43.3%;30例正常人中则没有发生EGFR基因突变,见表3、表4。
2.5 肺癌相关肿瘤标志物CEA、SCCA、CYFRA21-1检测结果 见表5。
2.6 CEA、SCCA、CYFRA21-1对 NSCLC 的风险预测分析 CEA曲线下面积为52.1%,SCCA曲线下面积为65.0%,CYFR A21-1曲线下面积为60.9%,三项联合曲线下面积为77.3%,95%置信区间为0.655~0.891。 可知 CEA、SCCA 或 CYFRA21-1单项在预测NSCLC风险方面并不可靠,但是如果三项联合诊断,可明显提升诊断效能。见图5。

表3 NSCLC患者EGFR基因突变结果

表4 正常人EGFR基因突变结果

表5 NSCLC组与正常人组血清CEA、SCCA、CYFRA21-1

图 5 血清 CEA、SCCA、CYFRA21-1 及三项联合预测NSCLC风险的ROC曲线
3 讨论
外泌体被认为是普遍存在于人体各种体液,包括母乳、唾液、血清、羊水、恶性腹水和尿液等多种液体中均含有大量可分离的外泌体[18]。外泌体可以作为诊断和治疗工具应用于临床。细胞在正常和病态条件下均分泌外泌体。外泌体携带包含供体细胞病理信息的各种核酸和蛋白质,这些核酸和蛋白质被认为是具有实验和临床诊断价值的生物标志物。在本项研究中,NSCLC患者组血清外泌体miRNA-21表达水平为119.6498.35,显著高于正常人组的39.1034.12,证明血清外泌体miRNA-21是NSCLC患病的高危预测因素,这与NSCLC肿瘤组织或肿瘤细胞中的结果一致[9,10]。实验结果充分表明外泌体作为液体活检技术的生物学意义,以及miRNA-21在NSCLC发病机制中发挥着巨大作用。我们推测,其机制可能是miRNA-21抑制细胞的分化并诱导细胞向肿瘤细胞转化,最终导致癌症的发生。肺癌细胞源性外泌体通过刺激细胞增殖、血管生成、细胞外基质重塑、转移和免疫监视逃逸来促进肿瘤进展,并通过转移致癌生物分子如miR NA-21作为其内容物来影响受体细胞。在进入靶细胞后,这些肿瘤来源的内容物有助于在受体细胞中发展癌症表型,引起受体细胞恶变[19]。
近年来,EGFR突变基因检测在肺部肿瘤相关疾病中进行得如火如荼。EGFR基因位点发生突变,会刺激细胞发生恶变,开始无休止的增殖,最终导致癌症的发生[20,21]。相比较于其他癌症,EGFR在NSCLC患者中突变率尤其高,因此,本项研究对30例NSCLC患者和30例正常人外周血EGFR基因突变情况进行检测。结果表明,在30例NSCLC患者中,EGFR基因总突变率为43.3%,而在正常人中,没有发现EGFR基因突变。因此我们可以得出结论,用EGFR基因突变作为NSCLC的风险预测指标具有极好的特异性,但在随机选取的30例NSCLC患者中,有56.7%的患者不存在EGFR基因突变,因此用EGFR基因突变作为NSCLC的风险预测指标存在极大的漏诊率,仅可以作为参考指标。
肿瘤标志物是当今用于肿瘤检测的最为广泛且相对有效的血清学标志物,其中与NSCLC最具相关性的是CEA、SCCA、CYFRA21-1。本研究对CEA、SCCA、CYFRA21-1在NSCLC风险预测中的价值行ROC曲线分析,结果显示,CEA、SCCA、CYF RA21-1的曲线下面积分别为:52.1%、65.0%和60.9%,均不可作为NSCLC的预测指标。三者联合起来,作为一个联合诊断指标,再次行ROC曲线预测NSCLC风险,曲线下面积显著提升至77.3%,从理论上讲可以作为NSCLC的诊断指标,但是由于在临床上实际操作起来需要复杂的运算、缺乏统一标准的诊断界点,且诊断效能明显低于外泌体miRNA-21,所以仍不推荐使用。
外泌体miRNA-21具有较高的NSCLC风险预测价值,而EGFR基因突变、肺癌相关肿瘤标志物的NSCLC风险预测价值相对较低
