大米蛋白质酰胺Ⅲ带三级红外光谱研究
2020-04-24武玉洁王丽欣封卓帆辛畅肖霄于宏伟
武玉洁,王丽欣,封卓帆,辛畅,肖霄,于宏伟
(1.河北一品制药股份有限公司,河北 石家庄,052165;2.石家庄学院 化工学院,河北 石家庄,050035)
大米中含碳水化合物、蛋白质、脂肪,及丰富的B族维生素等,是我国南方大部分地区人民的主要食品[1-4]。大米富含蛋白质,而蛋白质的营养价值在很大程度和其结构有关。IR光谱是物质定性的重要方法之一。它的解析能够提供许多关于官能团的信息。其定性分析有特征性高、分析时间短、不破坏试样、测定方便等优点[5-8]。蛋白质在酰胺Ⅰ带具有较强的红外吸收峰[9-10],但由于酰胺Ⅰ带和水分子的部分IR吸收峰重叠,因此影响了传统的IR光谱在蛋白质结构的深入研究。而水分子在蛋白质酰胺Ⅲ带吸收频率附近没有吸收峰,因此可采用IR光谱法测定大米酰胺Ⅲ带研究蛋白质的结构[11]。由于蛋白质的酰胺Ⅲ带的对应的官能团IR吸收强度不高,并不能提供有价值的光谱信息。2D-IR光谱是一项较为先进的IR光谱技术[12-13],本文采用2D-IR光谱,结合传统的IR光谱及TD-IR光谱进一步开展食品(包括:玉米,小麦及食用酵母)蛋白质酰胺Ⅲ带IR光谱研究工作[14-16],研究了温度变化对大米蛋白质二级结构及热稳定的影响,为大米的存贮及鉴别研究提供参考。
1 材料与方法
1.1 材料、仪器及操作方法
大米(产地:辽宁省盘锦市,石家庄市长安区北国超市谈固店售);傅里叶红外光谱仪(Spectrum 100型,美国PE公司);ATR-FTIR附件(Golden Gate型,英国Specac公司);ATR-FTIR变温控件(WEST 6100+型,英国Specac公司)。
1.2 红外光谱数据获得及图形处理
大米IR光谱实验以空气为背景,每次对于信号进行8次扫描累加;大米TD-IR光谱测温范围293~393 K(变温步长10 K)。大米IR光谱和TD-IR光谱数据采用Spectrum v 6.3.5软件,大米2D-IR光谱数据获得采用TD Versin 4.2软件。
2 结果与分析
2.1 大米IR光谱研究
大米的一维IR光谱如图1A所示。由图1A可知,3 283 cm-1频率处对应的吸收峰是大米OH伸缩振动模式(νOH-one-dimensional-rice),2 925 cm-1频率处对应的吸收峰是大米CH2不对称伸缩振动模式(νasCH2-one-dimensional-rice),2 855 cm-1频率处对应的吸收峰是大米CH2对称伸缩振动模式(νsCH2-one-dimensional-rice),1 745cm-1频率处对应的吸收峰是大米油脂C=O伸缩振动模式(νC=O-one-dimensional-rice),1 539 cm-1频率处对应的吸收峰是大米蛋白质酰胺Ⅱ带模式(νamide-Ⅱ-one-dimensional-rice), 而 1 240 cm-1频率处对应的吸收峰是大米蛋白质酰胺Ⅲ带模式(νamide-Ⅲ-one-dimensional-rice)。大米的二阶导数IR光谱如图1B所示。由图1B可知,其谱图分辨能力有了一定 的 提 高 , 其 中 1 660 cm-1(νamide-Ⅰ-1-secondderivative-rice)和 1 649 cm-1(νamide-Ⅰ-2-second derivative-rice)频率处对应的吸收峰是大米蛋白质酰胺Ⅰ带模式(νamide-Ⅰ-second derivative-rice), 而大米νamide-Ⅱ-rice 对应吸收频率包括:1 548 cm-1(νamide-Ⅱ-1-second derivative-rice)、1 515 cm-1(νamide-Ⅱ-2-second derivative-rice), 相关 IR 光谱数据见表1。
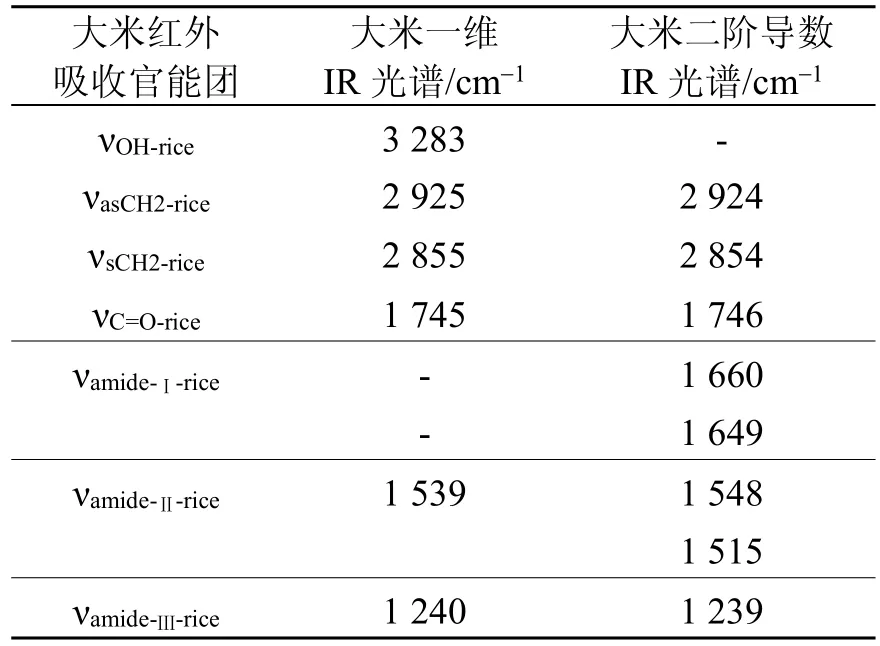
表1 大米的IR光谱数据(303 K)
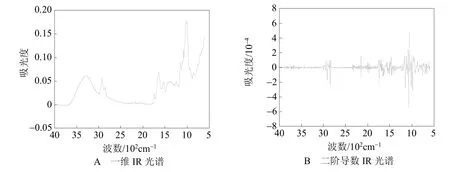
图1 大米IR光谱(303 K)
2.2 大米蛋白质酰胺Ⅲ带νamide-Ⅲ-rice的TD-IR光谱研究
首先开展了大米蛋白质酰胺Ⅲ带νamide-Ⅲ-one-dimensional-rice的一维TD-IR光谱研究(图2A)。由图2A可知,随着测定温度的升高,大米νamide-Ⅲ-one-dimensiona-rice对应的吸收频率出现了红移,而相应的吸收强度明显降低。进一步开展了大米蛋白质酰胺Ⅲ带νamide-Ⅲ-second derivative-rice 的 二 阶导数TD-IR光谱研究(图2B),其光谱信息比较复杂。由图2B可知,在303~393K的 加 热 过 程 中 , 大 米 νamide-Ⅲ-secondderivative-rice出现了新的红外吸收峰,相关TD-IR光谱信息见表2。大米蛋白质酰胺Ⅲ带νamide-Ⅲ-rice的TD-IR光谱实验则进一步证明,大米的蛋白质二级结构对于温度变化比较敏感,而随着测定温度的升高,大米的蛋白质微观结构发生改变。
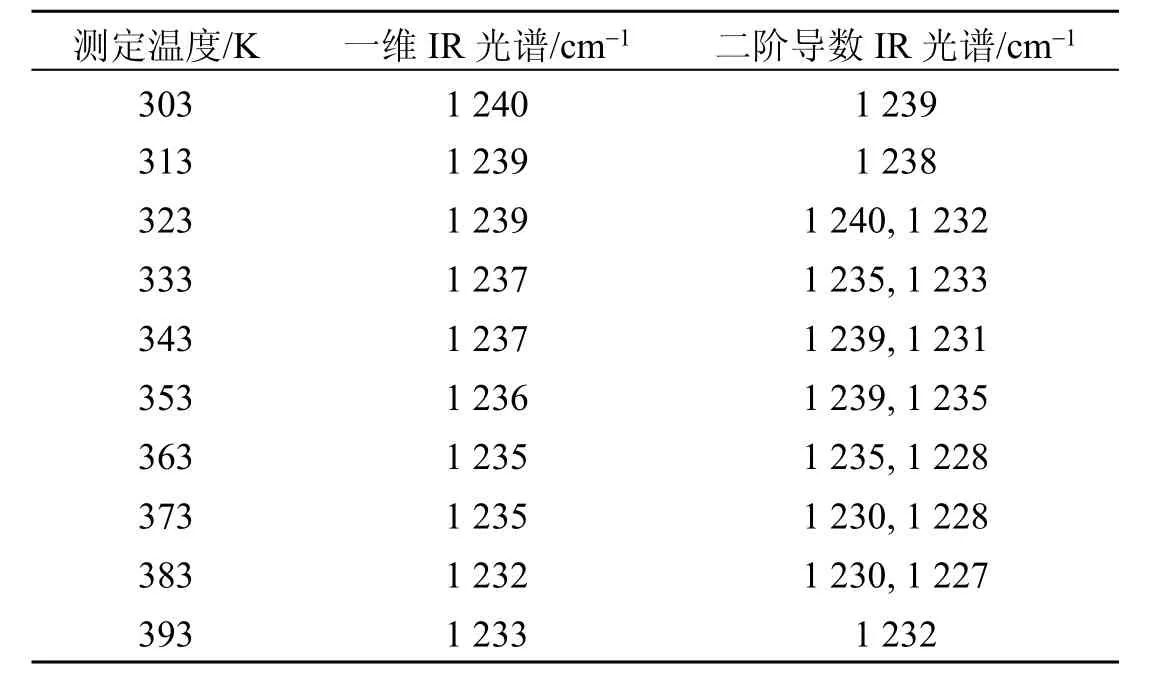
表2 大米蛋白质酰胺Ⅲ带νamide-Ⅲ-rice的TD-IR光谱数据(303~393 K)

图2 大米蛋白质酰胺Ⅲ带νamide-Ⅲ-riceTD-IR光谱(303~393 K)
2.3 大米蛋白质酰胺Ⅲ带νamide-Ⅲ-rice的2D-IR光谱研究
2.3.1 同步2D-IR光谱研究
在1 200~1 330 cm-1频率范围内,首先开展了大米蛋白质酰胺Ⅲ带νamide-Ⅲ-rice的同步2D-IR光谱研究(图3),其谱图分辨能力要优于相应的一维及二阶导数IR光谱。首先在(1 214 cm-1,1 214 cm-1)、(1 270 cm-1,1 270 cm-1)、(1 289 cm-1,1 289 cm-1)和(1 306 cm-1,1 306 cm-1)频率处发现了4个相对强度较大的自动峰。1 214 cm-1频率处的吸收峰归属于大米蛋白质二级结构中的β-折叠结构[14-16],1 270 cm-1频率处的吸收峰归属于大米蛋白质二级结构中的无规卷曲结构,1 289 cm-1频率处的吸收峰归属于大米蛋白质二级结构中的β-转角结构,而1 306 cm-1频率处的吸收峰归属于大米蛋白质二级结构中的α-螺旋结构。大米νamide-Ⅲ-rice同步二维红外光谱自动峰数据则证明:大米蛋白质二级结构中的β-折叠结构(1 214 cm-1)、无规卷曲结构(1 270 cm-1)、β-转角结构(1 289 cm-1)和α-螺旋结构(1 306 cm-1)对应的官能团对于温度变化比较敏感。此外在(1 214 cm-1,1 306 cm-1)和(1 270 cm-1,1 289 cm-1)频率处发现二个相对强度较大的交叉峰,则进一步证明大米蛋白质二级结构中,β-折叠结构(1 214 cm-1)和α-螺旋结构(1 306 cm-1)之间存在着较强的分子内相互作用,此外大米蛋白质二级结构中无规卷曲结构(1 270 cm-1)和β-转角结构(1 289 cm-1)之间存也在着较强的分子内相互作用。
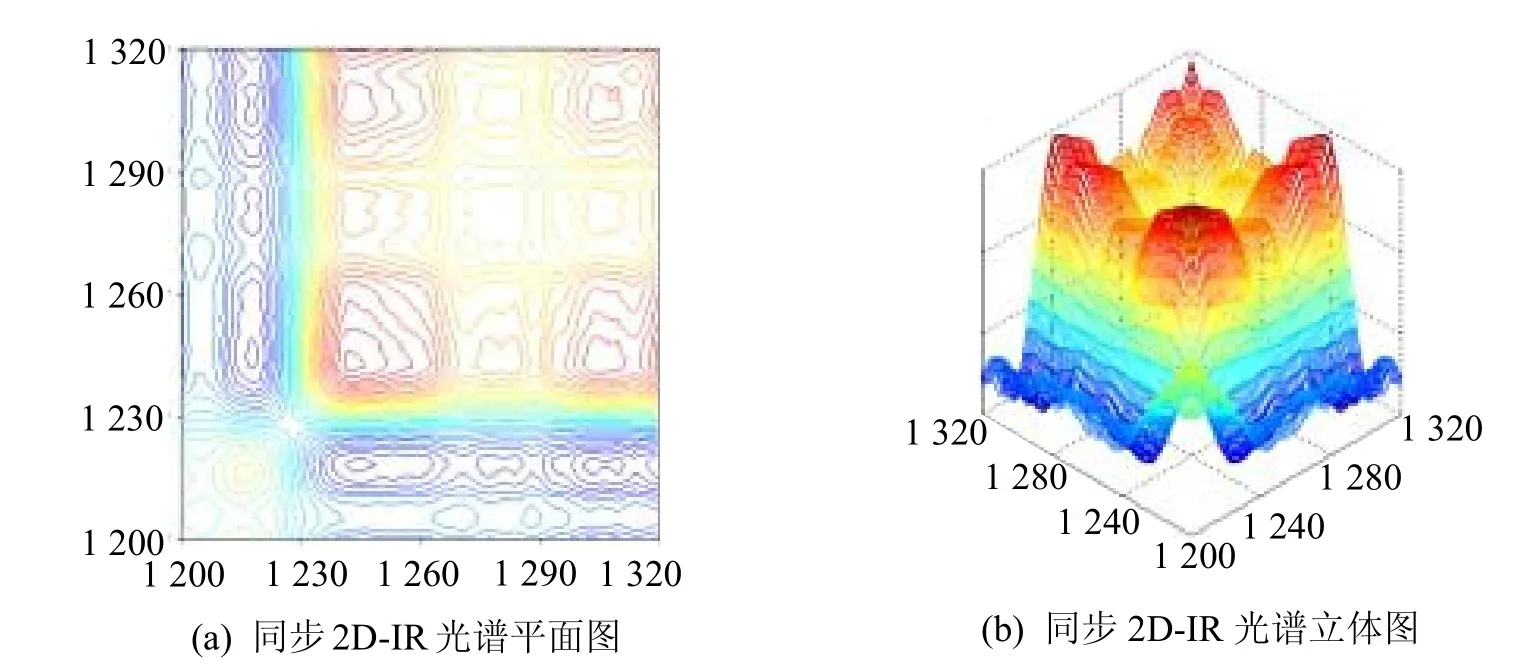
图3 大米蛋白质酰胺Ⅲ带νamide-Ⅲ-rice同步2D-IR光谱(1 200~1 330 cm-1)
2.3.2 异步2D-IR光谱研究
在1200~1330 cm-1频率范围内,进一步开展了大米蛋白质酰胺Ⅲ带νamide-Ⅲ-rice异步2D-IR光谱研究(图4),相关光谱数据及解释见表3。
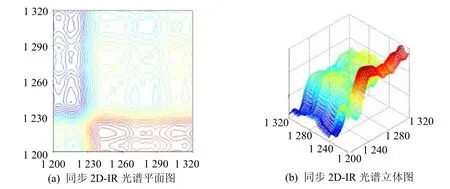
图4 大米蛋白质酰胺Ⅲ带νamide-Ⅲ-rice异步2D-IR光谱(1200~1330 cm-1)

表3 大米蛋白质酰胺Ⅲ带νamide-Ⅲ-rice的2D-IR光谱数据及解释
根据NODA原则[17-19]和表3数据可知,随着测定温度的升高,大米蛋白质二级结构红外吸收峰变化快慢顺序依次为:1 306 cm-1(α-螺旋结构)> 1 270 cm-1(无规卷曲结构)> 1 289 cm-1(β-转角结构)> 1 214 cm-1(β-折叠结构)。研究结果说明,大米蛋白质二级结构中的α-螺旋结构对于温度比较敏感,随着温度的升高,其结构最先被破坏,而大米蛋白质二级结构中的β-折叠结构则相对较为稳定。
3 结论
开展了大米蛋白质酰胺 Ⅲ 带的三级红外光谱研究。实验发现:在1 200~1 330 cm-1频率范围内,大米蛋白质的二级结构主要包括:α-螺旋结构(1 306 cm-1)、无规卷曲结构(1 270 cm-1)、β-转角结构(1 289 cm-1)和 β-折叠结构(1 214 cm-1)。随着测定温度的升高,大米蛋白质二级结构的微观结构发生改变,其热稳定性进一步降低。本文拓展了三级红外光谱在大米蛋白质结构及热稳定性的研究范围,具有重要的理论研究价值。
