游泳运动对2型糖尿病小鼠海马Aβ及生成相关蛋白的影响
2020-04-24姚曦何标
姚曦,何标
(1.安徽机电职业技术学院,安徽 芜湖,241003;2.安徽师范大学 体育学院,安徽 芜湖,241002)
阿尔茨海默病是一种多发于老年人群的神经系统疾病[1]。被认为是伴随机体衰老而引起的神经退行性病变,按照发病病因的不同可分为遗传性阿尔茨海默病和散发性阿尔茨海默病(sporadicAlzheimer's,sAD)。目前,sAD病因尚不清楚,普遍认为是遗传和环境等因素共同作用的结果[2]。有研究表明,sAD发生的始动因素可能是胰岛素抵抗或胰岛素功能异常[3]。神经退行性疾病可能始发于外周的胰岛素抵抗,而sAD可能与脑内胰岛素代谢异常密切相关[4]。运动作为一种有效的干预手段,对IR和AD有积极的预防和缓解作用,但具体的分子机制尚不清楚,本实验拟通过建立T2DM小鼠模型,探讨8周的游泳运动对T2DM小鼠海马Aβ42及生成相关蛋白含量的影响,及运动预防STZ致T2DM小鼠阿尔茨海默病样变化的机制。
1 材料与方法
1.1 实验动物及分组
购4周龄清洁级雄性C57BL/6小鼠,常规分笼饲养,实验小鼠适应性喂养一周后随机分为正常对照组 (C,N=6)和糖尿病建模组(N=30),C组小鼠普通饲料喂养。糖尿病建模组小鼠进行6周的高脂膳食后,腹腔注射STZ(25mg/kg),连续5 d,以空腹血糖≥11.1 mmol/L为糖尿病小鼠标准[5]。把糖尿病小鼠随机分为糖尿病安静组(DC,N=6)和糖尿病运动组(DE,N=6)。
1.2 运动方案
DE组小鼠进行8周的无负重游泳运动,每周5次,每次持续60 min,游泳运动开始前进行3 d的预游泳实验,分别15 min、30 min和45 min,第4 d开始正式游泳运动,持续8周,C组和DC组安静饲养。
1.3 取材
小鼠末次运动结束后禁食12 h,脱颈处死实验小鼠,取海马,放入-80℃冰箱保存,待测。
1.4 测定方法
采用蛋白质免疫印迹法检测海马APP、PS1、BACE1和Aβ42蛋白相对表达水平,参照文献[6]进行蛋白质免疫印迹实验。取适量海马,按1∶7的质量比加入混有PMSF的裂解液,均浆,离心,取上清,BCA试剂盒测定蛋白浓度。SDS-PAGE凝胶电泳,PVDF转膜,脱脂牛奶封闭,加一抗(APP,CST,1∶1 000;PS1,Santa,1∶1 000;BACE-1,abcam,1∶1 000;Aβ42,CST,1∶1 000),摇床过夜,孵二抗,TBST摇床清洗,暗室ECL显影,用AIpha成像系统曝光,ImageJ1.46进行灰密度值分析,将目的蛋白与内参平均密度的比值作为目的蛋白相对表达水平。
1.5 数据统计处理
用SPSS 18.0软件对所获数据进行统计分析,所有数据用均数±标准差表示,组间比较用单因素分析法(One-Way ANOVA),事后检验采用LSD法。P<0.05为差异具有显著性,P<0.01为差异具有极显著性,运用Graph Prism 7进行图像处理。
2 实验结果
2.1 游泳运动对小鼠海马Aβ42蛋白相对表达水平的影响
Western Blot实验结果显示,与C组(0.86±0.22)相比较,DC组小鼠海马Aβ42相对表达水平(1.46±0.11)显著增加(P<0.01),与DC组相比,DE组小鼠海马Aβ42相对表达水平(1.03±0.35)显著降低(P<0.05),如图1-A所示。
2.2 游泳运动对小鼠海马APP、BACE1和 PS1蛋白相对表达水平的影响
Western Blot实验结果显示,与C组(0.88±0.27)相比较,DC组小鼠海马APP相对表达水平(1.30±0.15)显著增加(P<0.01),与DC组相比,DE组小鼠海马APP相对表达水平(1.01±0.12)显著降低(P<0.05),如图1-B所示。
Western Blot实验结果显示,与C组(0.89±0.22)相比较,DC组小鼠海马BACE1相对表达水平(1.40±0.20)显著增加(P<0.01),与DC组相比,DE组小鼠海马BACE1相对表达水平(1.07±0.18)显著降低(P<0.05),如图1-C所示。
Western Blot实验结果显示,与C组(1.00±0.16)相比较,DC组小鼠海马PS1相对表达水平(1.48±0.22)显著增加(P<0.01),与DC组相比,DE组小鼠海马PS1相对表达水平(1.10±0.11)显著降低(P<0.01),如图1-D所示。
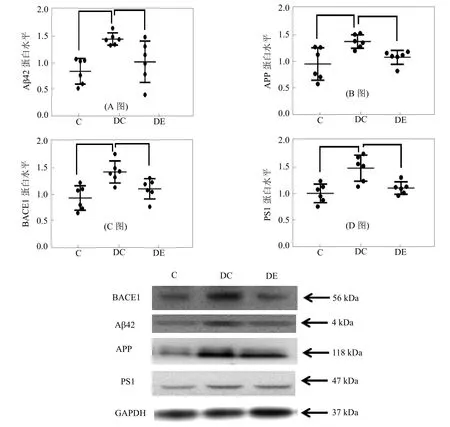
图1 各组小鼠海马APP、BACE1、PS1和Aβ42蛋白相对表达统计(N=6)
3 结果分析
AD以细胞外老年斑、神经纤维缠结和以胆碱能神经元的变性和突触的丢失为主要病理特征,起病隐袭,在以后的数年里缓慢发展为明显的痴呆症状[2]。sAD发生的始动因素可能是胰岛素抵抗或胰岛素功能异常,脑胰岛素抵抗可能是神经退行性疾病的始动因素[4]。神经元胰岛素功能异常引起sAD葡萄糖代谢异常、线粒体功能障碍、ATP代谢减少等症状,导致海马Aβ异常积聚等AD样病理变化[7]。实验结果发现,腹腔注射STZ诱导的T2DM小鼠海马Aβ42蛋白相对表达水平显著高于正常对照组,提示外周胰岛素功能异常导致T2DM小鼠海马发生AD样病理改变,其机制可能是外周胰岛素和葡萄糖稳态的改变影响脑内胰岛素及受体的功能,导致海马Aβ异常聚集[8]。自发性糖尿病大鼠海马Aβ1-42质量浓度也显著增加[9]。高脂膳食导致的IR大鼠海马Aβ蛋白相对表达水平显著增加[10]。上述研究表明,外周胰岛素抵抗导致小鼠海马Aβ蛋白相对表达增多,出现AD样病理改变。
Aβ细胞外异常聚集是AD的主要病因所在,其中以对神经细胞毒性较大的Aβ42为主要成分[11]。Aβ是淀粉样前体蛋白(Amyloid precursor protein,APP)在β-分泌酶和γ-分泌酶的作用下生成的[12]。APP首先在β-分泌酶的作用下,水解产生sAPPβ和膜结合的C末端含有99个氨基酸片段的C99,随后在γ-分泌酶的作用下,C99被裂解为Aβ,即Aβ代谢途径,BACE1和PS1分别是β-分泌酶和γ-分泌酶的主要成分[13]。本实验结果显示,与C组相比较,小剂量腹腔注射STZ诱导的T2DM小鼠海马APP、BACE1和PS1蛋白相对表达水平均显著升高,Aβ42蛋白相对表达水平显著增加,提示T2DM小鼠海马发生AD样病理改变。IR和胰岛素信号传导障碍上调小鼠海马和皮层APP蛋白相对表达水平,加速了Aβ的积聚速率,最终导致AD的发生[14]。对3 d龄新生幼鼠脑室注射STZ后发现,脑室注射STZ显著上调新生幼鼠颞叶和下丘脑APP mRNA表达水平,提示脑内IR和胰岛素信号传导障碍上调APP mRNA表达水平[15]。而高果糖饮食诱导的IR大鼠海马APP、BACE1及PS1蛋白相对表达水平显著高于对照组,IR大鼠海马APP异常裂解增多,Aβ生成增多[16]。而8月龄自发性糖尿病大鼠皮层APP、β-分泌酶蛋白相对表达水平显著高于同龄对照组[17]。提示胰岛素抵抗及胰岛素信号传导障碍导致Aβ生成相关蛋白表达增多。本实验研究结果与上述研究结果相一致,研究结果提示胰岛素抵抗及胰岛素信号传导障碍导致与Aβ生成相关的APP、BACE1和PS1等蛋白相对表达水平上调,其机制可能是胰岛素抵抗引起脑内胰岛素信号通路传导障碍,上调APP、BACE1和PS1蛋白相对表达水平,最终加速了Aβ的生成[18]。
适宜的身体锻炼有助于增强海马功能,提高学习记忆能力[19]。每周一次的身体活动可以有效降低sAD的发病机率[20]。本实验结果显示,与DC组相比,DE组小鼠海马APP、BACE1、PS1和Aβ42的蛋白相对表达水平显著降低,证实适宜的运动能够预防和缓解AD的发生。文献[21]发现,与安静组相比,5周的跑台运动显著降低APP/PS1小鼠海马APP蛋白相对表达水平和Aβ质量浓度。Yu等[22]证实,对腹腔注射D半乳糖导致的AD大鼠进行8周的跑台运动后发现,运动组大鼠海马APP、BACE1、PS1和Aβ42蛋白表达水平较安静组显著降低。上述研究结果提示,适宜的身体活动可能通过减少Aβ聚集,延缓AD的病理进程。其机制可能是运动通过抑制APP、BACE1和PS1蛋白相对表达水平,减少Aβ的生成[23]。侧脑室注射STZ上调SD大鼠海马Aβ42蛋白相对表达水平,对侧脑室注射STZ的SD大鼠进行6周的自主跑轮运动后发现,运动组大鼠海马Aβ42蛋白相对表达水平显著降低[24]。提示长期的运动可以抑制胰岛素抵抗导致的海马Aβ42的生成。文献[25]证实6周的游泳运动降低T1DM大鼠海马APP蛋白相对表达水平。本实验结果也显示,8周的游泳运动降低T2DM小鼠海马APP蛋白相对表达水平,与上述研究结果相一致。针对运动对Aβ生成相关蛋白影响的研究也有不同的结论,不同的运动方式对CD1小鼠大脑皮层APP和PS1蛋白相对表达水平产生不同的影响,与同龄安静组相比较,8周的自主跑轮运动上调了CD1小鼠大脑皮层APP和PS1蛋白相对表达水平,虽然16周的跑台运动对CD1小鼠大脑皮层APP蛋白表达水平没有产生影响,但降低CD1小鼠大脑皮层PS1蛋白相对表达水平[26]。本实验发现,8周的游泳训练降低T2DM小鼠海马APP和PS1蛋白表达水平,导致研究结果不一致的原因可能是实验动物的模型不同以及运动方式和动物年龄不同导致的。
4 结论
外周胰岛素抵抗及信号传导障碍导致海马发生AD样病例改变,主要表现为海马Aβ42生成增多,Aβ生成相关蛋白APP、BACE1及PS1蛋白相对表达水平增多。而8周的游泳运动通过抑制海马APP、BACE1和PS1蛋白相对表达水平,减少Aβ42的生成,推测运动可能通过抑制海马Aβ生成相关蛋白表达水平,减少Aβ42的生成,最终达到延缓AD的目的。
