延迟首次投喂对乌江中华倒刺鲃仔鱼的补偿生长、消化酶活性及饵料日转化率的影响
2020-04-23李忠利蒋天勇巴家文蔡红艳
李忠利,蒋天勇,巴家文,蔡红艳,黄 辉
(1.铜仁学院农林工程与规划学院,贵州铜仁 554300;2.西南大学荣昌校区水产系,重庆 402460)
在人工养殖或天然环境条件下,开口仔鱼受环境变化、季节更替和种内种间竞争的影响,都可能因饵料缺乏而造成饥饿胁迫,其自身的代谢、行为也会发生相应变化[1-2]。仔鱼在饥饿时一般通过降低代谢水平、调整能量分配和消耗自身储能物质等来适应,主要体现在自身蛋白质、脂肪、糖类等含量的变化,使得仔鱼生长发育延迟,且不同种类在饥饿时其耐受能力与补偿方式各不相同[3-5]。当饵料恢复后,仔鱼又会因饥饿程度的不同而表现出不同的补偿生长现象。
早期仔鱼死亡的主要原因与饥饿、开口摄食时间、敌害生物和疾病等因素有关,其中因开口摄食时间的推迟而导致的高死亡率表现尤为明显。当前有关鲤形目仔鱼延迟首次投喂方面的报道有黑尾近红鲌(Ancherythroculternigrocauda)、胭脂鱼(Myxocyprinusasiaticus)、岩原鲤(Procyprisrabaudi)和厚颌鲂(Megalobramapellegrini)等,主要针对仔鱼骨骼肌、消化系统、消化酶活性的变化[4-7],而对仔鱼生长及饵料日转化率的报道较少。对于开口仔鱼而言,消化酶在促进仔鱼代谢、存活和生长等方面的作用至关重要,其活力的强弱直接影响到仔鱼的消化机能与调节机制[1,8-10]。本研究通过研究延迟首次投喂条件下乌江中华倒刺鲃仔鱼消化酶的变化,一方面探讨饥饿再投喂对开口仔鱼消化机能的影响,分析开口仔鱼在补偿生长下的消化酶应对机制,为鲤科鱼类仔鱼的消化生理补充基础资料;另一方面为养殖鱼类人工育苗阶段的营养配方及饵料投喂模式提供理论依据。
1 材料与方法
1.1 仔鱼获取
初孵乌江中华倒刺鲃(Spinibarbussinensis)仔鱼材料于2018年6月采自乌江彭水鱼类人工增殖放流站,产自同一尾亲鱼。亲鱼用催产药物HCG和AHRH-A2合剂催产,通过人工受精获得受精卵,采用微流水孵化,经过约80 h全部出膜,随即带回实验室暂养于3个白色塑料水簇箱中(50 cm×35 cm×30 cm)。
1.2 实验设计
仔鱼自8日龄肠道贯通(以肛门处粪便为依据)开始实验,选择体表正常的仔鱼移入1 L玻璃水簇箱中,每箱(即1个重复)60尾。实验共设计H0(即正常投喂组)、H1(延迟1天再开始投喂,以下类推)、H3、H5、H7、H9和H11共7个处理组(当仔鱼PNR点,即13 d后停止分组),每组3个重复。随后进行再投喂实验,投喂时间均为17 d。
实验期间每天8:00、12:00和18:00各投饵一次,饵料为人工孵化的丰年虫(Artemiasinica)无节幼体(山东滨州尚嘉水族提供,粗蛋白约60%,粗脂肪约20%,粗灰分约7%)。先用过滤网滤掉多余水分,用刻度吸管吸取后投喂,以箱中无残饵为限,记录每次实际投喂量。每天早上采用曝气自来水换水一次,水温(26.1±1.3)℃、溶氧(8.12±0.56)mg/L、pH值7.95±0.13,氨氮(0.32±0.8)mg/L,换水量为总量的1/2。
1.3 取样与指标测定
全长、体重测定:各实验组每间隔4 d测量一次数据,各水簇箱随机抽取10尾测量全长(0.1 mm),称量体重(0.1 mg,每次取10尾,各取样3次)。
粗酶液制备:对仔鱼整鱼取样,将上述称量好的材料置于离心管中,加入4 ℃生理盐水(重量∶体积=1∶9),冰水浴剪碎、匀浆,3 000 r/min冷冻离心10 min,取组织匀浆上清液,置于-80 ℃冰箱保存。
消化酶测定:按照南京建成生物工程研究所试剂盒的方法,用紫外分光光度计(Alpha-1860A)测定蛋白含量(货号A045-2)、碱性磷酸酶(货号A059-1)、淀粉酶(货号C016-1)、脂肪酶(货号A054-1)和胰蛋白酶活力(货号A-080-2)。当天未能即时测定样本放置于-80 ℃超低温冰箱保存。
酶活力单位的定义如下,胃蛋白酶活性为每mg组织蛋白在37 ℃每分钟分解蛋白质生成1 μg酪氨酸相当于1个酶活力单位;淀粉酶活性为组织中每mg蛋白在37 ℃最适pH与底物作用30 min,水解10 mg淀粉定义为1个淀粉酶活力单位;胰蛋白酶活性为每mg组织蛋白在37 ℃每分钟分解蛋白质生成1 μg酪氨酸相当于1个酶活力单位;脂肪酶活性为在37 ℃最适pH条件下,每g脂肪蛋白在反应体系中与底物反应1 min,每消耗1 μmol底物为一个酶活力单位。
1.4 数据的计算与分析
初次摄食率:FFR=100%×N2/N1;
即时死亡率:IMR=100%×N4/N3;
饵料日转化率:DFCE=100%×(W2-W1)/[C×(t2-t1)];
特定生长率:SGR=(lnM2-lnM1)/(t2-t1);
式中,N2和N1分别为初次投喂时摄食仔鱼尾数和取样尾数(尾);N4和N3分别为初次投喂前,死亡的仔鱼尾数和各组仔鱼总尾数(尾);W2、W1分别代表t2、t1日龄时的鱼体湿重(g),C为摄食的饵料湿重(g);M2和M1分别为时间t2、t1时的全长(mm)或体重(g)。
全长、体重损失率和补偿率计算公式如下:
损失率:LR=(M0-M1)/M0×100%;
补偿率:CR=(N6-N5)/N5×100%;
其中M0和M1分别代表各组饥饿开始和饥饿结束时的全长(mm)或体重(g),N6和N5分别代表各组再投喂结束和再投喂开始(即饥饿结束)时的全长(mm)或体重(g)。
用Microsoft Excel 2010和Spss Satistics 17.0对数据进行整理、统计分析并作图,各实验组数据采用单因素方差分析(One-Way ANOVA)进行比较,当差异显著时则进行多重比较(Duncan’s multiple range tests),显著性水平为0.05。
2 结果分析
2.1 全长和体重的损失与补偿
各实验组初次摄食率、即时死亡率、全长与体重的损失率、补偿率见表1。初次摄食率随饥饿时间的延长而逐渐减少,即时死亡率随饥饿时间的延长而增加,从H5开始仔鱼明显消瘦、胆囊膨大,且H9和H11出现胸角。全长和体重的损失率都呈上升变化趋势,各组间差异显著。全长的补偿率为18.9%~22.2%,除H9与H11外,其余各组间差异不显著;体重补偿率为64.1%~69.8%,除H1与H3外,其余各组间差异不显著。
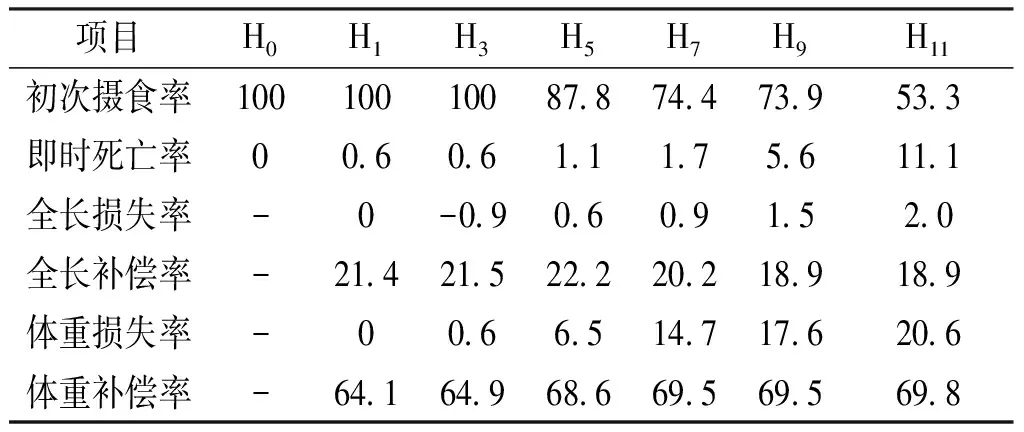
表1 各组饥饿及再投喂后全长和体重的损失率和补偿率Fig.1 Loss rate and compensation rate of total length and body weight after starvation and re-feeding in each group of S.sinensis %
2.2 补偿生长
各组在饥饿及再投喂17 d后的全长和体重变化见图1。正常组H0的全长和体重都呈上升趋势。各实验组饥饿处理后的全长和体重都呈下降趋势,且与正常组都存在显著性差异。各实验组再投喂后全长的补偿生长曲线呈明显下降趋势,与对应时间点的正常组比较,除H1差异不显著外,其余各组都存在显著性差异。体重的补偿生长曲线先上升后下降,且与正常组都存在显著性差异。
各组特定生长率的变化见图2。正常组H0的全长和体重特定生长率都呈波动性变化趋势,先呈波动性上升,分别在7 d和9 d时达到最大值,随后为波动性下降。各实验组再投喂后全长和体重的特定生长率与正常组都存在显著性差异,在全长的变化中,H1、H3和H5呈先上升后下降的趋势,H7、H9和H11呈先下降后上升的趋势;在体重的变化中,H1先上升后下降,其余各组都呈下降趋势。实验后期,除H1和H3的体重外,其余各组全长和体重的特定生长率都明显高于正常组。
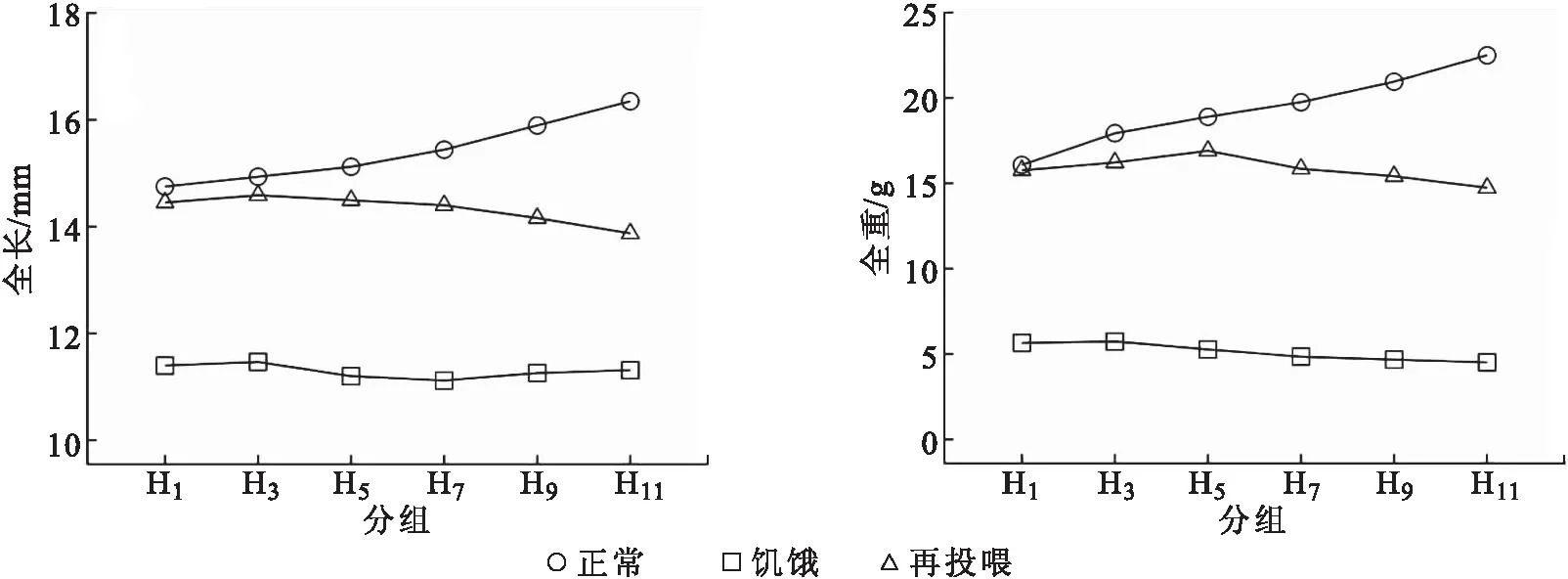
图1 各组全长和体重的补偿生长Fig.1 Compensatory growth of total length and body weight in each group of S.sinensis
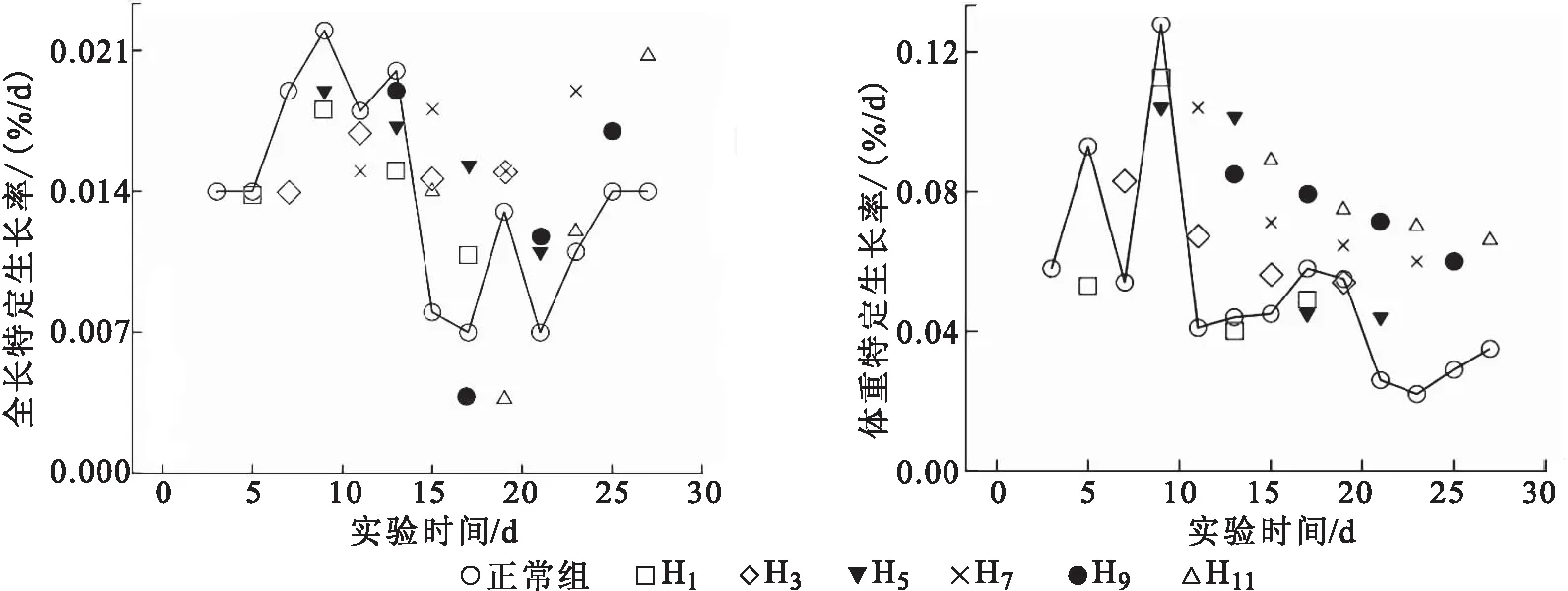
图2 各组全长和体重特定生长率的变化Fig.2 Specific growth rate of total length and body weight in each group of S.sinensis
2.3 消化酶的变化
各组在饥饿及再投喂17 d后消化酶的的变化情况见图3。正常组除了淀粉酶呈下降趋势外,碱性磷酸酶、胰蛋白酶和脂肪酶都呈上升变化趋势。饥饿处理中,淀粉酶、碱性磷酸酶和胰蛋白酶都呈下降趋势,脂肪酶从H1至H7组呈上升趋势,随后在H9和H11组下降。再投喂后,除了淀粉酶呈先上升后下降趋势外,其余三种酶都呈上升趋势。
再投喂后,各实验组间的比较结果显示,四种消化酶比活力在正常投喂与再投喂间差异都不显著。而在饥饿处理下,四种消化酶比活力在早期与正常投喂或再投喂的差异不显著,在后期除了淀粉酶、碱性磷酸酶和胰蛋白酶组的H1和H3,脂肪酶组的H1至H7外,其余各组均差异显著。
2.4 饵料日转化率的变化
对不同恢复投饵天数下的饵料日转化率进行了统计。实验结束时各实验组间的饵料日转化率无显著性差异,而与各自对应的正常组相比都存在显著性差异(见表2)。饵料日转化率的变化见图4,正常组在实验期间的饵料日转化率为0.010 %~0.044 %(平均0.027%±0.011%),且随实验天数的增加呈不规则的波动上升趋势。各实验组在再投喂下的饵料日转化率范围均在0.004%~0.015%,显著小于对应的正常组,各组内饵料日转化率呈不规则上升的变化趋势,但都无法恢复到正常投喂的水平。

图3 各组消化酶活性的变化
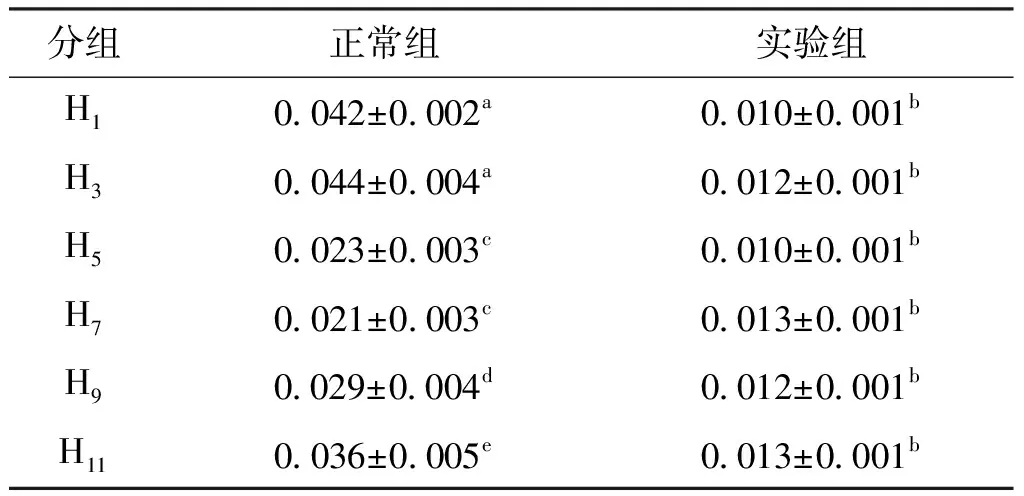
表2 各组实验结束时的饵料日转化率Tab.2 Daily conversion rate of bait of each group at the end of experiment %
注:同一列中不同上标字母表示差异显著(P<0.05),相同上标字母表示差异不显著(P>0.05)。
3 讨论
3.1 延迟首次投喂对仔鱼消化酶活力的影响
饥饿胁迫是鱼类在早期生活史中面临的主要问题之一,而消化酶的调节是开口仔鱼应对饥饿环境的主要方式[1,5]。不同的鱼类调节过程各不相同,在已报道的鲤形目鱼类中,厚颌鲂饥饿仔鱼通过增强脂肪酶比活力,消耗机体脂肪来补充个体所需[8]。王川等[5]研究发现胭脂鱼仔鱼在饥饿初期胰蛋白酶和脂肪酶活性呈上升趋势。即在饥饿条件下,仔鱼的消化酶仍具有活性,这一点在本研究的四种酶中都有体现,刘亚秋等[10]认为这主要受基因调控的影响,而非外源饵料诱导。四种酶中,仅脂肪酶活力在饥饿早期表现出波动性上升趋势,之后呈下降趋势,而其余三种酶都呈下降趋势,这可能与仔鱼自身摄入的食物量及可溶性蛋白的沉积有关[11]。

图4 各组饵料日转化率的变化Fig.4 Changes of daily food conversion rate in each group of S.sinensis
饥饿后再投喂下仔鱼消化酶的特征也各不相同,王川等[5]研究发现胭脂鱼仔鱼的胰蛋白酶呈先上升后下降的趋势,而淀粉酶活性与之相反,并指出仔鱼的饥饿恢复策略与饥饿程度和恢复时间有关,饥饿时间越长胭脂鱼仔鱼的淀粉酶活性越强。本研究结果与胭脂鱼刚好相反,除了淀粉酶活性下降外,其余酶活性在恢复摄食后都呈上升趋势,这可能与不同种类的消化系统差别有关。
本研究中,中华倒刺鲃开口仔鱼在正常摄食、饥饿以及再投喂条件下,仔鱼消化酶都具有活性,并且表现出波动性变化特征。Cahu等[12]和Cara等[1]认为仔鱼这种波动主要由遗传因素决定,同时也受自身消化器官发育程度和环境中饵料数量及营养成分的影响。刘亚秋等[10]在西江鲤(Cyprinuscarpio)的仔鱼研究中认为这是仔鱼消化功能逐步适应并完善的过程。
3.2 延迟首次投喂下仔鱼的补偿生长
谢小军等[3]归纳了饥饿再投饵和正常投饵下鱼体的生长差异,将补偿生长分为超补偿、完全补偿、部分补偿和不能补偿四种类型。即使在鲤形目鱼类中,延迟首次投喂下开口仔鱼也表现出不同的生长特点,岩原鲤和胭脂鱼饥饿3 d及以内的仔鱼在恢复投喂后,其体重均能显示出完全补偿生长,随后表现为部分补偿生长(岩原鲤4 d、胭脂鱼8 d),且仔鱼随饥饿时间的延长,其补偿生长能力逐渐下降[4,5]。Mookerji等[13]也发现南亚野鲮(Labeorohita)仔鱼在延迟首次投喂5 d后体重增值和存活率才明显下降,而本研究结果显示中华倒刺鲃仔鱼的显著变化时间稍晚(7 d),其全长和体重都随再投喂时间的延长而呈下降趋势,特定生长率的上升变化趋势显示该鱼饥饿再投喂后能完成部分补偿生长,这可能是饥饿达到一定程度后,仔鱼自身的消化酶活性显著降低,此时即使补充投饵,其消化能力也无法维持自身物质和能量的需求,从而无法恢复到正常水平[14]。而厚颌鲂的补偿生长效果更明显,李芹等[8]发现该鱼饥饿3天内恢复投喂能表现出超补偿生长现象,并认为这与不同阶段鱼体的发育状况、食性及饵料质量有关。而有关补偿生长机制主要有代谢滞后假说、食欲增强假说和综合作用假说三种[15],多数报道更倾向于第三种,即仔鱼在恢复投喂后不仅增强了食欲,提高了摄食水平,同时也增强了代谢,改善了食物转化率。
3.3 延迟首次投喂下仔鱼的摄食和存活
饥饿状态下,鱼类通过改变一些重要酶的活性,分解体内储能物质来维持生命活动,以此对新陈代谢进行调节,对机体起到保护作用。对开口仔鱼而言,在最佳的开口时间内投饵能保证仔鱼有较高的成活率,也能保证仔鱼正常的生长发育[7,9,16]。延迟首次投喂实验为仔鱼的开口投喂时间提供了理论参考,在短期饥饿情况下,仔鱼一般都能通过消耗自身机体物质,以完成补偿生长,但饥饿时间越长,其补偿能力越弱,当达到PNR点之后将逐渐趋于死亡[5,17-18]。本研究中,尽管各饥饿处理下仔鱼的饵料日转化率在恢复投喂后都能表现出一定程度的恢复,但都无法恢复到正常投喂水平,其饵料转化能力明显降低。
初次外源摄食时间对仔鱼生长发育有着显著影响,随着首次投喂时间的延迟,仔鱼表现出明显的生长减缓、个体萎缩、器官退化和死亡率升高等特征[6,15,19-20]。在人工育苗过程中,把握好开口投喂时间,对于早期仔鱼消化酶的形成和功能的完善,对仔鱼消化吸收能力、个体生长发育有着极为重要的作用。
