高压静电场处理对椪柑采后贮藏性的影响
2020-04-22吴珏谢文华徐淑婷陈烨芝曹锦萍王岳孙崇德
吴珏,谢文华,徐淑婷,陈烨芝,曹锦萍,王岳,孙崇德
(浙江大学果实品质生物学实验室/农业农村部园艺植物生长发育与品质调控重点开放实验室/园艺产品冷链物流工艺与装备国家地方联合工程实验室/园艺植物整合生物学研究与应用浙江省重点实验室,杭州310058)
我国是柑橘原产地和生产大国,柑橘种植面积和产量自2012年起均跃居世界首位[联合国粮食及农业组织统计数据库(FAOSTAT)]。柑橘产销异地的特性决定了采后加工贮运环节在柑橘产业中的重要地位。我国柑橘生产规模的不断扩大以及日益发展的柑橘出口贸易,依赖于成熟稳定的采后处理和贮藏加工技术。目前,我国柑橘采后保鲜技术主要以杀菌剂和生长调节剂等化学药剂处理为主,辅以低温冷藏、单果包装、气调处理等一系列物理措施[1]。然而,由于化学防腐剂存在毒性残留、环境污染、耐药性增加、食品安全隐患等缺陷[2],使得化学方法在食品和采后果蔬的贮藏保鲜中受到越来越多的限制。近年来,随着对食品安全关注度日益增加,人们开始趋向于寻找环境友好型的替代保鲜技术。
高压静电场(high voltage electrostatic field,HVEF)保鲜技术是利用非致死高压静电场在果实贮藏前进行短时间处理,以达到延长贮藏期和保鲜目的的一种物理保鲜技术。HVEF保鲜技术具有绿色、节能、杀菌等特性[3],且具有多种生物效应,近年来在食品和果蔬保鲜研究中受到广泛关注。HVEF可同时作用于采后病原菌和果实本身。目前,关于HVEF保鲜作用机制的研究主要涉及改变膜电位[4]、影响呼吸系统电子传递[5]、产生臭氧杀菌[6]、引起细胞膜穿孔[7]等几个方面。
HVEF对果实品质的维持具有多方面的积极作用。韩金宏[8]研究发现,HVEF处理能够显著降低油桃的冷害指数、腐烂率,缓解失重率和相对电导率的上升趋势,调节耐冷性相关酶如超氧化物歧化酶、过氧化氢酶和过氧化物酶活性。廉韶斌等[9]发现,HVEF 处理可以提高香蕉果实可溶性固形物含量、过氧化物酶活性和果胶酶活性。孙贵宝等[10]研究认为,HVEF 处理能很好地保持黄冠梨果实的含水量,维持果实硬度,控制腐烂,并延迟梨采后衰老过程。HVEF 对果蔬的保鲜作用,在苹果、梨、蔓越莓等不同的果蔬上也得到了验证,并开发出了相关的HVEF 处理设备[11-12]。此外,有研究表明,HVEF的作用效果还受温度和处理时间等因素的影响[13]。然而,该技术在柑橘果实贮藏保鲜方面的研究目前尚未见报道。因此,本研究以椪柑果实为材料,探索HVEF对其保鲜效果,并筛选合适的技术参数。
1 材料与方法
1.1 果实材料
试验于2015—2018 年在本实验室内开展。试验用椪柑分别于2015年11月和2016年11月采收自浙江省衢州市柯城区实验农场,采收后立即运输至实验室,选取成熟度基本一致、无病虫害和机械损伤的果实用于试验。贮藏结束后,开展生理生化相关指标的测定。
1.2 HVEF 处理条件筛选
1.2.1 电场强度筛选
椪柑果实HVEF 处理电场强度的筛选于2015年进行。所采用的HVEF 设备为自主研发,由控制台、高压静电电源、果实处理装置3部分组成。高压静电电源产生电压范围为0~90 kV,果实处理装置的电场强度(简称“场强”)范围为0~1 800 kV/m。果实处理装置为带卡槽的绝缘支架组成的密闭箱体,通过调节高低压电极板的距离,可形成不同的场强。果实HVEF处理模式如图1所示。设置电场强度梯度分别为150、200、250 和300 kV/m,单次处理时间为2 h,处理2 次,其间间隔24 h,对照组(CK0)不做任何处理。处理间隙及处理后的果实贮藏于20 ℃、相对湿度(relative humidity,RH)为85%~90%的环境中。每个处理250 个果实,以果实腐烂率作为筛选的评价指标,本年度果实不作生理指标测定,仅用于处理场强的筛选,最终筛选出200 kV/m的效果最佳。以此参数为基础,进行处理条件的进一步优化。
1.2.2 处理时间的优化
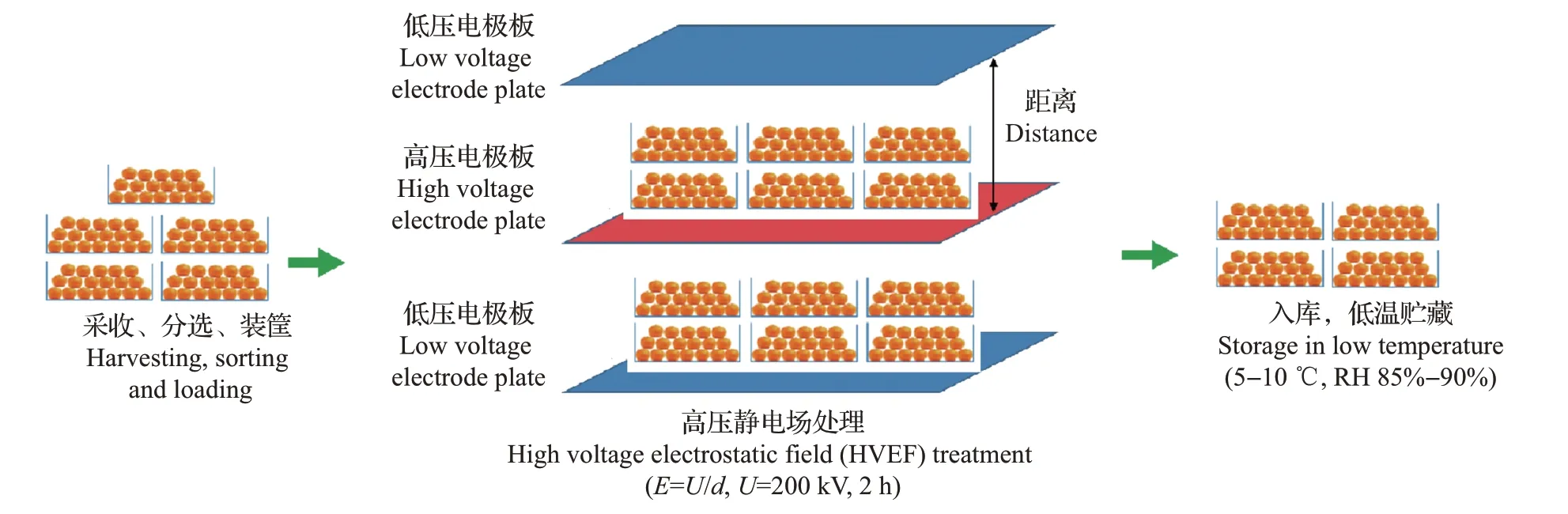
图1 椪柑果实HVEF处理示意Fig.1 Schematic diagram of HVEF treatment of ponkan fruit
椪柑果实HVEF 处理方式的筛选于2016 年进行,场强设定为200 kV/m,处理次数设定为1 次(200 kV/m-Ⅰ)、2次(200 kV/m-Ⅱ)和3次(200 kV/m-Ⅲ)(单次处理时间为2 h,每次处理间隔时间为24 h),对照组(CK)不做任何处理。处理间隙及处理后的果实贮藏于冷库(10 ℃,RH 85%~90%)中。
1.3 果实相关指标的测定
1.3.1 腐烂率
每个处理总果数为250 个,每隔30 d 统计果实的腐烂情况。果实腐烂率=腐烂果数/总果数×100%,果实腐烂数为每次统计腐烂数量的累加。
1.3.2 失重率
每个处理选取30个果实,编号后进行失重率统计,贮藏0 d的果实重量记为W0,贮藏n月的果实重量记为Wn,失重率=(W0-Wn)/W0×100%。
1.3.3 呼吸速率
每个处理选取12个单果,将果实称量后放置于密封的保鲜盒中,每盒放置3 个果实,密封3 h 后用CheckPoint Ⅱ便携式O2/CO2测定仪[MOCON Europe A/S(Dansensor)公司,丹麦]测定盒内CO2浓度。呼吸速率/(mg/(h·g))=m(CO2)/mg÷[m(果实)/g×密封时间/h]。
1.3.4 可溶性固形物(total soluble solid,TSS)含量测定
每个果实选取对称的2 瓣,分别挤汁至便携式PR-101α数显糖度计(Atago公司,日本)上测定TSS值,所得平均值计为单果的TSS值。每个处理设置12个单果重复。
1.3.5 可溶性糖与有机酸含量测定
采用气相色谱法测定可溶性糖与有机酸含量,具体参照LIN等[14]的方法并稍作修改。称取100 mg冻样粉末,加入1.4 mL 色谱甲醇(-20 ℃),封口涡旋,在70 ℃、950 r/min条件下振荡15 min,1.1×104g离心10 min;将上清液全部倒入10 mL离心管中,先后加入1.5 mL ddH2O和750 μL三氯甲烷,充分涡旋混匀,2 200 g 离心10 min;取上清液1 mL 到1.5 mL离心管中,-40 ℃贮藏,备用。
取100 μL 样品到1.5 mL 离心管中,加10 μL 内标核糖醇(0.2 mg/mL),常温真空旋转干燥3 h,加入60 mL甲氧氨盐酸盐(20 mg/mL),封口涡旋,短暂离心后在37 ℃、950 r/min 条件下振荡1.5 h。加40 μL N,O-双(三甲基硅烷基)三氟乙酰胺(含1%三甲基氯硅烷),封口,短暂离心后再在37 ℃、950 r/min条件下振荡30 min。最后,短暂离心后转入样品瓶,待进样。
样品检测采用Agilent 7980气相色谱仪(Agilent J&W 公司,美国)和氢火焰离子化检测器(flame ionization detector,FID),样品分离采用HP-5MS 毛细管色谱柱(30 m×0.25 mm,直径0.25 μm),进样口温度250 ℃,离子源温度230 ℃,4级杆温度150 ℃,色谱柱流量1 mL/min,连接线温度250 ℃。采用自动进样方式,进样量为1 μL,分流比为24∶1。温度运 行 程 序:100 ℃保 持1 min;3 ℃/min 升 温至184 ℃;0.5 ℃/min 升温至190 ℃;10 ℃/min 升温至250 ℃,保持1 min;5 ℃/min 升温至280 ℃,保持3 min;100 ℃后运行1 min;平衡时间1 min。可溶性糖和有机酸种类按照标准品出峰时间进行鉴别,其含量根据标准曲线进行计算。
1.3.6 果实色泽测定
采用色差计(HunterLab MiniScan XE Plus,HunterLab 公司,美国)测定果皮的色泽,测定标准参照国际照明委员会(CIE)1976 L*a*b*色差体系,计算公式[15]为:柑橘色泽指数(citrus color index,CCI)=1 000×a*/(L*×b*)。每个处理设置12个单果重复,每个果实测定赤道面均匀分布的4个部位并取平均值。
1.3.7 乙醇含量测定
采用顶空萃取气相色谱法检测乙醇含量[16]。称取1.2 g磨碎的鲜样,加5 mL饱和氯化钠溶液混匀,吸取3 mL匀浆到10 mL顶空萃取瓶中,加入仲丁醇作为内标,混匀并密封,60 ℃水浴加热平衡1 h后,从瓶上空抽取200 μL气体,注入气相色谱仪进行检测。每个处理设置3 个重复。乙醇测定仪器参数:Agilent 7980A 气相色谱仪和FID 检测器,色谱柱型号为HP-INNOWAX(30 m×0.25 mm,直径0.25 μm,Agilent J&W 公司,美国),载气为N2,进样口温度150 ℃,分流比24∶1,检测器温度160 ℃,炉温100 ℃。乙醇含量通过制作乙醇标准曲线进行计算。
1.3.8 总酚含量测定
参照CAO 等[17]的方法并稍作修改。称取0.2 g磨碎的鲜样,按照料液质量体积比1∶20 加入甲醇,混匀后超声30 min,8 000 r/min 离心10 min 后收集提取液,沉淀再重复提取2 次,合并上清液,用于总酚含量测定。试管中先加入4 mL H2O,再加入0.5 mL 合适稀释倍数的提取液,混匀后加0.5 mL 福林酚试剂4 倍稀释液(Sigma 公司,美国),静置3 min后加入1 mL饱和Na2CO3溶液,摇匀后于30 ℃水浴锅内静置2 h,测定在760 nm 处的吸光度值。以没食子酸(gallic acid)作标准曲线,总酚含量以没食子酸当量表示,mg/g。每个处理进行3次重复。
1.3.9 果实表皮细胞超微结构观察
将果实表皮切成5 mm×10 mm大小的长方形,用2.5%戊二醛溶液在4 ℃环境下固定过夜,然后按下列步骤处理:倒掉固定液,用磷酸缓冲液(0.1 mol/L,pH 7.0)漂洗样品3次,每次15 min;然后将样品放入1%的锇酸溶液中固定1~2 h;将固定液倒干,用磷酸缓冲液(0.1 mol/L,pH 7.0)漂洗样品3 次,每次15 min;将样品依次放入50%、70%、80%、90%和95%的乙醇溶液里脱水,每个浓度处理15 min,然后用100%的乙醇脱水20 min;最后放入纯丙酮中处理20 min。将样品放入体积比为1∶1的包埋剂与丙酮的混合液中处理1 h;再放入体积比为3∶1的包埋剂与丙酮的混合液中处理3 h;最后放入纯包埋剂中处理过夜。将处理过的样品包埋,70 ℃加热过夜,即得到包埋样品。用超薄切片机(Reichert-Jung 公司,奥地利)进行切片,切片厚度为70~90 nm,然后将切片分别用柠檬酸铅溶液和醋酸双氧铀-50%乙醇饱和溶液各染色15 min,用H-7650 型透射电镜(Hitachi公司,日本)进行观察。
1.3.10 果皮表面真菌数量测定
参考KOIDE 等[18]的方法并稍作修改。将20 g果皮清洗干净后放入磨浆机中,然后加入100 mL无菌水,研磨3 min,吸取1 mL匀浆液,加入9 mL无菌水,混匀后吸取100 μL菌液均匀涂布于马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基平板上,于28 ℃培养箱中培养72 h 后统计果皮表面真菌菌落数。每个处理重复3次。
1.3.11 生长素和脱落酸含量测定
采用酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)检测生长素(indole-3-acetic acid,IAA)和脱落酸(abscisic acid,ABA)含量。称取0.2 g 果皮,加入4 ℃预冷的磷酸缓冲液(0.1 mol/L,pH 7.4),匀浆后以3 000 r/min 离心20 min,收集上清液用于检测,所用试剂盒为植物生长激素ELISA试剂盒和植物脱落酸ELISA试剂盒(上海酶联生物科技有限公司)。
1.4 统计分析
采用SPSS 20.0 软件对数据进行统计分析,实验数据以平均值±标准差表示,2组数据间的差异显著性比较采用t 检验方法,多组数据间的多重比较采用Tukey显著性检验方法。
2 结果与分析
2.1 场强和处理时间对腐烂率的影响
在2015年的试验中,为了更好地对比不同场强处理对椪柑的作用效果,采取20 ℃作为贮藏温度。结果(表1)表明:在20 ℃贮藏条件下存放25 d,未做处理的果实腐烂率为4.0%,第50 天的腐烂率达到9.6%,而在第75 天,腐烂率达到25.2%。不同场强的高压静电场处理在25 d 后均降低了果实的腐烂率。在处理时间一定的情况下,果实腐烂率随着处理场强的增大呈现先下降后升高的变化趋势,其中,200 kV/m的电场强度处理后的果实在整个贮藏期间的腐烂率最低。因此,选取200 kV/m作为处理场强,用于HVEF处理时间参数的优化。
在2016 年的试验中进一步对比了在200 kV/m电场强度下不同处理次数的效果。采取椪柑冷藏保鲜常用温度10 ℃作为贮藏温度。结果(表2)表明:在低温贮藏条件下椪柑果实放置30 d未出现腐烂现象。贮藏前期各处理组的腐烂率和对照组之间没有明显差异,但在贮藏后期,HVEF处理对果实腐烂率的影响逐渐明显。贮藏第90天时,对照组(CK)腐烂率为6.3%,而HVEF 处理的果实仅为4.3%~5.0%。至第120 天时,对照组腐烂率为12.0%,而HVEF 处理组腐烂率为7.7%~9.0%。单次处理和多次处理之间的差异不大。
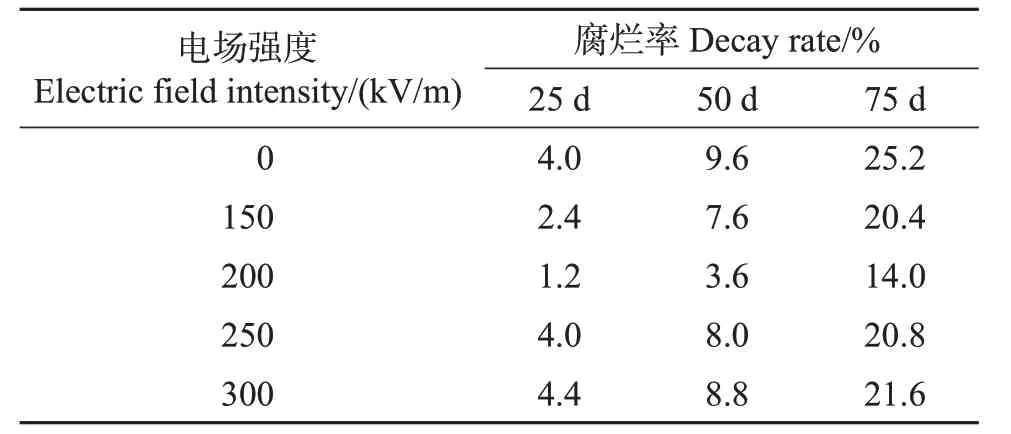
表1 不同电场强度处理对椪柑果实贮藏期间腐烂率的影响Table 1 Effect of different electric field intensities on decay rate of ponkan fruit during storage

表2 处理次数对椪柑果实贮藏期间腐烂率的影响Table 2 Effect of treatment times on decay rate of ponkan fruit during storage
2.2 果实表面真菌数量变化
对经HVEF处理后的果实表面真菌数量进行检测,发现单次和多次的HVEF 处理均能显著降低果实表面真菌数量(图2)。处理次数越多,果实表面真菌数量降幅越大,其中,2 次处理和3 次处理之间的差异不显著。该结果表明,HVEF 处理可能存在抑制或杀灭表皮病原菌的作用,这可能是其具有防腐保鲜功能的原因之一。
2.3 呼吸速率变化
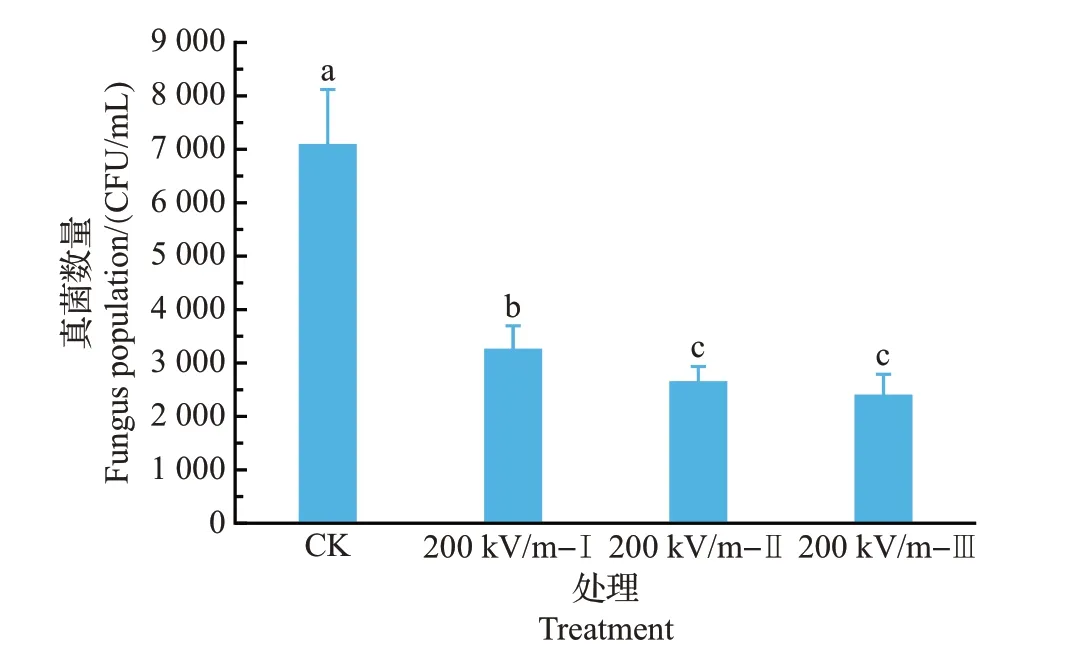
图2 HVEF处理对椪柑果实表面真菌数量的影响Fig.2 Effects of HVEF treatments on populations of fungi on the surface of ponkan fruit
HVEF 处理后果实呼吸速率低于对照组;随着HVEF处理次数的增加,呼吸速率呈下降的趋势(图3)。该结果表明,HVEF 处理可以抑制果实呼吸速率,且多次处理对抑制呼吸速率有累积效应。由于果实采后呼吸作用过旺会消耗一部分营养成分,从而造成果实质量损失、贮藏期间营养品质成分的下降,以及不良代谢产物的积累等,由此加速果实的衰老。因此,HVEF 处理对呼吸速率的抑制作用可能有利于果实品质的维持。
2.4 失重率变化
随着贮藏时间的延长,椪柑果实的失重率逐渐增加。HVEF处理的果实失重率在整个贮藏过程中均略低于对照。其中,200 kV/m-Ⅰ处理组的失重率最低,但不同次数的处理间无显著差异(P>0.05)(图4)。该结果与呼吸速率测定结果(图3)相呼应,表明HVEF处理降低椪柑失重率可能与其对果实呼吸的抑制有关。
2.5 采后品质指标分析
在贮藏过程中,椪柑果实TSS 含量总体呈上升趋势。除在贮藏第90 天时,200 kV/m-Ⅰ处理的果实TSS含量显著低于对照外(P<0.05),其余处理与对照组间差异不显著(P>0.05)(图5)。说明HVEF处理对贮藏的椪柑果实的TSS含量没有显著影响。

图3 HVEF处理对椪柑果实呼吸速率的影响Fig.3 Effects of HVEF treatments on the respiratory rate of ponkan fruit
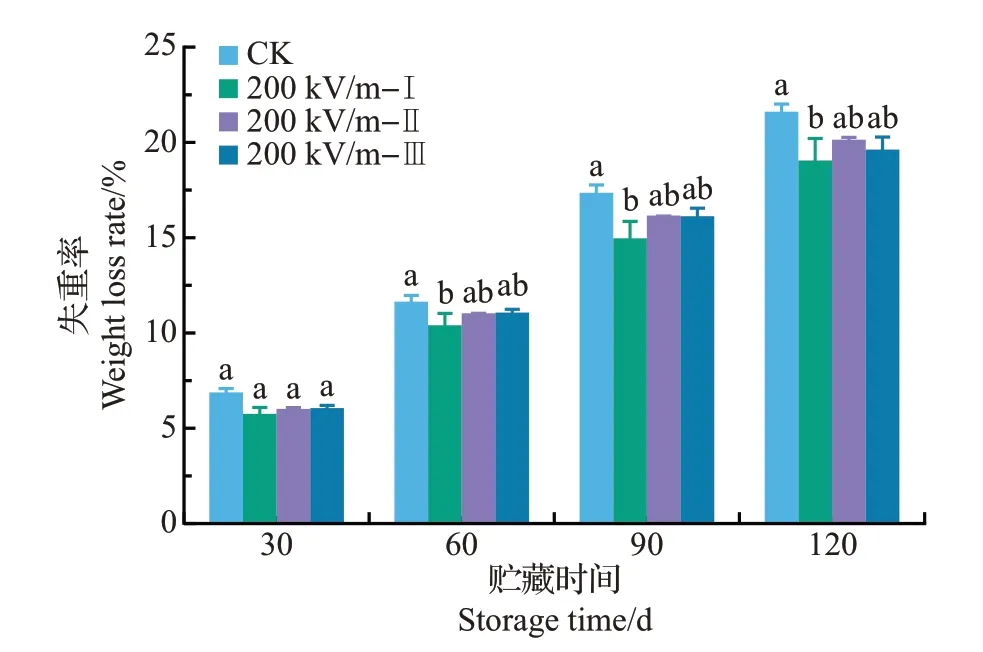
图4 HVEF处理对椪柑果实贮藏期间失重率的影响Fig.4 Effects of HVEF treatments on the weight loss rate of ponkan fruit during storage
椪柑果肉可溶性糖主要为蔗糖、果糖和葡萄糖。在整个贮藏过程中,果糖和葡萄糖含量缓慢升高(图6A~B),蔗糖含量则逐渐下降(图6C)。HVEF处理提高了果实第120天时葡萄糖和果糖的含量。其中200 kV/m-Ⅱ的处理效果最明显,与CK 组相比,葡萄糖含量和果糖含量分别提高了27%和12%,并延缓了蔗糖含量的下降。该结果表明,HVEF 处理有利于果实可溶性糖含量的维持,这一结果与呼吸作用的测定结果(图3)相呼应,说明HVEF对可溶性糖含量的维持可能与其抑制呼吸作用有关。

图5 HVEF处理对椪柑果实TSS含量的影响Fig.5 Effects of HVEF treatments on the total soluble solid(TSS)content of ponkan fruit
椪柑属于柠檬酸型果实,果实中有机酸含量最高的为柠檬酸,其次是苹果酸。由图7可见,随着贮藏时间的延长,苹果酸和柠檬酸含量都不断降低。总体而言,HVEF 处理的果实苹果酸含量在各时间段略高于对照,但差异不明显,且在贮藏的不同时间段,各处理组的效果略有波动。HVEF 处理对果实柠檬酸含量的影响同样存在波动,在贮藏第30天,200 kV/m-Ⅱ处理的柠檬酸含量显著高于对照(P<0.05),而在第120 天,200 kV/m-Ⅰ和200 kV/m-Ⅱ处理的柠檬酸含量显著高于对照(P<0.05),而200 kV/m-Ⅲ处理的柠檬酸含量则显著低于对照(P<0.05)。说明HVEF 处理对椪柑果实有机酸含量的影响还不确定,需进一步加以探讨。
椪柑果实在采后贮藏过程中,果皮颜色会逐渐由绿转黄。贮藏第30 天,HVEF 处理的CCI 值均大于对照组,其中,200 kV/m-II 处理组与对照组差异显著(P<0.05);贮藏第120天时,3组HVEF处理的CCI 值均显著高于对照组(P<0.05)(图8)。说明HVEF处理可提升果实贮藏后期的色泽。
在贮藏过程中,椪柑果实会逐渐积累乙醇,这是导致果实异味的产生而影响其食用品质的重要原因之一。由图9可知,HVEF处理后的椪柑果实在贮藏过程中乙醇含量大都显著低于对照(P<0.05),其中200 kV/m-Ⅰ的处理效果最佳。说明HVEF 处理能有效抑制果实贮藏过程中乙醇含量的升高,延缓果实风味品质的下降,在贮藏后期效果更为明显。

图6 HVEF处理对椪柑果实贮藏期间果肉可溶性糖含量的影响Fig.6 Effects of HVEF treatments on the soluble sugar contents of ponkan fruit during storage
2.6 总酚含量变化
酚类物质具有强抗氧化活性以及抑制病原菌的作用,是果实中重要的抗性成分。果皮的总酚含量在贮藏过程中呈现先上升后下降的趋势(图10A),果肉的总酚含量则呈现波动状态(图10B)。在整个贮藏过程中,处理组和对照组果皮和果肉总酚含量差异大都不显著(P>0.05)。该结果表明,HVEF处理对椪柑果实的总酚含量无明显的影响。

图7 HVEF处理对椪柑果实贮藏期间有机酸含量的影响Fig.7 Effects of HVEF treatments on the organic acid contents of ponkan fruit during storage

图8 HVEF处理对椪柑果实贮藏期间果皮色泽变化的影响Fig.8 Effects of HVEF treatments on the rind color of ponkan fruit during storage

图9 HVEF处理对椪柑果实贮藏期间乙醇含量的影响Fig.9 Effects of HVEF treatments on the ethanol content of ponkan fruit during storage

图10 HVEF处理对椪柑果实贮藏期间总酚含量的影响Fig.10 Effects of HVEF treatments on the total phenolic contents of ponkan fruit during storage
2.7 IAA 和ABA 含 量 变 化
综上表明,200 kV/m-Ⅰ在降低椪柑腐烂率、减少失重率、降低异味成分乙醇含量等方面均有积极作用,因此,对200 kV/m-Ⅰ处理的果实进一步开展IAA 和ABA 含量测定。由图11 可见,随着贮藏时间的延长,椪柑果实IAA含量呈现先升高后降低的变化趋势,在贮藏第60天时达到峰值;200 kV/m-Ⅰ的HVEF处理显著提高了果实在贮藏期间的IAA水平,与对照组间存在显著差异(P<0.05)。

图11 HVEF处理对椪柑果实贮藏期间IAA含量的影响Fig.11 Effects of HVEF treatment on the IAA content of ponkan fruit during storage
在贮藏过程中,椪柑果实ABA 含量持续上升,其中,前60 d的上升幅度较大,后期变化较为平缓。而200 kV/m-Ⅰ的HVEF处理后的果实ABA含量在第30 天迅速上升到峰值(P<0.05),然后下降且略低于对照,但差异不明显(P>0.05)(图12)。
2.8 HVEF 处理对果实细胞结构的影响
透射电镜观察结果表明,HVEF 处理后果实表皮细胞的脂粒颜色加深,脂粒的体积和数量均有所增加。整个脂粒的结构受到一定程度的挤压和变形,但这种损伤在处理后15 d时可得到一定程度的修复,同时,HVEF处理的细胞腔内线粒体和叶绿体的数量多于CK(图13)。该结果表明,HVEF处理对果实表皮细胞造成了一定的损伤,其损伤程度轻微且在果实的修复能力范围内,从而可能诱导了果实的创伤胁迫和修复反应,这可能也是果实ABA、IAA含量升高的原因之一。

图12 HVEF处理对椪柑果实贮藏期间ABA含量的影响Fig.12 Effects of HVEF treatment on the ABA content of ponkan fruit during storage
3 讨论
目前,HVEF 技术已经在油桃[8]、香蕉[9]、黄冠梨[10]、蔓越莓[11-12]、苹果[19]、梨[19]等水果的保鲜中开展研究。本研究筛选出了适用于椪柑果实的HVEF处理,参数为200 kV/m 单次处理2 h。前人的研究结果表明,HVEF具有杀菌作用,能改变膜电位[4]、影响呼吸系统电子传递[5]、产生臭氧杀菌[6]、引起细胞膜穿孔[7]等。本研究中,HVEF处理后椪柑果实腐烂率有所下降,同时果实表面菌落数也降低,表明HVEF处理效果可能与其杀菌作用有关,这与前人的研究结果[3-7]也相一致。
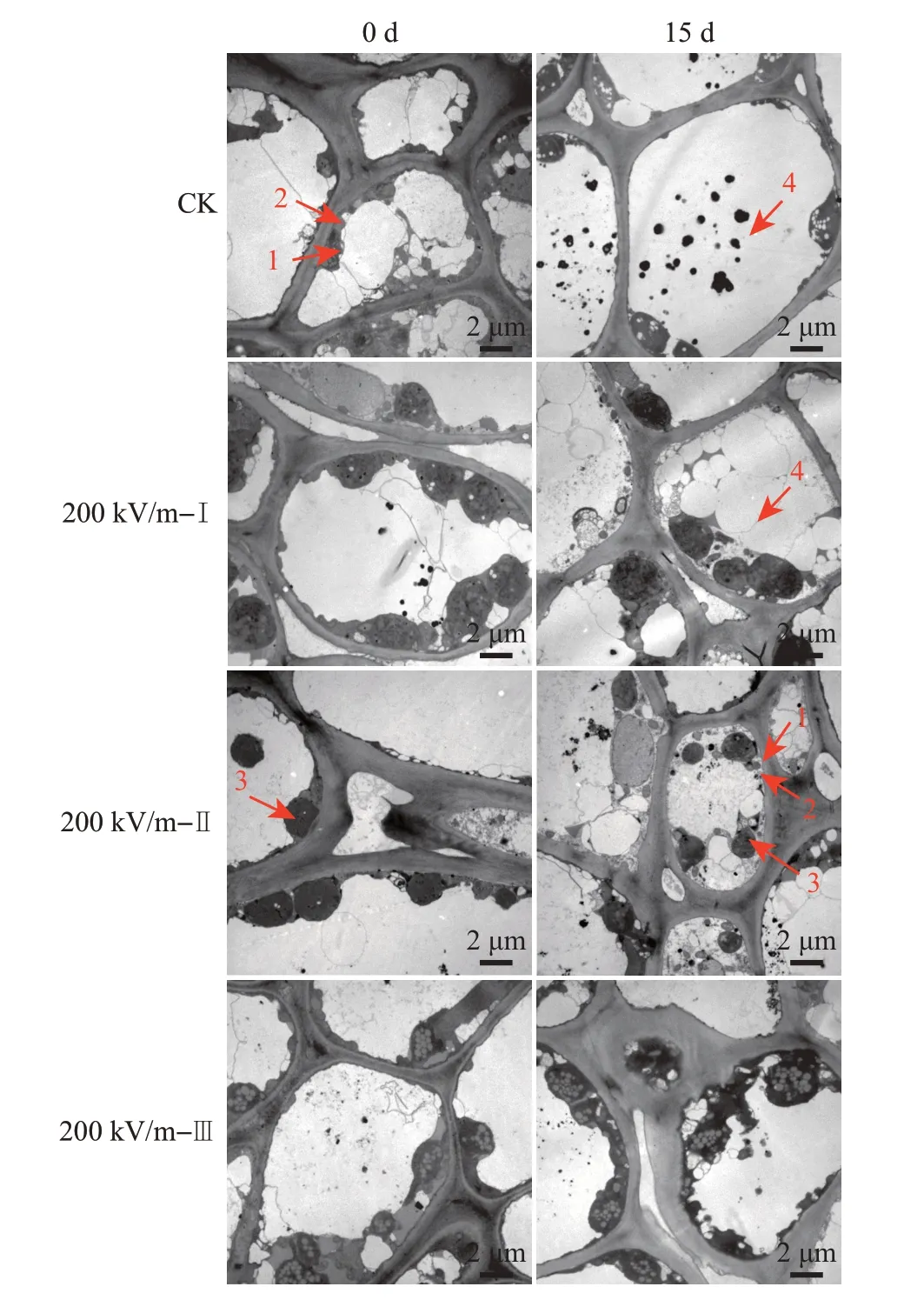
图13 HVEF处理下果实表皮细胞的超微结构Fig.13 Cellular ultrastructure of ponkan fruit peel under HVEF treatment
对果实的生理调节作用是HVEF 的另一作用机制[20]。本研究中,HVEF 处理降低了椪柑采后呼吸速率和失重率,提高了葡萄糖和果糖含量,减少了蔗糖含量的下降,抑制了果肉中乙醇的产生,而且提高了贮藏后期的果皮色泽,表明HVEF 处理在维持果实品质方面具有积极作用。椪柑属于非呼吸跃变型果实,生长素(IAA)和脱落酸(ABA)是调控柑橘果实采后生理变化的重要激素。其中,生长素类物质对于维持柑橘采后新鲜度具有重要作用,目前,生长素类物质2,4-二氯苯氧乙酸(2,4-D)已成为柑橘采后保鲜的重要成分之一[21]。HVEF 处理显著提高了整个贮藏过程中的IAA含量,从而延缓果实衰老,可能也是其保鲜效果优良的机制之一。ABA 与植物的抗逆有着密切关系。在本研究中,HVEF使椪柑果实ABA含量在贮藏早期明显升高,根据前人的研究结果,HVEF会导致细胞膜结构破坏[22],因此,推测HVEF对椪柑果实细胞具有类似于逆境的作用,从而诱导ABA含量的短暂上升。
本文仅探讨了单独使用HVEF处理对椪柑果实的保鲜效果。结果表明:HVEF 处理具有一定的防腐作用,但是并不能完全控制采后腐烂,与防腐保鲜剂相比还有较大差距。但是,HVEF 在降低呼吸和失重率、维持可溶性糖含量、改善色泽、降低乙醇积累等方面具有积极作用,在椪柑的采后保鲜和品质维持中具有潜在的应用价值。因此,如何将HVEF 与其他保鲜方法联用,进一步提高HVEF 的防腐保鲜效果以满足生产中的需求,值得进一步的试验研究。此外,对于HVEF 的作用机制还需要进一步的深入研究,如IAA、ABA 以及更多其他激素在HVEF 保鲜中起着怎样的作用以及如何作用等。HVEF 处理对椪柑果实是否存在着抗性诱导、微创伤和修复等作用,也有待更深入的探讨。
4 结论
本研究发现HVEF处理能降低椪柑果实采后贮藏期间的腐烂率,其中200 kV/m 单次处理2 h 效果最佳。HVEF处理对椪柑果实的保鲜可能存在2方面作用:一方面,HVEF处理降低了果皮表面病原菌数量;另一方面,HVEF处理降低了果实的失重率和呼吸速率,延缓了可溶性糖的下降,提升了果实贮藏后期的色泽,减少了椪柑果实乙醇的积累,并对果皮细胞结构产生影响,同时,提高了贮藏期果实IAA和贮藏早期ABA激素水平。
