甜樱桃采后贮藏环境中病原菌的分离鉴定及其致病力研究
2020-04-22王凤丽裘纪莹戴美学陈蕾蕾赵双枝辛雪周庆新
王凤丽,裘纪莹,戴美学,陈蕾蕾,赵双枝,辛雪,周庆新*
(1.山东师范大学生命科学学院,济南250014;2.山东省农业科学院农产品研究所/山东省农产品精深加工技术重点实验室/农业农村部新食品资源加工重点实验室,济南250100)
甜樱桃是蔷薇科(Rosaceae)李亚科(Prunoideae)樱属(Cerasus)植物,其果实外观红亮剔透,皮软多汁,营养丰富,具有抗癌、预防心脑血管疾病等功效,被誉为“生命之果”[1-2]。甜樱桃起源于欧洲和西亚,自19世纪70年代传入我国,最早在山东烟台种植,紧接着在辽宁、河北、天津、北京扩展种植,20世纪80年代后甜樱桃在我国的种植面积逐渐成倍增加,到2017年其种植面积已达20万hm2,产量约为110万t,居世界第一[3-5]。甜樱桃品种繁多,在我国种植的甜樱桃品种主要包括红灯(Hongdeng)、美早(Tieton)、红蜜(Hongmi)、先锋(Van)、萨米脱(Summit)、布鲁克斯(Brooks)等50多个品种,以及通过杂交选育和后代选育的早熟或中晚熟新品种[6-7]。在甜樱桃种植过程中,病害是影响产量和品质的主要原因,包括非侵染性病害和侵染性病害。非侵染性病害主要由冻害及缺素所致;侵染性病害主要包括病毒性病害,穿孔病、根癌病等细菌性病害,根腐病、褐腐病、青霉病、灰霉病等真菌性病害。其中,真菌性病害是主要的侵染性病害[8-10]。在种植期早预防、早发现并结合一定的农业防治和药剂防治措施,会大大减少樱桃病害的发生。尽管有了种植期的防治和保护措施,但仍有不少病原菌不可避免被带入采后储运环节,樱桃采后的病害问题也越来越受到研究者们的重视。由于甜樱桃的收获季节环境温度偏高、空气湿度较大,其采后腐败和损失问题愈加严重。由微生物侵染引起的侵染性真菌病害是甜樱桃采后储运过程中腐烂衰败的重要原因之一,往往在田园中就已覆盖果实表面,在樱桃采摘、运输、销售过程中伺机侵染,随着时间推移进一步侵染到周围健康果实,造成严重的腐烂现象。已报道的侵染甜樱桃的病原真菌有链格孢菌属、葡萄孢属、青霉属、镰刀菌属、曲霉属等。王楚等[11]从山西地区低温贮藏的甜樱桃中分离出草酸青霉(Penicillium oxalicum)和葡萄孢属(Botrytis sp.)真菌。田亚晨等[12]从山东烟台地区的采后腐烂樱桃中分离出燕麦赤霉菌(Gibberella avenacea)、总状毛霉菌(Mucor racemosus)、三线镰刀菌(Fusarium tricinctum)、互生链格孢菌(Alternaria alternata)、奥桑青霉菌(Penicillium polonicum)和烟曲霉菌(Aspergillus fumigatus)等6种真菌。赵远征等[13]对辽宁省大连市大樱桃黑斑病进行了病原菌鉴定,确定其病原菌为互生链格孢(Alternaria alternata),该属病原菌可以直接侵染或通过自然孔口和伤口侵染樱桃果实和叶,其中,果实发病尤为严重,在个别地区可达75%以上。
近年来,针对甜樱桃采后保鲜技术的相关研究也不断增多[4,9,14-17],但基于储运过程中病原菌的分离鉴定及其特性研究相对较少。本研究针对山东省济南市某樱桃种植专业合作社生产的甜樱桃,在采后储运、低温贮藏过程中发生的病原菌进行分离鉴定,通过研究温度、pH 值等环境因子对其生长特性的影响和致病力分析,筛选出1 株贮藏期易发生的耐低温、致病力强的互生链格孢NCPS1,为甜樱桃采后低温储运及防腐保鲜技术研发等提供了重要的理论依据。
1 材料与方法
1.1 材料与仪器
供试甜樱桃:品种为‘红灯’,购自山东省济南市长清区,从产地快速运输到实验室,选择颜色和大小均匀、无机械损伤的九成熟樱桃果实预冷24 h后,放入1 ℃冷库中贮藏,贮藏期间挑出腐烂樱桃和裂果并进行病原菌分离。
试验仪器:LRH-150-MS 霉菌培养箱(广东省韶关市泰宏医疗器械有限公司);ZHWY-200H恒温培养振荡器(上海智城分析仪器制造有限公司);SW-CJ-2D 双人净化工作台(江苏省苏州净化设备有限公司);AH-2 OLYMPUS 电子显微镜(日本奥林巴斯株式会社)。
1.2 试验方法
1.2.1 病原菌的分离纯化
选取裂果或腐烂樱桃,采用组织分离法[18]和划线培养法分离病原菌。用75%的乙醇擦拭樱桃果实表面进行消毒,风干后取病害组织与健康组织交界处约2 mm×2 mm大小果皮,在0.05%次氯酸钙溶液中浸泡10 min,用无菌滤纸浸干,将其接种到马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基上,每个病症3 皿,于28 ℃培养箱中黑暗培养,2 d后取菌丝边缘转接,直至分离出纯培养物。对于腐烂成团的病害樱桃果实,直接采用划线培养法进行分离纯化。纯培养物斜面(NCPS1~NCPS6)于4 ℃冰箱中保藏,备用。
1.2.2 病原菌的形态学观察
从菌落边缘取菌块分别接种到PDA 和麦芽汁琼脂(malt extract agar,MEA)培养基上,观察菌落生长形态。分别取在PDA平皿上培养7 d的病原菌菌丝和孢子,在电子显微镜下进行观察,记录显微形态,进行鉴定[19]。
1.2.3 病原菌的分子生物学鉴定
取病原菌菌块转接至马铃薯葡萄糖液体培养基上,于120 r/min、28 ℃摇床上培养3 d,挑取部分菌丝块送至江苏金唯智测序中心,测定其基因间隔区ITS1/ITS4序列,并进行分子生物学分类鉴定。
1.2.4 病原菌的进化树构建
将病原菌序列与GenBank 中的已知序列进行同源性比对,结合形态学特征鉴定病原菌种类。
1.2.5 病原菌的生物学特征检测
生长速率:以7 d 内在PDA 培养基上菌落直径大小表示。于PDA平皿中央接种直径为5 mm的病原菌菌饼,28 ℃培养7 d,采用十字交叉法[20]测量菌落直径,每个处理设置3个平行实验。
培养温度:于PDA 平皿中央接种直径为5 mm的病原菌菌饼,分别置于0、2、4、6、8、15、20、25、30、35 ℃的恒温培养箱中培养,7 d后测量菌落直径,每个处理设置3个平行实验。
培养pH:于PDA平皿中央接种直径为5 mm的病原菌菌饼,PDA 培养基的pH 值设定为2、4、6、8、10,每个处理设置3个平行实验。
1.2.6 病原菌的致病力分析
参照文献[21-22]的方法:将健康的樱桃果实用75%乙醇擦拭消毒,并用无菌水清洗后,自然风干。在樱桃果实赤道中央打取深3 mm、直径3 mm的小孔。取直径3 mm 左右的病原菌菌饼,接种到樱桃孔口处,将接种的樱桃放入保鲜盒中,28 ℃培养3 d 后观察发病情况。每个处理20 个果实,试验重复3 次。病斑测量采用十字交叉法,病斑直径/mm=测量直径/mm-3 mm。
致病力分级标准参考吴建圆等的方法[23]:强致病力,病情指数≥60.0;中等致病力,30.0≤病情指数<60.0;弱致病力,病情指数<30.0。
1.3 数据处理
采用SPSS 22.0 软件进行相关性分析,采用Origin 9.0软件作图。
2 结果与分析
2.1 甜樱桃采后病原菌的分离纯化及菌落形态
从采后腐烂樱桃中分离到6 株病原真菌(NCPS1~NCPS6),28 ℃条件下分别在PDA 和MEA培养基上培养,其菌落形态如图1所示。3~7 d后,6 株病原菌在2 种培养基上生长旺盛,其中NCPS1、NCPS3 在PDA 培养基上菌落平展,呈棉絮状,生长速度快,背面灰褐色,菌丝体埋生或表生(图1A1、A3),在MEA 培养基上菌落呈均匀白色(图1B1、B3);NCPS2在PDA培养基上菌落呈灰白色(图1A2),在MEA 培养基上菌落呈白色(图1B2);NCPS4在PDA培养基上菌落为黄绿色,有白色边缘(图1A4),在MEA 培养基上菌落为浅橘黄色,有白色边缘(图1B4);NCPS5在PDA培养基和MEA培养基上菌落为橄榄绿色,绒毛状,平铺(图1A5、B5);NCPS6在PDA培养基和MEA培养基上菌落为灰白色,散生,绒毛状,菌丝体部分表生,有明显菌丝束(图1A6、B6)。
2.2 甜樱桃采后病原菌的显微形态

图1 病原菌的菌落形态Fig.1 Colony morphology of pathogens
采用电子显微镜观察6株分离病原真菌的显微形态,结果如图2所示。NCPS1、NCPS2的菌丝呈淡褐色,表面光滑,有隔膜,菌丝宽2~4 μm(图2A1~A2)。NCPS1分生孢子梗端生或侧生,圆柱形,2~7个隔膜,直或弯曲(图2B1);NCPS2分生孢子单生或链生,倒棒形,褐色,光滑,3~7个横隔膜,1~4个纵隔膜,1~2 个斜隔膜,孢身(12~42)μm×(7~13)μm,具短喙,生于分生孢子的端部,喙及假喙(5~16)μm×(3~4)μm(图2B2)。NCPS3的分生孢子梗与NCPS1、NCPS2 无明显区别,但是孢子稍大,(20~55)μm×(10~23)μm(图2A3、B3)。NCPS4 菌丝无色,光滑,有隔膜,直径2~3 μm,分生孢子梗直立,光滑,顶端具二轮、对称帚状分枝,梗上着生分生孢子链(图2A4);分生孢子为椭圆形或卵形,单胞,光滑,多为无色,直径3~3.5 μm(图2B4)。NCPS5菌丝无色,光滑,直径4~9 μm(图2A5);分生孢子梗多侧生于菌丝,偶分枝,分隔处不缢缩,直立,平滑或细疣,褐色或橄榄褐色,具孢痕,(90~300)μm×(3~8)μm,分生孢子顶生或侧生,淡褐色,具分支的孢子链,卵形至圆筒形,平滑,1~3 个隔膜,(10~18)μm×(5~8)μm(图2B5)。NCPS 6 菌丝无色,光滑,具隔膜,直径1~2 μm(图2A6);产孢瓶体单生,不分枝,光滑,无色或淡褐色,(10~30)μm×(0.5~2)μm,瓶生孢子圆柱形,成链,光滑,无色透明,(4~7)μm×(1~2)μm(图2B6),厚垣孢子与有性态孢子未观察到。
2.3 樱桃采后病原菌的基因间隔区(internal transcript space,ITS)序列分析
2.3.1 ITS 序列扩增结果
6株病原真菌通过聚合酶链式反应(polymerase chain reaction,PCR)技术进行ITS序列扩增,其琼脂糖凝胶电泳检测结果如图3所示。PCR条带大小约550 bp,可用于后续的序列测定。
2.3.2 ITS 区rDNA 序列系统进化树构建结果
将6 株病原菌的ITS 序列测序结果在NCBI(https://www.ncbi.nlm.nih.gov)上进行BLAST比对,筛选出与GenBank 中相似性高的序列,用MEGA 5.0软件的最大简约法(maximum parsimony,MP)构建进化树。结果如图4所示,6株病原菌分别为互生链格孢(Alternaria alternata)NCPS1和NCPS2、链格孢(Alternaria sp.)NCPS3、扩展青霉(Penicillium expansum)NCPS4、禾 生 枝 孢(Cladosporium herbarum)NCPS5 和 土 栖 帚 枝 霉(Sarocladium terricola)NCPS6。其中链格孢属有3 株,与田亚晨等[12]从烟台地区采后甜樱桃中分离到的病原菌含有较多的链格孢属菌一致,而与姚婷等[24]报道的5 株采后樱桃果实病原菌以及王楚等[11]报道的2株采后甜樱桃腐烂病原菌没有相同的菌株,说明甜樱桃感染的病原菌具有一定的地区差异性。
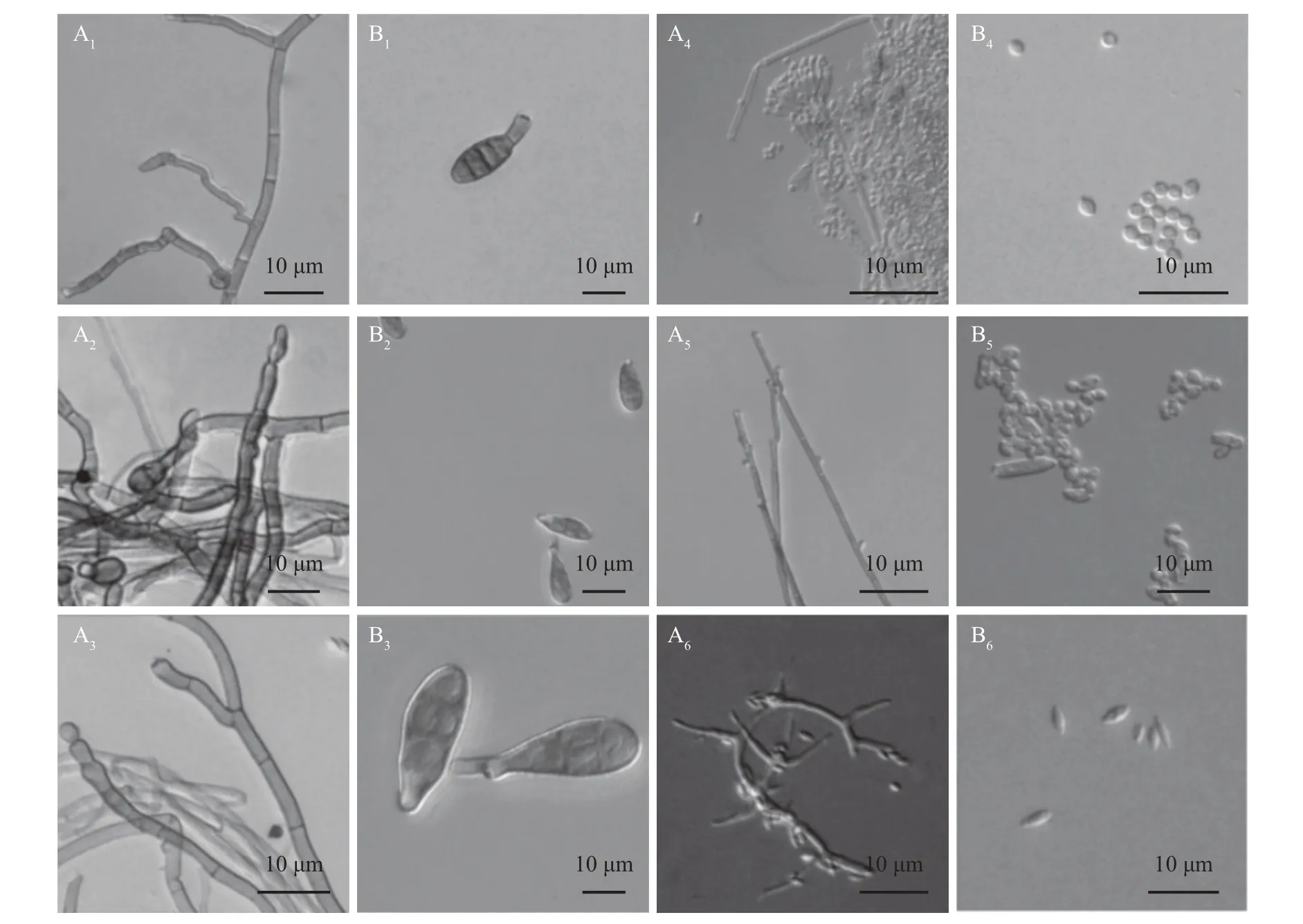
图2 病原菌的显微形态Fig.2 Microstructure of pathogens

图3 PCR产物的琼脂糖凝胶电泳检测结果Fig.3 PCR products detected by agarose gel electrophoresis
2.4 樱桃采后病原菌的生物学特性
为深入了解环境因子对主要病原菌生长的影响,本研究从生长速率、生长温度、最适生长pH值3个方面对6株病原真菌(NCPS1~NCPS6)在不同环境因子条件下生物学特性进行了分析。
菌丝生长速率以7 d内在PDA培养基平板上的菌落直径大小表示。6株病原菌在28 ℃培养7 d的生长速率如图5A所示:NCPS3的生长速率最快,其次是NCPS2、NCPS1、NCPS4、NCPS5、NCPS6。pH值对病原菌生长的影响见图5B:NCPS1~NCPS6菌株在pH 4~10 之间均可生长,最适生长pH 值为8,其中NCPS4 在pH 2 时仍可以较好地生长。培养温度对病原菌生长的影响见图5C:除NCPS4 的最适生长温度为30 ℃外,其余5株菌的最适生长温度均为25 ℃,当培养温度达到35 ℃时,仅NCPS1 和NCPS4 能生长;NCPS1 和NCPS2 在0~8 ℃温度范围内均可生长,相比其他菌株具有最强的耐寒性;NCPS3 在2~8 ℃温度范围可生长,具有较好的耐寒性;NCPS5在4~8 ℃温度范围可生长,而NCPS4和NCPS6 在0~8 ℃温度范围内不能生长。可见,链格孢菌属菌株NCPS1 和NCPS2 具有较强的耐寒特性,在低温贮藏环境中容易暴发病害。

图4 以ITS rDNA基因序列为分子标记的6株病原菌的系统进化树Fig.4 Phylogenetic tree for each fungal strain based on ITS rDNA sequence
2.5 病原菌致病力比较结果
将病原菌回接甜樱桃3 d 后,可直观地观察到不同病原菌病斑直径大小,通过对果实病斑直径统计和病情指数计算,进而分析6 株病原菌的致病力差别。6株病原菌在樱桃果实上的致病力结果如表1 和图6 所示:NCPS1、NCPS2、NCPS3 为强致病力菌株,NCPS4、NCPS5为中等致病力菌株,NCPS6为弱致病力菌株。结合菌株生长速率(图5)发现,致病力与生长速率呈明显的正相关。这与关波等[25]从新疆石河子地区甜樱桃上分离得到的3株菌的生长速率与致病力相关的结论一致。
3 讨论与结论
本研究从采后甜樱桃的储运、低温贮藏过程中分离出6株病原菌,综合形态学和ITS序列分析,分别将其鉴定为互生链格孢(Alternaria alternata)NCPS1和NCPS2、链格孢(Alternaria sp.)NCPS3、扩展青霉(Penicillium expansum)NCPS4、禾生枝孢(Cladosporium herbarum)NCPS5 和土栖帚枝 霉(Sarocladium terricola)NCPS6,其 中 禾 生 枝 孢NCPS5 和土栖帚枝霉NCPS6 在甜樱桃上的病害尚未见报道,该菌生长速度较慢,致病力较弱。链格孢、扩展青霉[26]是已报道的引起甜樱桃果实腐烂损害的病原菌,其中链格孢菌可引起甜樱桃黑斑病,发病率高,危害非常严重[27],这与本文中分离出的3株链格孢真菌较其他菌生长速率快,耐低温,从而导致发病率高、致腐性强的结论一致。
甜樱桃采后感染的病原菌大多源于从田间携带至储运环节中,当环境适于病原菌生长时,果实的腐烂迅速爆发。本研究报道的6株甜樱桃采后病原菌中有3 株为链格孢属菌,这与田亚晨等[12]从烟台地区甜樱桃采后分离到的病原菌中含有较多的互生链格孢菌的结果一致,而与姚婷等[24]和王楚等[11]报道的甜樱桃采后腐烂病原菌没有相同的菌株,说明不同甜樱桃产地的果实致病菌具有一定的地区差异性,这可能与本地区的土壤环境及气候有一定关系[25]。因此,在樱桃主产区应明确各自地区田间的主要致病菌,了解其发病规律,采收前采取相应的预防措施,尽可能地减少带菌储运。此外,也不排除在不同的储运环境中可能存在不同的易侵染甜樱桃果实的致病菌。
不同种属病原菌甚至同一种属病原菌中不同菌株的生物学特性和致病力不完全相同。在本研究分离鉴定的6株病原菌中,互生链格孢NCPS1致病力最强,生长速率快,耐低温胁迫,是甜樱桃冷库贮藏过程中需要重点防范的病原菌,除采取低温措施之外,进入冷库之前有必要采用国家规定范围内的可食性抑菌剂或其他措施对樱桃进行预处理。综上,本研究为采后甜樱桃的冷库贮藏及配套保鲜技术的研发提供了重要的理论依据。
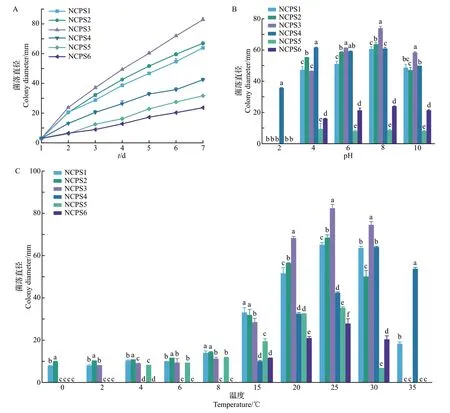
图5 6株病原菌的生物学特性Fig.5 Biological characteristics of six pathogens

表1 甜樱桃采后病原菌的致病力Table 1 Pathogenicity of pathogens on postharvest sweet cherry fruits

图6 病原菌在甜樱桃果实上的致病力分析Fig.6 Pathogenicity analysis of pathogens on sweet cherry fruits
