264例儿童使用抗肿瘤药的不良反应分析
2020-04-22邢亚兵马姝丽
张 淼,邢亚兵,马姝丽
(郑州大学附属儿童医院/河南省儿童医院/郑州儿童医院药学部,郑州 450018)
儿童肿瘤作为一个全球性的公共卫生问题,已经成为仅次于儿童意外死亡的第二大儿童死亡原因[1]。根据国家癌症中心数据,2000~2010年我国儿童肿瘤发病率为8.71/10万人,死亡率为3.63/10万人[2]。近年来随着抗肿瘤药的发展,儿童肿瘤治疗也取得了显著成就。根据2017年美国统计数据,14岁以下患儿5年生存率为83.0%,其中淋巴瘤、急性淋巴细胞白血病患儿5年生存率超过90.0%[3]。但是儿童作为一个特殊群体,肝肾功能尚未发育完全,容易因抗肿瘤药蓄积而出现较多毒副作用,如造血功能抑制、胃肠道反应、神经毒性等[4-5]。笔者对某儿童医院2015~2019年收集的264例抗肿瘤药不良反应(adverse drug reaction,ADR)进行统计分析,以期为临床合理用药提供参考。
1 资料和方法
1.1 资料来源
回顾分析某儿童医院不良反应监测中心2015年1月~2019年12月收集的264例抗肿瘤药不良反应,并对患儿的一般状况、药品名称、给药途径、累及系统、发生时间、因果关系、对疾病影响、ADR类型等进行分析。
1.2 判断标准
根据国家药品监督管理局制定的ADR判定标准判断[6]。判定标准:① 用药与ADR的出现有无合理的时间关系。② 反应是否符合该药已知的ADR类型。③ 停药或减量后,反应是否消失或减轻。④ 再次使用可疑药品是否再次出现同样反应/事件。⑤ 反应/事件是否可用所用药物的作用、患者病情的进展、其他治疗的影响来解释。符合①~⑤选项,则关联性评价为“肯定”;符合①、②、③、⑤,评价为“很可能”;符合①~③,评价为“可能”。其中肯定、很可能、可能即为ADR。
严重ADR判定标准[7]:① 导致死亡,危及生命(呼吸困难、昏迷、休克等)。② 致癌、致畸、致出生缺陷。③ 导致住院或住院时间延长。④ 其他重要医学事件等。
新的ADR判定标准:① 该厂家产品说明书中未载明的ADR。② 说明书中已有描述,但发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的ADR。
2 结果
2.1 性别和年龄分布
264例ADRs中,男童139例,女童125例,男童比例略高于女童。患儿最小年龄5个月,最大年龄16岁,平均年龄为(5.46±2.92)岁,0~4岁患儿ADR占比最高(56.44%),其次为5~9岁患儿(31.44%)。详见表1。
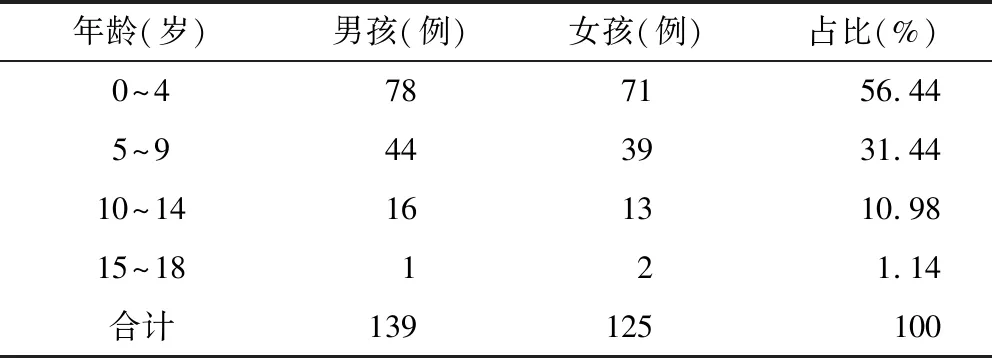
表1 患儿ADR的性别与年龄分布
2.2 涉及药品名称
264例ADRs中,发生ADR前3位的药物分别为阿糖胞苷42例(15.91%),甲氨蝶呤34例(12.88%),环磷酰胺28例(10.61%)。详见表2。

表2 引起ADR的抗肿瘤药品分布
2.3 给药途径
264例ADRs中,静脉滴注(泵内滴注)给药216例(81.82%),肌内注射给药37例(14.02%),口服给药10例(3.79%),皮下注射给药1例(0.38%)。
2.4 ADR累及系统损害
264例ADRs中,累及系统损害前3位分别为:血液系统96例(36.36%),临床表现为骨髓抑制、粒细胞缺乏、血浆纤维蛋白原减少、白细胞减少等;消化系统49例(18.56%),临床表现为呕吐、腹痛、肝酶升高等;皮肤及其附件35例(13.26%),临床表现为皮疹、瘙痒、局部组织红肿等。详见表3。

表3 ADR累及系统损害和临床表现
2.5 ADR发生时间
264例ADRs中,在用药3天内发生119例(45.08%),其中用药过程中发生69例(26.14%);用药3~5天发生47例(17.80%);用药5~7天发生43例(16.29%);用药7~14天发生48例(13.18%);用药大于14天发生7例(2.65%)。详见表4。

表4 患儿出现ADR的时间分布
2.6 ADR因果关系评价
264例ADRs中,判定为“肯定”有关的8例(2.33%),“很可能”有关的174例(65.91%),“可能”有关的82例(31.06%)。
2.7 对患儿疾病的影响
264例ADRs中,因ADR引起住院延长者85例(32.20%),无明显变化者131例(49.62%),无法评判者48例(18.18%)。
2.8 发生严重及新的ADR
264例ADRs中,一般ADR 136例(51.52%),无新的ADR;严重ADR 128例(48.48%),其中新的ADR 2例(0.76%)。
3 讨论
本研究报道的ADRs中,在性别构成方面,男童比例高于女童,原因可能是男童和女童对抗肿瘤药的敏感程度不同所致[8-9]。但是,本文报道案例较少,不能全面反映ADR分布的性别差异,仍需进一步研究。在年龄方面,0~4岁患儿发生ADR较多,占56.44%。原因可能是:① 0~4岁患儿发病率较高[10],患儿基数大。② 患儿肝肾功能发育尚未完善,药物代谢和排泄速度较慢,药物容易蓄积[9]。因此,应该根据患儿年龄、体重、肝肾功能状况等因素个体化用药,以减少患儿的ADR发生率。
264例ADR报告中,阿糖胞苷ADR占比最高,其次分别为甲氨蝶呤和环磷酰胺。阿糖胞苷是细胞增殖期的抗代谢药物,可抑制细胞DNA合成,干扰细胞增殖,临床主要用于治疗急性白血病,其中对急性粒细胞白血病疗效最好,ADR主要为骨髓抑制[11]。甲氨蝶呤属于抗叶酸类抗肿瘤药,通过抑制二氢叶酸还原酶阻碍肿瘤生长,临床上主要用于治疗急性白血病、头颈部肿瘤、骨肿瘤等,ADR主要为胃肠道反应和骨髓抑制[12]。由于白血病在儿童肿瘤中占比最高,阿糖胞苷和甲氨蝶呤使用较多,故骨髓抑制和胃肠道ADR较多。因此,在应用阿糖胞苷和甲氨蝶呤期间,应注意监测造血功能,以防出现严重ADR。
给药途径方面,264例ADRs中静脉给药和肌内注射占253例,与文献中报道[13]的绝大多数ADR由注射给药引起相符,这是抗肿瘤药本身剂型决定的。所有ADRs中,给药途径合理的有263例(99.62%),不合理的1例为培门冬酶注射液皮下注射给药(该案例属于ADE),培门冬酶说明书明确指出需肌内注射或静脉滴注给药。张娟莉等[14]报道,培门冬酶ADR主要表现为恶心、呕吐、腹泻、腹痛、凝血酶原时间延长和凝血因子Ⅰ异常等。培门冬酶皮下给药后,患儿全身皮肤黏膜出现红色皮疹,该ADE是否与皮下注射用药相关,仍需进一步探究。
抗肿瘤药引起的ADR可累及多个器官或系统,本文报道前3位ADR分别为造血功能抑制、消化道反应和皮肤变态反应,而其他文献报道[13,15]中消化系统反应较为多见。造成这一现象的原因一方面是现有报道多为成人用药状况,不能真实反映儿童用药特征;另一方面是由于造血功能抑制多为迟发性ADR,本院患儿住院时间较长,出现血液功能异常能及时发现。本文报道的ADR发生在用药3天内和5~14天占比较高,可能原因是消化系统和皮肤系统ADR通常在用药早期内发生,而骨髓有代偿能力发生ADR较晚[13]。因此患儿用药期间,尤其在用药早期和用药1~2周,应注意监测患儿的各项生化指标变化,以减少不良反应对器官的损害。
264例ADRs中,引起的造血功能抑制、消化系统损害、神经系统损害等严重ADR较多,导致约1/3的患儿住院时间延长。造血功能抑制是使用抗肿瘤药最严重的ADR[16],本文报道中主要表现在骨髓抑制、粒细胞缺乏、血浆纤维蛋白原减少、白细胞减少等。虽然该类型ADR严重,但是该院预防措施比较完善,未造成患儿病情恶化或死亡。
4 不足及总结
笔者对某儿童医院近5年来使用抗肿瘤药出现的ADR进行了归纳分析,汇总了常用抗肿瘤药的ADR数据,以期为医护用药提供参考。但是,本文收集到的案例较少,不能全面反映儿童应用肿瘤药物的状况。该院所有ADR均为自愿上报,上报人员通常为一线医护人员,他们工作繁重琐碎,漏报、错报、信息不全时有发生[17]。此外,儿童由于肝肾功能尚未发育完全,较成年人更容易发生ADR,应该严格按照说明书推荐剂量和给药途径合理用药。对于超说明书用药,应有循证依据。同时,应做好患儿家长和护理人员的宣教工作[18],让他们在用药前充分认识到相关药品ADR,做到及时发现、及时处理。
