施加石灰石粉和微生物肥料对发病山核桃林土壤化学性质和微生物群落的影响
2020-04-22徐秋芳梁辰飞陈俊辉
方 伟,余 晓,王 晶,徐秋芳,梁辰飞,秦 华,陈俊辉
(浙江农林大学环境与资源学院浙江省森林生态系统碳循环与固碳减排重点实验室,浙江杭州311300)
山核桃Carya cathayensis是中国特有的珍贵干果。近年来,山核桃造林面积快速增加,大量施用农药化肥和人为过度经营,山核桃根腐病的发生面积也逐步增大,导致根腐病和干腐病日益严重,造成山核桃林下植被破坏、土壤肥力和pH值下降[1],给农户造成重大经济损失。研究者对山核桃干腐病和根腐病病原菌进行分离鉴定[2-4],证明干腐病的发生与子囊菌门葡萄座腔菌科Botryosphaeriaceae葡萄座腔菌属Botryosphaeria真菌有着密切联系[5],根腐病主要病原菌是尖孢镰刀菌Fusarium oxysporum[6]。土壤酸化、根系腐烂是农业生产连作障碍的常见现象[7-8],也是土壤微生物区系失衡,真菌比例增加的主要原因[9-11]。因此,提高土壤pH值是解决连作障碍的重要手段之一。大量研究表明:在酸性土壤中施用生石灰可提高土壤pH值,调节土壤微生物的数量、分布和组成,对植物的生理机能有较好的促进和改善作用[12-13]。同时,添加有益微生物及菌剂型生物肥料也是改善退化土壤微生物区系的措施之一。杨星[14]研究发现:施用微生物肥料能提高土壤微生物多样性和抑制病原菌的生长;土壤中添加哈茨木霉菌Trichoderma harzianum对辣椒Capsicum annuum、马铃薯Solanum tuberosum、黄瓜Cucumis sativus、花生Arachis hypogaea、白菜Brassica pekinensis等抗病实验表明:哈茨木霉菌对多种农作物有促生和抗病效应[15-17]。而芽孢杆菌Bacillus作为一种生防菌对果树病原菌有较好的抑制效果,其抑制作用是通过菌体及其产生的拮抗物质或分泌水解酶(蛋白酶和纤维素酶)实现的[18]。然而,益生菌在生产中的应用效果差异很大。许多有益菌株在实验室研究效果很好,但应用到大田土壤中则因为难以与土著微生物竞争,很难在土壤中长期发挥其作用。为了解决山核桃林地土壤退化、山核桃干腐病和根腐病等问题,本研究以解淀粉芽孢杆菌为对象,设计了提高土壤pH值、添加有益菌、施用有益菌菌肥等3种调控措施,应用定量PCR以及PCR-DGGE技术,监测调控措施对土壤细菌和真菌结构动态变化的影响以及添加的有益菌在土壤中的存活时间。研究结果对指导目标菌种及其肥料的应用具有重要的实践意义。
1 材料与方法
1.1 试验概况
1.1.1 盆栽土壤与实验材料 试验土壤为浙江省杭州市临安区湍口乡的山核桃林地石灰岩土壤。采样深度为0~30 cm,属阳面山地干腐病和根腐病较严重的山核桃林地土壤,常规施用肥料为氨基酸复混肥料(河南莲花味精股份有限公司),磷、氮、钾质量分数为30%。每年施3次肥,每次用量2 kg·株-1,施肥时间为每年9-10月及3月底和6月。土壤基本理化性质:pH 6.2,有机质16.51 g·kg-1,碱解氮132.20 mg·kg-1, 有效磷 5.81 mg·kg-1, 速效钾 116.60 mg·kg-1。
3种土壤调节材料分别为:①石灰石粉末(CaCO3),采自当地的石灰石矿区;②芽孢杆菌发酵液为浙江省森林生态系统碳循环与固碳减排重点实验室前期筛选的具有抑制核桃干腐病的芽孢杆菌(菌种保藏号: CGMCC11640), 发酵液所含养分为氮 0.236 mg·L-1, 磷 516.960 mg·L-1, 钾 39.000 mg·L-1, 钙 2.310 mg·L-1, 镁 1.680 mg·L-1, 铁 0.077 mg·L-1, 铜 0.002 mg·L-1, 锌 0.067 mg·L-1, 硼 0.092 mg·L-1。 pH 6.82。③复合微生物肥料(江阴市联业生物公司提供),肥料含有芽孢杆菌和哈茨木霉2种有益菌,pH值6.50,总有效活菌数为(菌落形成单位)0.56×108g-1,养分:氮29.6 g·kg-1,五氧化二磷64.2 g·kg-1,氧化钾 11.0 g·kg-1, 有机质 456.7 g·kg-1, 可溶性氨基酸 15.0 g·kg-1。
1.1.2 试验设计 土壤培养试验设置4个处理:①无添加的对照(ck);②添加2.5%(w/w)石灰石粉(LP);③添加芽孢杆菌发酵液(SL);④添加2%(w/w)复合微生物肥料(MCF)。每个处理3个重复。称取过2 mm筛风干土壤4.60 kg于花盆(高26 cm,径24 cm)中,将各个处理加入的材料混合均匀,用蒸馏水调节土壤含水量到田间持水量的30%。菌液处理量取450 g发酵液与水混合,保证与其他处理的水分相等。培养试验开始于2016年11月15日,用塑料薄膜封盖防止水分蒸发过快,同时,隔2 d对沙床补充水分,保证沙子的湿度。盆栽进行过程中定期称量补水,保持盆栽水分含量恒定。培养周期为120 d。
1.1.3 样品采集与分析 在培养开始后20、40、60、120 d进行土壤采集,土样采集深度为5~10 cm,土壤混匀分2份,1份自然风干过1 mm和0.149 mm土壤筛,用于测土壤化学指标:土壤pH(m水∶m土=2.5∶1.0); 有机质用重铬酸钾-硫酸外加热法[19]; 碱解氮用碱解扩散法[19]; 有效磷用碳酸氢钠(NaHCO3)浸提后钼锑抗比色法测定[19];速效钾用醋酸铵浸提然后使用火焰光度计测定[19]。另一份土壤经冷冻干燥处理,使用DNA提取试剂盒提取土壤总DNA,用作分子生物学实验。
1.2 分析方法
1.2.1 土壤总DNA的提取和rDNA的PCR扩增 称取0.50 g冻干土提取总DNA,使用提取试剂盒Power SoiDNA Isolation Kit(Mo Bio,美国); Bovine Serum Albumin(BSA, 20 g·L-1,TaKaRa,中国大连);Goldview(SBS,中国上海);荧光染料SYBR green I(Invitrogen,美国);质粒提取试剂盒,SYBRPremix Ex TaqTM(Takara,中国大连);引物由上海生物工程有限公司合成。DNA提取方法按试剂盒使用说明书,提取的DNA片段经10 g·L-1的琼脂糖凝胶进行电泳检测,用微量分光光度计进行浓度测定[20](NanoDrop ND-1000 spectrophotometer,美国),DNA样品分装并保存于-40℃冰箱。
PCR 用 50 μL 反应体系: 10×Premix Taq 25.00 μL, 引物各 0.50 μL, 模板 DNA 0.75 μL, 0.50 μL BSA(20 g·L-1), 用灭菌超纯水补足至 50.00 μL(PCR 引物见表 1.2)。 扩增程序参考赵天心等[20], 反应设置阴性对照组,经10 g·L-1琼脂糖凝胶电泳检测,然后用Goldview染色,确认其片段大小,保存在-20℃,用于变性梯度凝胶电泳(DGGE)分析。
1.2.2 DGGE染色及凝胶成像分析 使用D-Code TM Universal Mutation Detection System(Bio-Rad,美国)进行DGGE分析,方法参考赵天心等[20]。在体积分数为6%的聚丙烯酰胺和变性梯度40%~60%(V/V)的凝胶上进行电泳[100%变性胶含有7 mol·L-1尿素和40%(V/V)甲酰胺],胶厚度为1 mm,电泳缓冲液为1×TAE,取10.0 L第2轮PCR产物与10.0 L 6×loading buffer混匀后用微量进样器加样,在60℃和80 V条件下电泳 13 h[20-21]。
1.2.3 DGGE谱图分析 电泳结束后,凝胶使用SYBR green I(1∶10 000)染料染色30 min后在 Gel DocTM EQ凝胶成像系统(Bio-Rad,美国)拍照并保存,利用Quantity One 4.6.2(Bio-Rad,美国)软件对图进行数字化分析。条带的数目表明样品的基因型丰富度(Ggenotypic richness,S)[22],用Quantity One软件检测条带的相对亮度即为该基因型的相对多度(Pi)[23]。用基因型丰富度、多样性指数(Shannon-Wiener diversity index,H′)和Pielou均匀度指数(Pielou evenness index,E)表征土壤微生物群落的基因型多样性(genotypic genotypic diversity)特征。
1.2.4 土壤细菌真菌丰度-实时荧光定量 PCR用土壤总DNA作为模板,FR1、FF390(真菌)和338F、 518R(细菌)为引物(表 1), 20.0 μL 反应体系[20]: 2×SYBR Premix Ex TaqTM10.0 μL, 上下游引物各0.2 μL,模板DNA 1.0 μL,灭菌超纯水补足20.0 μL,每个样品3次重复,反应程序具体如下:真菌,预变性95℃3 min;变性95℃ 30 s,退火55℃ 30 s,最后72℃延伸30 s,31个循环;溶解曲线过程(65℃到95℃,0.5℃·s-1);细菌,预变性95℃ 3 min;变性95℃ 30 s,退火56℃30 s,最后72℃延伸30 s,31个循环;溶解曲线过程(65℃到95℃,0.5℃·s-1)。标准曲线制作:用已知种属的阳性克隆子扩增培养后提取质粒DNA,检测其浓度和纯度[D(260)/D(280)]后,将质粒以10倍梯度稀释(10-3~10-8),作为标准样品,计算细菌真菌的基因拷贝数[26]。反应程序和体系反应体系同上。
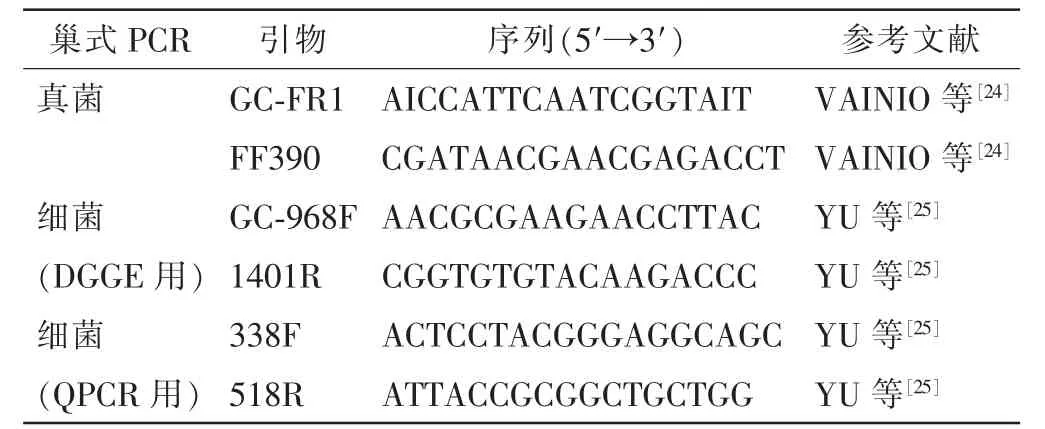
表1 PCR扩增所用引物Table 1 Primers used for PCR amplification
1.3 数据分析
图表使用Excel 2016和SPSS 22.0软件进行数据处理,各处理间比较采用One-way ANOVA分析,差异显著性分析用Duncan法进行数据统计(P<0.05)。DGGE图谱参考余晓等[21]方法用Quantity One软件数字化,用Shannon-Wiener多样性指数(H′)、丰富度指数(D)以及均匀度指数(E)对土壤细菌和真菌多样性进行分析[27]。其计算公式分别为:

式(1)~(3)中:ni为每条电泳条带光密度峰值,N是同一泳道中所有条带光密度峰值的总和,S为每一泳道总共的条带数。光密度峰值通过Quantity One软件分析获取[24]。
2 结果与分析
2.1 不同调控措施对土壤理化性质的影响
表2比较了4个处理在120 d培养周期中对土壤化学性质的影响。在培养周期中,从各指标结果来看,LP处理显著提高了土壤pH值和土壤有机质质量分数(P<0.05),但对土壤其他养分质量分数无显著影响。MCF处理在120 d时显著(P<0.05)降低了土壤pH值,MCF、SL处理与ck显著(P<0.05)提高了土壤有机质和土壤有效磷,同时MCF处理也显著(P<0.05)提高了土壤碱解氮和速效钾,MCF处理降低了土壤pH值(6.29~5.34),而SL处理提高了土壤pH值。
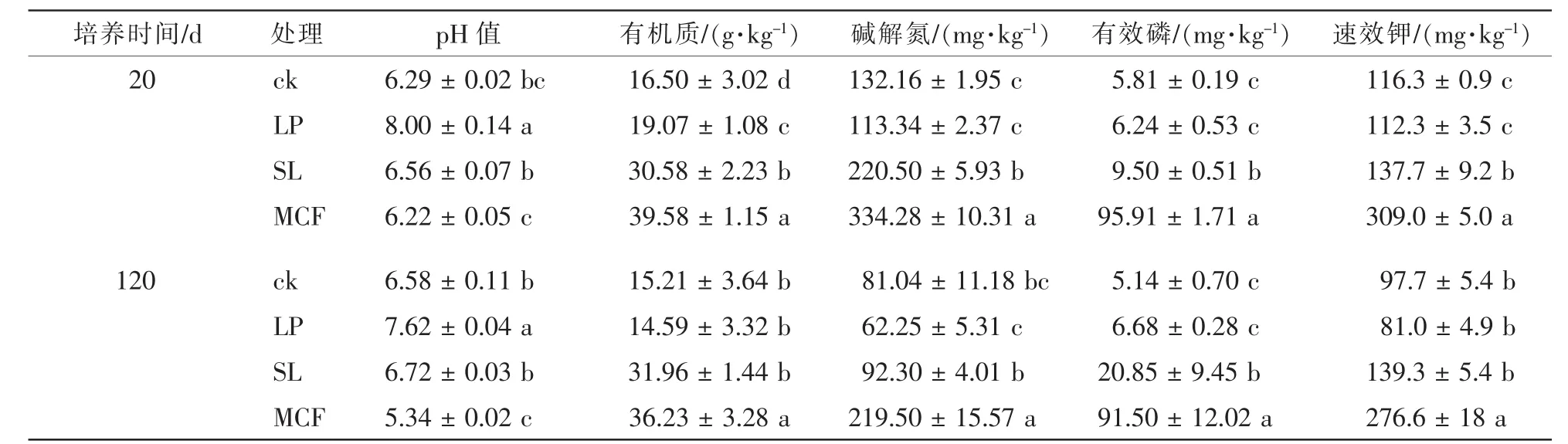
表2 不同调控措施对土壤养分的影响Table 2 Effects of different treatments on soil nutrients
2.2 不同调控措施对土壤细菌和真菌丰度影响
2.2.1 调控措施对土壤细菌丰度的影响 120 d培养过程中土壤细菌丰度变化如图1。从随培养时间细菌丰度变化来看,4种处理土壤细菌丰度总体呈下降趋势。SL处理细菌数量呈先增加再减少趋势,在20 d时与MCF处理差异不显著,20 d后SL处理和其他3种处理比较都存在显著差异(P<0.05),在40 d达到最高6.02×108g-1。MCF处理细菌丰度在20 d时高于其他3种处理,培养过程中呈下降趋势,60 d后和ck比较无显著差异(P>0.05)。LP处理在20~60 d均提高了土壤细菌丰度,120 d时和ck比较差异不显著(P>0.05)。结果表明:SL处理在整个培养周期中显著(P<0.05)提高了土壤细菌数量,MCF处理在20~40 d显著(P<0.05)提高了土壤细菌数量,LP处理在60 d显著(P<0.05)提高了土壤细菌数量。
2.2.2 不同调控措施对土壤真菌丰度的影响 120 d培养过程中土壤真菌丰度变化如图2所示:在整个培养周期中,4种处理真菌基因拷贝数呈先上升再下降趋势。MCF处理的土壤真菌丰度在4个时期高于其他处理且有显著差异(P<0.05),在40 d时真菌基因拷贝数达最高,为8.73×107g-1。与ck相比,SL处理的土壤真菌拷贝数在20~60 d显著增加(P<0.05),LP处理的土壤仅在40 d时高于ck,有显著差异(P<0.05),其他时期无明显差异。
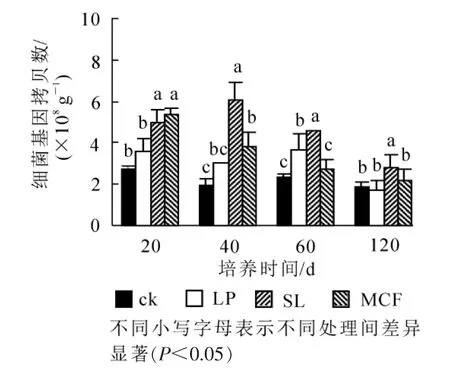
图1 不同调控措施下土壤细菌丰度的动态变化Figure 1 Dynamics of soil bacteria abundance with different treatments

图2 不同调控措施下土壤真菌丰度的动态变化Figure 2 Dynamics of soil fungi abundance with different treatments
2.3 不同调控措施对土壤细菌和真菌群落结构及多样性影响
2.3.1 不同调控措施对土壤细菌结构的影响 对4次采集的土壤细菌进行PCR-DGGE分析(图3),不同的条带代表不同的细菌基因片段,每个泳道中条带的亮度反映出细菌相对生物量的多少。首先对培养20 d土壤DNA进行PCR-DGGE,将几个优势条带割胶,用相同的引物扩增,用作定位标记(Marker),目的是分析这些优势条带的动态变化,再分析不同培养时间土壤细菌的DGGE。结果表明:培养20 d时,不同处理条带存在差异,但同一处理3个重复之间相似度很好,说明培养实验控制良好。所有处理有3条较亮的共性条带(条带1、4、6),条带6不受处理影响,而条带1则是菌液处理亮度反而最弱,条带4则是复合微生物肥料处理稍微弱一点。个性条带分析发现,条带5最亮,该条带由目标菌——芽孢杆菌WK1产生,同时发现复合微生物肥料处理土壤其条带5的亮度比对照和石灰石粉处理高。条带2是石灰石粉处理的特征条带,但培养到40 d时,菌液处理也出现条带2。随着培养时间的增加,大部分条带变化不大,而作为菌液的优势条带5在菌液处理在120 d之内一直保持最强亮度,说明添加的芽孢杆菌能很好地与土壤微生物竞争而繁殖生长,但发现条带5的位置在40 d时出现新的条带,推测新条带与原条带的间隔随着培养时间的增加而增加,因为PCR-DGGE的条件完全相同,推测可能是原土壤存在的菌,因生长状况良好,而被优先扩增出来。根据细菌PCR-DGGE图谱中条带位置和亮度的数值化结果,计算得细菌的多样性指数、均匀度指数和丰富度指数(表3)。多样性指数越大表示微生物群落多样性越高,均匀度指数说明不同物种的数量均等程度,丰富度指数高则说明物种数目多。多样性指数结果分析表明:ck处理多样性指数在整个培养过程中高于其他处理,60 d之前显著(P<0.05)高于SL和MCF处理,说明添加菌液、施用微生物肥料降低了细菌的生物多样性;LP处理在前40 d时与对照持平,60 d时显著(P<0.05)低于对照,但高于(P<0.05)菌液和复合微生物肥料处理。不同处理之间丰富度指数差异变化规律与多样性指数一致。SL处理土壤细菌均匀度指数和其他3种处理相比,存在显著差异(P<0.05),而LP、MCF和ck等3种处理间细菌均匀度指数没有差异。
2.3.2 不同调控措施对土壤真菌结构的影响 土壤真菌的PCR-DGGE结果表明:复合微生物肥处理后,其真菌DGGE图谱结构明显不同于其他3个处理(图4),所有处理和培养时间有3条优势共性条带(条带1、5、8),培养20 d时复合微生物肥料土壤条带1的亮度低于其他3个处理,但40 d以后亮度差异消失。微生物肥料处理有5个特征条带(条带2、3、4、6和7),这些特征条带在前60 d时变化不大,但第120天时只剩下条带2,其余基本消失或非常弱。而且培养120 d时所有条带亮度均较低,说明此时土壤真菌的总体数量下降明显。对真菌的PCR-DGGE图谱进行Shannon-Wiener指数分析(表4):20 d时LP处理和SL处理有显著性差异(P<0.05),但培养20 d时LP处理的土壤真菌多样性和丰富度指数高于其他3种处理,40~120 d期间添加菌液处理的土壤真菌多样性指数和丰富度指数在各个时期低于其他处理。MCF处理的多样性指数和丰富度指数在20 d时低于ck,但无显著差异(P>0.05)。

图3 不同调控措施下土壤中细菌群落在不同时间下的DGGE图谱Figure 3 DGGE fingerprinting of bacteria in soils with different treatments and time experiment
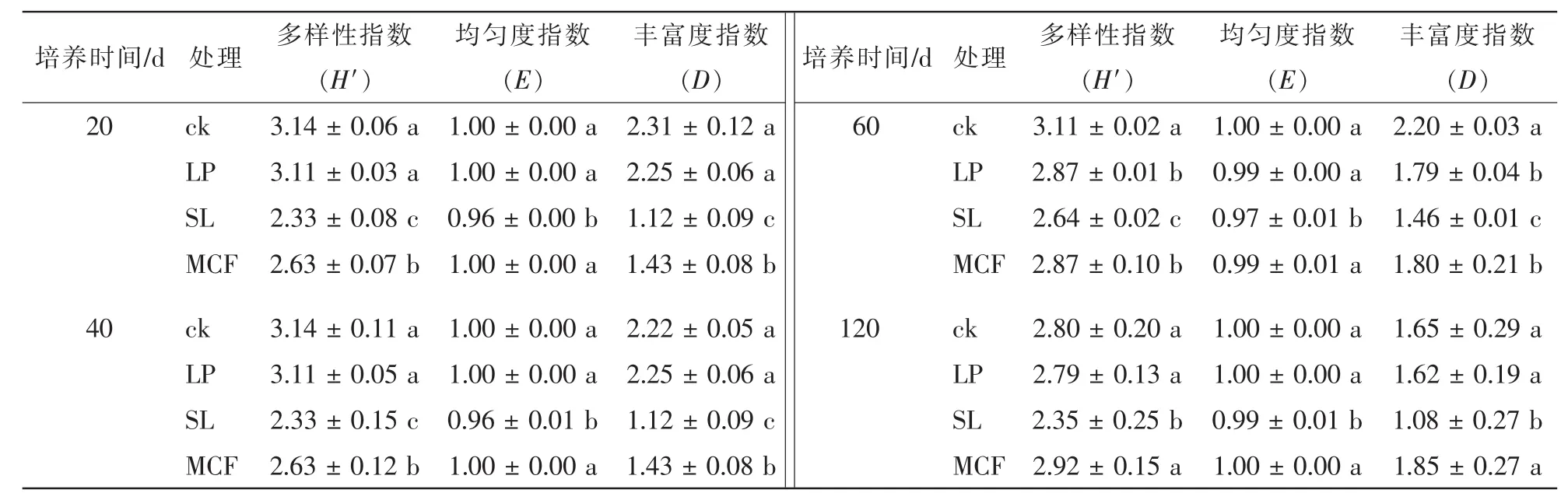
表3 不同调控措施下土壤细菌群落多样性分析Table 3 Biodiversity indices of soil bacteria in the soils with different treatments
3 讨论
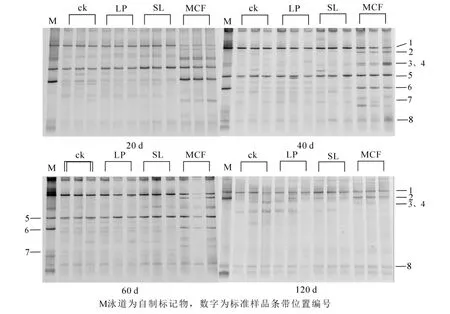
图4 不同调控措施下土壤中真菌群落在不同时间下的DGGE图谱Figure 4 DGGE fingerprinting of fungi in soils with different treatments and time experiment
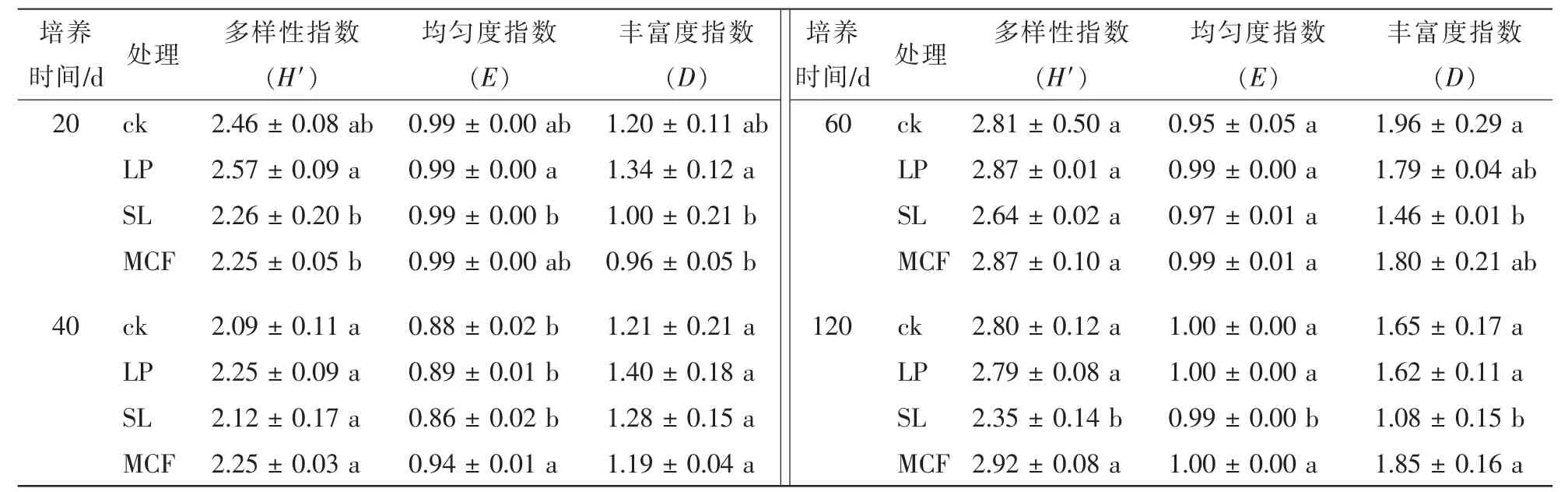
表4 不同调控措施下土壤真菌群落多样性分析Table 4 Biodiversity indices of soil fungi with different treatments and experiment time
土壤微生物的数量动态变化是反映土壤总微生物活性的一个重要参数,与土壤质量、健康状况和生产力密切相关。近些年,随生态农业的发展和社会对环境保护的日益重视,不断深入研究林地连作障碍,并积极研发新型肥料(尤其是菌肥)来替代农药和化肥[28]成为热点。逄焕成等[29]用微生物菌剂处理土壤,使土壤速效钾、碱解氮、有效磷和有机质分别提高了28.9%、50.2%、71.4%和55.9%。本研究表明:4种处理对土壤理化性质影响有所不同,施用菌液和微生物肥料2种处理均提高了土壤速效养分和有机质质量分数,但对于土壤肥效的提高表现为前期大于后期。石灰石粉对土壤养分无显著提高作用,对土壤pH值的调控效果最快,能显著提高土壤pH值,达到山核桃生长的理想范围,而该地常用生石灰调节土壤酸度,可以短期内提高土壤pH值,但对植物根系以及土壤微生物有很大伤害[30],常发生因施用不均匀引发局部土壤强碱现象,不适合人工翻耕的山地土壤。因此,对于林地土壤酸度调节而言,施用石灰石粉不仅比传统的生石灰效果更好、经济成本低,而且持久效果更好,长达4 a以上[31]。复合微生物肥可调节土壤酸度,显著降低土壤pH值,可能是施入土壤后肥料中的有机质矿化以及氮的硝化作用造成。因此,施用菌液和复合微生物肥料能显著改善土壤理化性状,对科学合理施肥,提高山核桃林地土壤质量有极其重要指导意义。
本研究表明:不同处理细菌基因拷贝数达108g-1左右,真菌基因拷贝数达106~107g-1,低于辜运富等[32]在植烟土壤测定的基因拷贝数,可能是2种作物土壤性质差异造成的。石灰石粉处理对细菌的丰度作用不明显,只在施用后60 d时高于对照(P<0.05)。由于生产上有施用生石灰调节pH值的措施,所以本底土壤pH值呈微酸性(6.29)。一般认为:中性土壤有利于细菌繁殖。本研究中施用石灰石粉提高土壤pH值至8.0以上对土壤细菌丰度无显著促进作用。菌液处理40 d时土壤细菌丰度最高,短期施用菌液和复合微生物肥料显著提高了细菌和真菌数量,和胡可等[33]、康萍芝等[34]研究结果一致。原因是菌液和复合微生物肥料含有大量养分,为细菌和真菌的生长提供了丰富的碳源和能源,同时菌液和复合微生物肥料本身含有大量添加的菌种。40 d后复合微生物肥处理真菌丰度下降幅度较大,可能是真菌对复杂有机碳的依赖性比细菌强,肥料中添加有哈茨木霉,该菌前期生长繁殖快,成为优势菌种,40 d时大部分复杂的有机碳被微生物分解利用,导致真菌下降幅度较大[35]。
土壤微生物群落多样性提高不仅能促进土壤生态系统的稳定,而且能延缓土壤微生物生态环境的恶化[36]。高雪莲等[37]通过DGGE技术研究发现:施用生物有机肥后甜瓜Cucumis melo根际细菌和放线菌的数目明显高于对照土壤,病原菌和真菌数量迅速减少。本研究中,DGGE图谱表明不同处理土样间大部分条带相似,细菌和真菌DGGE图谱中菌液处理条带减少,细菌DGGE图谱出现颜色较深条带(条带5),说明施用菌液抑制其他菌落生长,增加了土壤优势菌群数量,改变了土壤微生物群落结构。复合微生物肥料处理的细菌DGGE图谱中,仅条带5颜色较其他条带深,其他条带无明显变化,而真菌DGGE图谱条带数减少,4条带颜色较深,说明施用复合微生物肥料能增加有益菌数量,抑制土壤中其他真菌的生长。也有研究证实:向土壤添加有益菌,能有效改善土壤肥力,抑制病原菌,增加微生物群落多样性和提高植株抗病能力[38-40]。对DGGE图谱信息的多样性指数分析发现,添加菌液后土壤细菌多样性指数和丰富度指数下降,与游偲等[41]结果相反。可能的原因之一是外加的菌数量增加明显,抑制了某些土著细菌的生长[42]。原因之二是外加的菌数量增加明显,扩大了多样性指数计算公式的分母。复合微生物肥料处理的土壤细菌多样性指数和丰富度指数明显低于对照,真菌多样性指数和丰富度指数无显著变化,李朔[43]和吴恩彪[44]研究得出施用微生物肥料能增加土壤微生物的多样性的结果不一致,原因是他们的微生物肥料中含有多种微生物,而本研究使用的复合微生物肥料只含有哈茨木霉和芽孢杆菌2种菌。
4 结论
添加石灰石粉能显著提高山核桃林地土壤pH值,施用菌液能提高土壤pH值和有机质、速效氮、速效磷、速效钾质量分数,并能显著提高土壤细菌数量,复合微生物肥料对提高林地土壤有机质和有效养分效果最好,显著提高土壤真菌丰度,短期提高土壤细菌数量,因此菌液、复合微生物肥和石灰石粉可明显改良山核桃林地土壤化学性状和提高土壤有益菌数量,可作为山核桃林地土壤改良剂。
