桂花OfFCA基因的克隆及在花芽分化时期的表达分析
2020-04-22吴鸿飞周敏舒徐倩霞杨丽媛赵宏波
吴 琪,吴鸿飞,周敏舒,徐倩霞,杨丽媛,赵宏波,董 彬
(浙江农林大学 风景园林与建筑学院,浙江 杭州311300)
开花是植物生命周期中的重要发育阶段,受自身遗传和外界环境因素的影响[1]。FCA(FLOWERING LOCUS CA)参与拟南芥Arabidopsis thaliana开花调控,通过多腺苷酸化(polyadenylation)和介导FLC(FLOWERING LOCUS C)染色质的组蛋白去甲基化(demethylation)调控开花[2-4]。拟南芥的fca突变后会抑制开花促进因子 FT(FLOWERING LOCUS T)和SOC1(SUPPRESSOR OF OVEREXPRESSION OF CONSTANS)的表达,fca突变体在不同光周期下均表现出晚花表型[5]。另外,FCA可以激活LFY(LEAFY)和AP1(APETALA1)的活性促进拟南芥开花[6]。将水稻 Oryza sativa和巴西橡胶树 Hevea brasiliensis的FCA基因转入拟南芥fca突变体,会导致晚花性状出现逆转和恢复[7-8]。由此可见,FCA在植物花期调控方面发挥着重要作用。环境温度影响植物开花时间。植物FCA基因是温敏途径(thermosensory pathway)中的重要基因,可响应温度变化调控植物的花芽分化[9]。与16℃相比,23℃可促进拟南芥FCA的转录,使FCA蛋白水平升高,fca突变体对温度不敏感[10]。FCA通过诱导FT表达在高温下促进拟南芥开花[11]。与1年生拟南芥相比,一些多年生植物对温度变化的反应及其对开花的影响表现出多样性。例如,在多年生拟南芥的1个祖先近源种Boechera stricta中,与18℃相比,25℃处理下开花延迟[12];同样,在菊花Chrysanthemum morifolium中,也发现夏季温度升高能延迟菊花开花[13]。目前,对环境温度调控其开花的机理主要集中于模式植物中,木本植物种类繁多,且开花差异很大,关于木本植物中如何响应环境温度变化调控开花的机理仍不清楚。本研究通过对桂花Osmanthus fragrans OfFCA基因的同源克隆和定量聚合酶链式反应(PCR),分析OfFCA在不同温度下桂花不同花芽分化时期不同组织中的表达情况,初步探究OfFCA参与桂花花芽分化的调控作用,为桂花的花期调控、遗传改良以及新品种培育提供一定理论基础。
1 材料与方法
1.1 材料
从浙江农林大学桂花种质资源圃中,选取株龄相同且生长一致的桂花‘堰虹桂’O.fragtans‘Yanhonggui’,分别于19和25℃处理。当处理0、10、20、30、40、50和60 d时,分别采集‘堰虹桂’的叶和花芽,一部分进行显微解剖结构观察;另一部分液氮处理后-80℃冻存,用于基因克隆和定量PCR分析。
1.2 方法
1.2.1 石蜡切片制作 石蜡切片制作参照刘涛等[14]的方法。主要步骤包括:①固定。采用体积比为18∶1∶1的700 mL·L-1乙醇、冰乙酸和甲醛将不同时期桂花的样品固定24 h以上。②切片。将经过脱水、透明、渗蜡、包埋等处理材料进行切片,厚度约12 μm。③染色及观察。固绿染色后用中性树脂封片,风干后,于显微镜(Axio Imager 2,日本)下观察。
1.2.2 RNA提取及反转录 取花芽分化时期约0.5 g的花芽或叶片,按照RNAprep pure Plant Kit试剂盒说明书提取RNA,RNase-free DNaseⅠ(Takara)去除DNA。cDNA反转录参照Reverse Transcriptase MMLV(Takara,大连)说明书,产物储存于-20℃备用。
1.2.3 桂花OfFCA基因的克隆 通过前期转录组获得的FCA基因Unigene片段设计特异性引物(FCA-F:GCTATTCGTTGGAGGAGTT;FCA-R:GTTGTCTTGCGTAGTTGTC),以反转录的cDNA为模板进行PCR扩增, PCR 反应体系如下: 上下游定量引物(10 μmol·L-1)各 1 μL, cDNA 1 μL, 2×SYBR Premix Ex TaqⅡ(Tli RNaseH Plus)10 μL和双蒸水7 μL。PCR反应条件为:95℃预变性5 min;95℃变性30 s,60℃退火30 s,72℃延伸1 min;35次循环;72℃延伸10 min;4℃保存备用。PCR反应产物经10 mg·g-1琼脂糖凝胶电泳检测后回收,纯化,连接到pMD18-T载体,转化大肠埃希菌Escherichia coli DH5α感受态细胞,蓝白斑筛选阳性克隆,经PCR鉴定后送上海生工生物科技公司测序。
1.2.4 桂花OfFCA基因及其编码蛋白的生物信息学分析 将克隆得到的OfFCA基因用DNAMAN软件进行多重比对序列,使用MEGA 7.0软件Neighbor-Joining法构建系统发育树;利用MultiLoc 2软件(http://abi.inf.uni-tuebingen.de/Services/MultiLoc2)进行亚细胞定位预测;在线工具TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)和 SignalP 5.0(http://www.cbs.dtu.dk/services/SignalP/)分析 OfFCA 蛋白跨膜结构域、信号肽预测;利用ExPASy工具中的SOPMA软件预测蛋白质二级结构,用SWISS-MODEL(https://swissmodel.expasy.org/)对三级结构进行预测。
1.2.5 实时荧光定量PCR 设计OfFCA荧光定量引物,送上海生工生物科技公司合成。荧光定量PCR反应体系为:SYBR Premix Ex TaqⅡ 10.0 μL,上下游定量引物(OfFCA-F:AGCATGTGTGTCCTGATGGA; OfFCA-R: GCTTATGATGCACCGGTTGT)各 0.8 μL(10 μmol·L-1), cDNA 2.0 μL, 双蒸水补齐至20.0 μL。反应程序如下:95℃预变性30 s,95℃ 5 s,60℃ 30 s,40个循环;95℃ 15 s,60℃ 1 min,95℃ 30 s,60℃ 15 s。3次生物学重复。采用2-△△CT法[15]计算OfFCA的相对表达量。
2 结果与分析
2.1 桂花OfFCA基因克隆及序列分析
同源克隆获得桂花OfFCA基因cDNA序列,长度为1 319 bp(图1),开放阅读框为864 bp,编码287个氨基酸,基因登录号为MK737873。通过DNAMAN软件比对发现:OfFCA与旋花科Convolvulaceae矮牵牛Ipomoea nil的IpFCA-like、茄科Solanaceae马铃薯Solanum tuberosum的SoFCA-like、胡麻科Pedaliaceae芝麻Sesamum indicum的SeFCA-like及玄参科Scrophulariaceae沟酸浆Erythranthe guttata的EryFCA和烟草Nicotiana attenuata的NiFCA-like较为相似,其氨基酸序相似度分别为76%、69%、68%、68%和68%(图2)。
2.2 桂花OfFCA编码蛋白的生物信息学分析
ExPASy软件结构域预测发现:OfFCA蛋白具有典型的RRM基序和WW结构域(图2),其相对分子质量为70.6 kD,理论等电点值为5.12。OfFCA蛋白不存在信号肽,亚细胞定位预测显示:OfFCA蛋白定位于细胞质。蛋白结构三级如图3所示。亲水性指数(GRAVY)为-0.565,表明OfFCA具有较好的亲水性。

图1 桂花OfFCA PCR电泳图Figure 1 Electrophoretogram of OfFCA gene

图2 OfFCA与其他物种同源蛋白氨基酸序列比对Figure 2 Comparative analysis of OfFCA protein sequence
2.3 桂花OfFCA系统进化树分析
用MEGA7.0构建‘堰虹桂’与其他物种FCA之间的系统发育树(图4)。结果显示:OfFCA与木犀科Oleaceae油橄榄Olea europaea的OlFCA和胡麻科芝麻的SeFCA具有较近的亲缘关系。

图3 桂花OfFCA蛋白三级结构预测Figure 3 Tertiary structure prediction for OfFCA protein
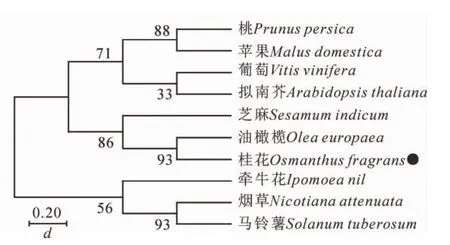
图4 桂花OfFCA系统进化树Figure 4 Phylogenetic tree based on OfFCA gene
2.4 不同温度下桂花花芽分化进程及OfFCA表达特性分析
通过对不同温度下‘堰虹桂’不同花芽分化时期的石蜡切片发现:19℃处理约20 d后,‘堰虹桂’进入花序分化期,约30 d后进入小花分化期,40 d左右进入花萼和花瓣分化期,50 d后进入雄蕊分化期和雌蕊退化分化期。但在25℃处理下,‘堰虹桂’在30 d左右进入花序原基分化期且一直处于该时期(图5),花芽分化进程显著延迟。以上现象说明低温19℃能够显著促进‘堰虹桂’的花芽分化进程,从而促进开花时间提前。

图5 不同温度处理下‘堰虹桂’花芽分化进程Figure 5 Flower bud differentiation period of Osmanthus fragrans‘Yanhonggui’ under different temperature treatments
FCA基因是植物响应温度变化调控植物开花的重要基因,对桂花OfFCA基因进行定量表达检测发现:无论是在叶还是花芽组织中,OfFCA基因在19℃的表达均显著高于25℃(图6),这说明OfFCA基因可响应相对低温19℃的变化,参与调控‘堰虹桂’的花芽分化。
3 讨论
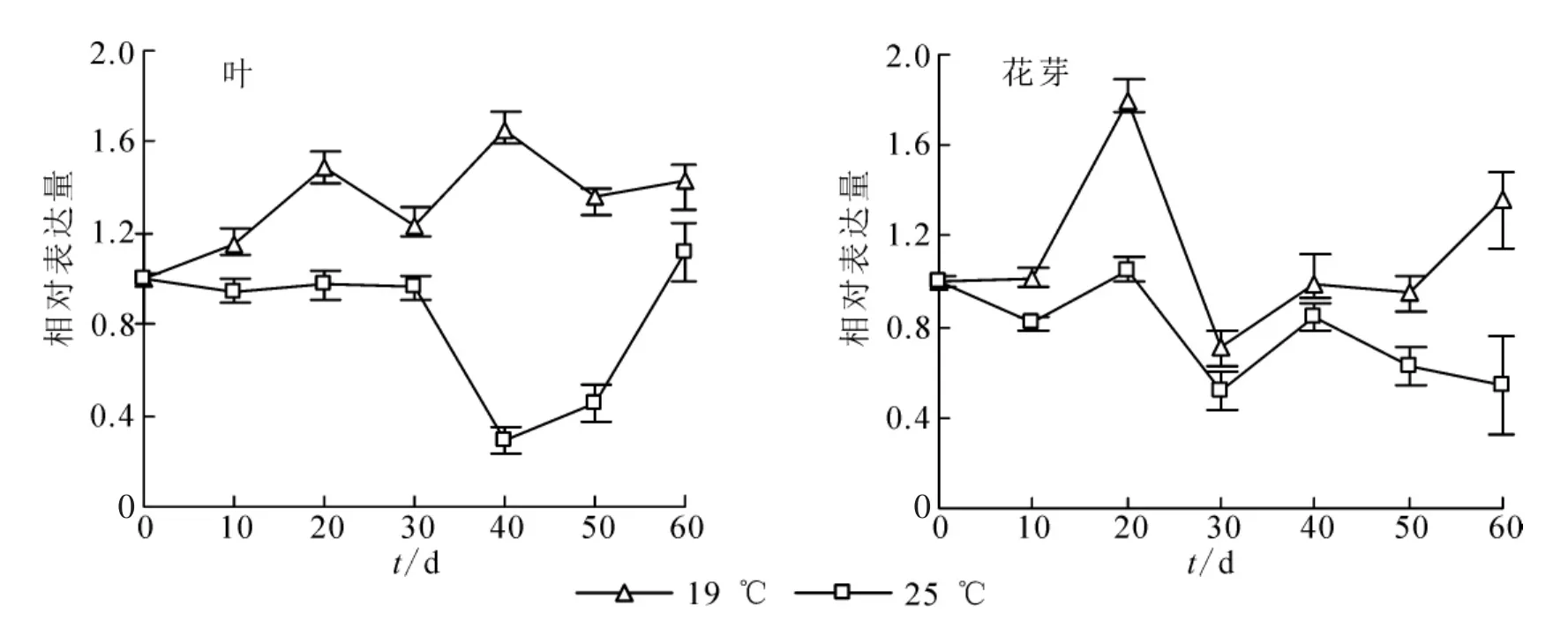
图6 OfFCA基因在‘堰虹桂’叶和花芽中的表达变化Figure 6 Expression pattern of OfFCA in leaf and flower bud at different temperatures
环境温度不同于春化作用和冷胁迫,一般处于该物种生理学和非胁迫温度之间,广泛影响植物的生长发育。不同物种对环境温度的响应具有很大差异,例如,在低温条件下,拟南芥和水稻的开花时间均延迟[16-17],但是在朵丽蝶兰Doritaenopsis hybrid的研究中,低温能够诱导其成花转变,促进生理生化变化及花芽分化[18]。同时在烟草的研究中,低温也是促使烟草提前进入花期的重要因素之一[19]。本研究发现:与正常生长温度25℃相比,相对低温19℃显著促进‘堰虹桂’花芽分化进程,使开花时间提前(图5)。目前,FCA同源基因在拟南芥等多个物种中已克隆得到,但是至今仍没有桂花OfFCA基因的相关报道。本研究从桂花秋桂品种‘堰虹桂’中分离得到1 319 bp的OfFCA基因(图1),其开放阅读框为864 bp,编码287个氨基酸,基因登录号为MK737873。与其他物种FCA同源基因类似,OfFCA具有典型的RRM基序和WW结构域,与矮牵牛IpFCA-like的同源性最高(76%),且与其他物种包括马铃薯、芝麻、沟酸浆以及烟草的同源性均高达68%以上(图2)。另外,OfFCA基因与木犀科油橄榄OeFCA和胡麻科芝麻SiFCA关系最近(图4)。
环境温度对植物的花芽分化和开花具有重要的影响,其调控机制也存在很大的差异。FCA受转录和转录后调控,在拟南芥中,与16℃相比,23℃时FCA转录和蛋白质水平升高,进而促使成花转变使花期提前[20]。但在木本植物三叶橙Poncirus trifoliata中,与23℃相比,PtFCA1在较高的环境温度(27℃)显著下调,且35S::PtFCA1回补拟南芥fca-1突变体花期显著提前[21]。在桂花中发现,无论在叶和花芽中,19℃条件下OfFCA基因的表达均显著高于25℃(图6)。据此可以推测,OfFCA响应环境温度变化参与桂花的花芽分化并使开花时间提前。在拟南芥等模式植物中,FCA通过抑制FLC以及SVP(SHORT VEGETATIVE PHASE)基因调控FT和SOC1的表达来促进花芽分化和开花时间[22],但是桂花OfFCA基因是否像模式植物一样,通过直接调控FLC和SVP基因的表达进而使FT和SOC1蛋白积累促进开花,还有待更进一步的验证。
目前,关于桂花的开花分子机制的报道比较少[23]。本研究通过对桂花的FCA基因克隆和表达分析,初步探究OfFCA影响环境温度变化调控桂花花芽分化的分子机制,对桂花的花期调控、遗传改良以及新品种培育提供一些理论基础。
