内生甲基营养型芽孢杆菌对罗汉果斑枯病的拮抗作用
2020-04-22宋利沙蒋水元冯世鑫陈乾平张占江黄夕洋
蒋 妮,宋利沙,蒋水元,冯世鑫,陈乾平,张占江,黄夕洋
(1.广西药用植物园,广西 南宁 530023;2.广西壮族自治区中国科学院广西植物研究所,广西 桂林 541006)
【研究意义】罗汉果(Siraitiagrosvenorii)为葫芦科多年生藤本植物,其干燥果实为我国传统中药,具有清热止咳、化痰、润肺及生津止渴等功效,被中国历版药典收载[1]。罗汉果还是我国特有的药食同源植物,果实中含有高甜度且低热量的罗汉果苷类,作为最佳的天然甜味剂得以广泛应用并大量出口到欧美和日本等地[2-3]。广西是罗汉果的主产区及道地产区,全国80 %以上的罗汉果产自广西北部山区[4-6]。2015年笔者首次报道[7]在桂林等主产区发生一种严重影响罗汉果生长的新病害——罗汉果斑枯病,经鉴定病原菌为子囊菌(Stagonosporopsiscucurbitacearum),恶霉灵、戊唑醇和咪鲜胺等化学药剂对其病原菌丝的生长具有强抑制作用。目前,罗汉果斑枯病已成为罗汉果栽培过程中普遍发生、为害严重的一种病害。据农户反馈,化学药剂能在一定程度上控制该病害的发生,但需逐年不断增加用药浓度和使用次数,部分严重发生的果园已开始出现抗药性。甲基营养型芽孢杆菌(Bacillusamyloliquefaciens)抗病谱广、抗逆性强、对作物安全且环境友好,目前已成为植物病害生防菌家族的后起之秀,是近年来生防细菌研究的热点之一[8]。bjq-a是分离自药用植物的内生细菌[9],将其应用于防控罗汉果斑枯病,对开展绿色、安全、有效、可控的罗汉果生产具有重要意义。【前人研究进展】国内外大量研究表明,从土壤中分离的芽孢杆菌(Bacillus)、假单孢菌(Pseudomonas)和土壤放射杆菌(Agrobacterium)等拮抗细菌在植物病害生物防治中发挥了非常重要的作用[10-13]。但是,随着土壤微生物资源的日趋枯竭,人们转而从植物内生菌或海洋中寻求新的拮抗资源[14-15]。已有研究表明,内生细菌存在于植物根际和叶片周围,生存环境稳定,是其他病原菌的绝佳竞争者,利用内生细菌是筛选拮抗细菌的一条重要途径,而药用植物作为一类具有特殊用途的植物,可从中获取具有重要研究价值的菌株[16-17]。据报道,从人参中分离到的内生细菌——甲基营养型芽孢杆菌、从白术中分离到的拮枯草芽孢杆菌及从温郁金中分离到的贝莱斯芽孢杆菌分别对人参锈腐病、白术根腐病菌和铁皮石斛炭疽病菌等病原菌表现出较好的拮抗活性[16-18]。本研究课题组前期从广西特色药用植物山牵牛叶片中分离到一株活性极强的拮抗内生细菌——甲基营养型酶芽孢杆菌菌株(bjq-a),对山牵牛及三七的炭疽病菌(Colletotrichumgloeosporioides)、三七根腐病菌(Fusaiumsolani)、三七黑斑病 菌(Alternariapanax)、广西莪术叶斑病菌(Phomopsissp.)和苦玄参叶斑病 菌(Alternariasp.)等多种药用植物病原菌均表现出较强的拮抗活性[9]。【本研究切入点】罗汉果斑枯病是罗汉果产区新发病害,迄今关于该病害的研究仅限于病原鉴定及化学药剂室内筛选,利用甲基营养型芽孢杆菌对其进行防治的研究未见报道。【拟解决的关键问题】开展bjq-a拮抗罗汉果斑枯病病原菌活性测定及初步防治试验,为罗汉果斑枯病的绿色防控提供生防资源,为该病害生防菌剂的开发利用提供技术支持。
1 材料与方法
1.1 试验材料
供试bjq-a为甲基营养型芽孢杆菌,罗汉果斑枯病病原菌株为子囊菌真菌,均由本研究课题组分离纯化后试管保藏在广西药用植物园植物病理研究室。
1.2 试验方法
1.2.1 平板对峙试验 从保存罗汉果斑枯病病原菌菌种的试管中挑取少量菌丝体移至PDA培养基,25 ℃恒温培养7 d,用无菌打孔器在菌落边缘取直径为6 mm 的菌饼,接种至新鲜PDA培养基中央,同时在距培养基中央2.5 cm处的3个角,点接培养好的bjq-a(即3个接种bjq-a处理),以仅接种罗汉果斑枯病病原菌为对照1(CK1)。各接种bjq-a处理和CK1均设3个重复,置于28 ℃恒温培养箱培养7、14、21和30 d时用十字交叉法测量病原菌菌落直径,取平均值,计算病原菌抑菌率。
病原菌抑菌率(%)=(CK1菌落直径-接种株bjq-a处理菌落直径)/CK1菌落直径×100
1.2.2 bjq-a无菌发酵液对罗汉果斑枯病病原菌菌丝生长和形态影响试验 bjq-a无菌发酵液的制备:将bjq-a在LBA培养基上划线活化,挑取3个单菌落于内装100 mL LB的三角瓶中(容量为250 mL),在28 ℃、180 r/min 条件下振荡培养72 h。取出培养液,在10 000 r/min离心机上离心10 min,取上清液经直径为0.22 μm的微孔滤膜过滤即得bjq-a无菌发酵液。将罗汉果斑枯病病原菌株在PDA上活化5 d后,用直径为6 mm的打孔器在菌落上打孔制成若干菌饼备用。将制备好的bjq-a无菌发酵液与加热溶解后温度降至40 ℃左右的PDA,按照表1所示比例快速混匀,倒入已灭菌的直径为10 cm的平皿中,10 mL/皿,每个浓度5皿。待混合PDA冷却凝固后,将罗汉果斑枯病病原菌菌饼接入各平皿中央(共5个bjq-a无菌发酵液处理),以相同体积的无菌水与PDA混合作为对照2(CK2)。在28 ℃培养箱中培养14 d后,用十字交叉法测量各平皿中菌落的直径,计算菌丝生长抑制率及半最大效应浓度(EC50)。用经灭菌的接种针分别从20 % bjq-a无菌发酵液处理和CK2的平皿中挑取少量菌丝,在倒置显微镜下观察菌丝形态,并于40倍物镜下拍照记录。
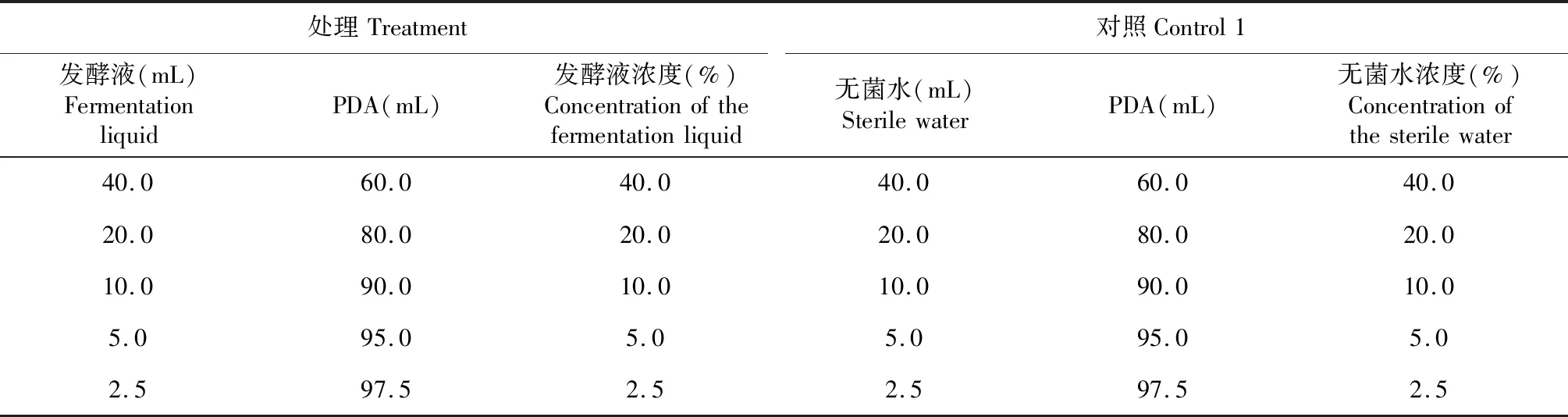
表1 bjq-a无菌发酵液及对照1的浓度Table 1 The concentration of bjq-a fermentation liquid and control 1
1.2.3 bjq-a无菌发酵液对罗汉果斑枯病病原菌孢子萌发及形态影响试验 参考殷晓敏[19]的方法,用无菌水将罗汉果斑枯病病原菌孢子配置为1×106CFU/mL的悬浮液,用此孢子悬浮液稀释bjq-a发酵液,使发酵液最终浓度为 50.0 %、25.0 %、12.5 %、6.0 %和3.0 %,每处理3个重复。以无菌水与罗汉果斑枯病病原菌孢子悬浮液混合为对照3(CK3)。28 ℃保湿器中保湿培养24 h,取出显微观察病原菌孢子形态及萌发情况,计算孢子萌发率、抑制率和EC50。
1.2.4 bjq-a无菌发酵液对罗汉果斑枯病离体抑制试验 将罗汉果斑枯病病原菌在PDA上活化5 d后,用直径为6 mm的打孔器在菌落边缘处打孔制成菌饼备用。选择新鲜、健康的罗汉果叶片洗净晾干后,用无菌接种针将叶片刺出若干个伤口,形成一个直径约6 mm的圆形接种点,每张叶片2个接种点。
将菌饼接种至伤口处,24 h后用小型喷瓶将20 % bjq-a无菌发酵液喷施到叶片的正反两面,每张叶片喷10 mL,此后每隔24 h喷1次,共喷3次。对照4(CK4)叶片亦接种罗汉果斑枯病病原菌饼,每张叶片喷施10 mL无菌水。取喷施20 % bjq-a无菌发酵液处理及CK4各10张叶片,分别置于培养皿中,28 ℃恒温保湿培养。于接种后48、72、96和168 h观察发病情况,用十字交叉法测量各病斑直径,取平均值,计算菌落抑制率。
平均病斑直径=各病斑直径之和/测量的病斑数
菌落抑菌率(%)=(CK4平均菌落直径-喷施20 % bjq-a无菌发酵液处理平均菌落直径) /CK4平均菌落直径×100
1.2.5 bjq-a活性代谢产物分析 参考仇艳肖[20]的方法分别制备含几丁质、羧甲基纤维素钠和酪蛋白的培养基,在培养基中央移入直径为6 mm 的bjq-26菌饼,28 ℃恒温培养2 d,观察有无透明圈产生,以检测菌株是否含有几丁质酶、纤维素酶(β-1,4葡聚糖酶)和蛋白酶。参考宋利沙等[8]的方法,采用ELISA酶活试剂盒说明测定bjq-26发酵液原液中的蛋白酶、纤维素酶和几丁质酶活性及吲哚乙酸含量。
1.3 统计分析
试验数据采用Excel 2007进行整理,以SPSS 19.0进行差异显著性分析。
2 结果与分析
2.1 bjq-a菌株对罗汉果斑枯病病原菌的抑制作用
由表2可知,bjq-a与罗汉果斑枯病病原菌共同培养7 d时,罗汉果斑枯病病原菌的抑制率为44.16 %,显著低于其他培养时间接种bjq-a处理(P<0.05,下同);培养14 d时,接种bjq-a的罗汉果斑枯病病原菌受到抑制(图1-A),平均菌落直径仅3.62 cm,病原菌抑制率最高,为63.8 %,而CK1的罗汉果斑枯病病原菌已长满全皿(图1-B);培养21和30 d时,接种bjq-a的罗汉果斑枯病病原菌抑制率均为62.5 %,与培养14 d时的罗汉果斑枯病病原菌抑制率差异不显著(P>0.05,下同)。后期观察发现,培养30 d后,接种bjq-a的罗汉果斑枯病病原菌菌丝渐变稀疏,颜色稍深,罗汉果斑枯病病原菌菌落直径与培养14和21 d时差异不明显,表明培养30 d后接种bjq-a的病原菌菌丝体已完全受到抑制不再生长。说明bjq-a与罗汉果斑枯病病原菌共同培养14 d对其病原菌菌丝的抑制作用最大,且共同培养30 d时仍保持与培养14 d相近的抑制效果。
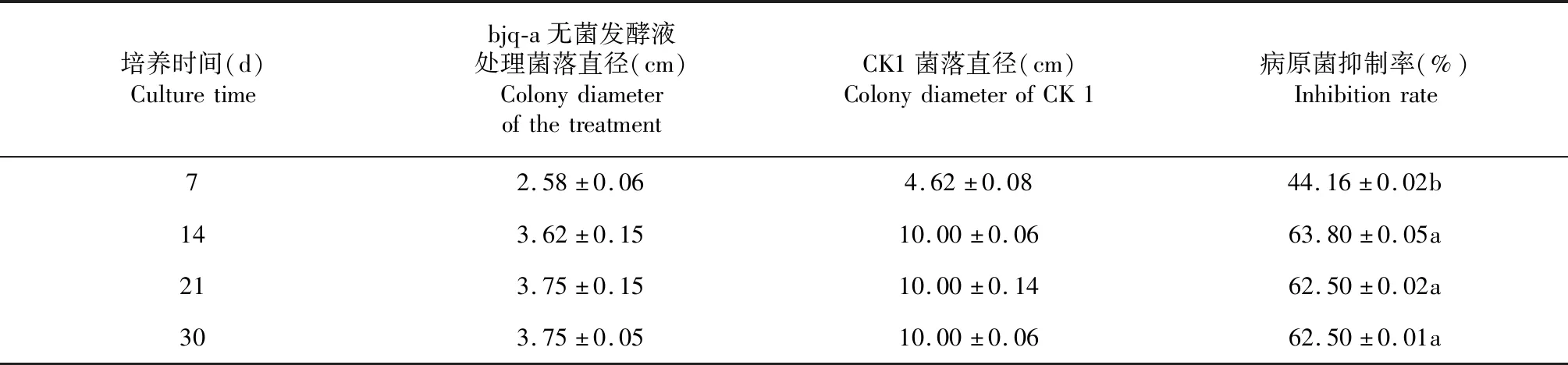
表2 bjq-a对罗汉果斑枯病病原菌丝生长的抑制效果Table 2 Inhibitory activity of antagonistic bacteria bjq-a against S. cucurbitacearum hypha
注:同列数据后不同小写字母表示差异显著(P<0.05),下同。
Note:Different lowercase letters in the same column represented significant difference(P<0.05). The same as below.
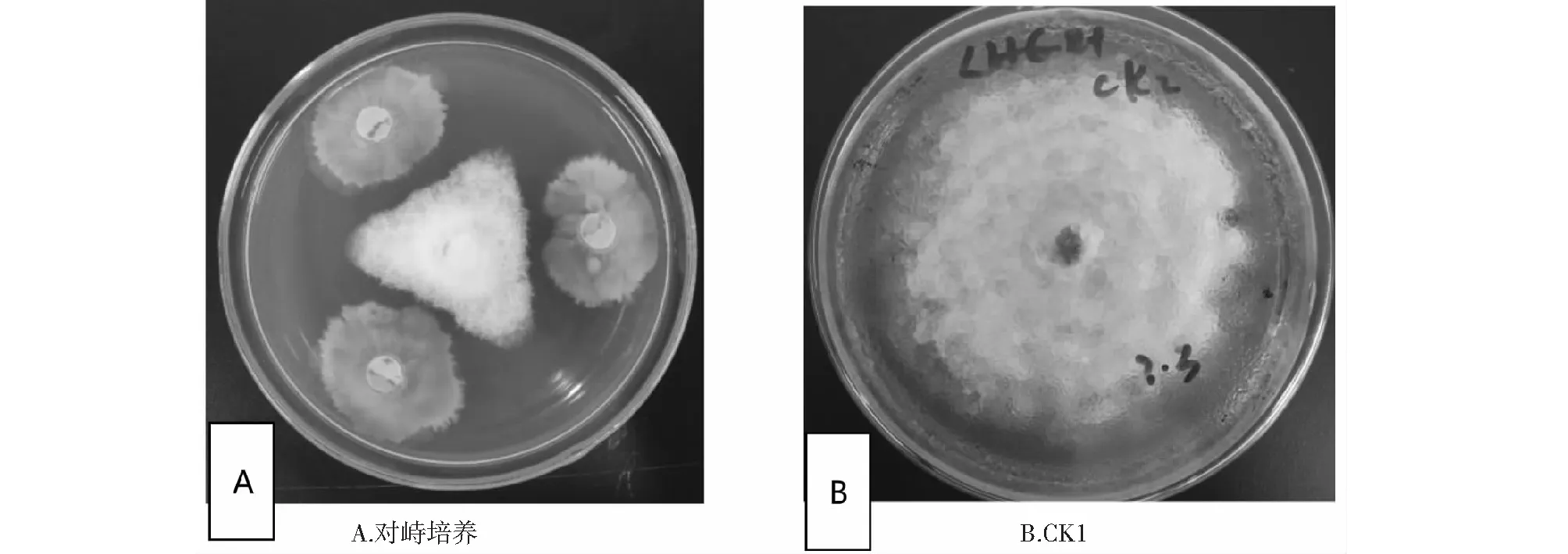
图1 bjq-a 对S. cucurbitacearum的拮抗作用Fig.1 Antagonistic effects of strain bjq-a on the S. cucurbitacearum
2.2 bjq-a无菌发酵液对罗汉果斑枯病病原菌菌丝生长及形态的影响
由表3可知,20 %和40 % bjq-a无菌发酵液对罗汉果斑枯病病原菌菌丝生长的抑制率分别为96.2 %和99.5 %,抑制效果较明显。经毒力测定,发酵液的EC50=3.65 %(毒力回归方程Y=1.915X+4.006,相关系数r=0.8186)。从图2-A可看出,在bjq-a无菌发酵液浓度为40 %的PDA平皿中,罗汉果斑枯病病原菌菌丝几乎不能生长,抑制率达99.5 %,而CK2的PDA平皿中长满罗汉果斑枯病病原菌菌丝。与2.1的试验结果比较发现,PDA中bjq-a发酵液浓度>20 %时,罗汉果斑枯病病原菌菌丝的抑制率均>90.0 %,而2.1的试验结果中罗汉果斑枯病病原菌的最高抑制率为63.8 %,说明bjq-a进行发酵培养可能更利于其抑菌活性物质释放。
在40×显微镜下观察发现,在含bjq-a发酵液(浓度为40 %)的PDA培养基中,罗汉果斑枯病病原菌菌丝畸形、膨大为念珠状(图2-B),而CK2的菌丝体细直,不弯曲(图2-C)。

表3 bjq-a无菌发酵液对罗汉果斑枯病病原菌菌丝生长的抑制效果Table 3 The Inhibitory activity of bjq-a fermentation liquid to the mycelial growth of S. cucurbitacearum
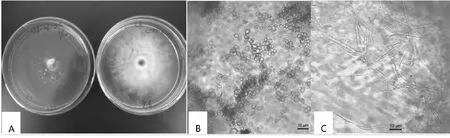
A :40 % bjq-a发酵液对罗汉果斑枯病病原菌生长的抑制作用(左平皿为处理,右平皿为CK2);B:40 % bjq-a发酵液处理的罗汉果斑枯病病原菌菌丝形态;C:CK2的罗汉果斑枯病病原菌菌丝形态A:Antagonistic effects of 40 % bjq-a fermentation on the S. cucurbitacearum(the left plate was the treatment and the right plate was the CK2);B:Hyphae treated by 40 % bjq-a fermentation liquid;C:Hyphae treated by CK2图2 bjq-a发酵液对罗汉果斑枯病病原菌菌丝生长及形态的影响Fig.2 Effects of fermentation liquid of bjq-a on the mycelial growth and morphology of S. cucurbitacearum
2.3 bjq-a无菌发酵液对罗汉果斑枯病病原菌孢子萌发及形态的影响
由表4可知,50 % bjq-a无菌发酵液对罗汉果斑枯病病原菌孢子萌发的抑制率达90.5 %,随着bjq-a无菌发酵液浓度的降低,抑制活性减弱。经毒力测定,发酵液的EC50=6.85 %(毒力回归方程Y=1.915X+4.006,相关系数r=0.9839)。从图3-A和图3-B可看出,CK3中正常的罗汉果斑枯病病原菌孢子形态为短杆棒状,萌发的芽管细长,侵染活力强;而发酵液中的罗汉果斑枯病病原菌孢子膨大为原体积的数十倍,孢子不萌发,或萌发的芽管较短或弯曲,难以侵染。

表4 bjq-a无菌发酵液对罗汉果斑枯病病原菌孢子萌发的抑制效果Table 4 Inhibitory activity of bjq-a fermentation liquid to the spore germination of S. cucurbitacearum

A:正常孢子及萌发状(CK3);B:畸形孢子及萌发状A:Normal spore and germination(CK3);B:Deformed spore and germination图3 bjq-a无菌发酵液对罗汉果斑枯病病原菌孢子形态及萌发的影响Fig.3 Effects of fermentation liquid of bjq-a on the spores morphology and germination of S. cucurbitacearum
表5 20 % bjq-a无菌发酵液对罗汉果斑枯病的防治效果Table 5 Biological control efficacy of 20 % bjq-a fermentation against S. cucurbitacearum on the S. grosvenorii leaves
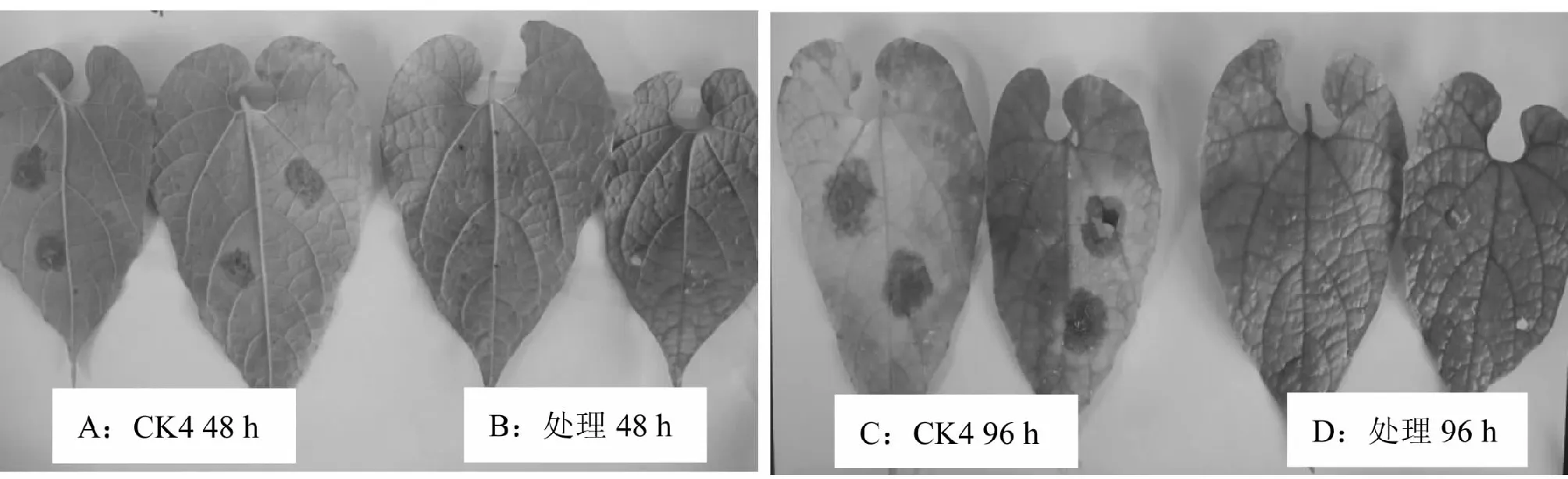
A:接种48 h的CK4叶片;B:接种48 h、20 % bjq-a无菌发酵液处理的叶片;C:接种96 h的CK4叶片;D:接种96 h、20 % bjq-a无菌发酵液处理的叶片A:The leaves of CK4 were inoculated for 48 hours;B:The leaves inoculated with pathogen and treated by 20 % bjq-a fermentation for 48 hours;C:The leaves of CK4 were inoculated for 96 hours;D:The leaves inoculated with pathogen and treated by 20 % bjq-a fermentation for 48 hours图4 接种罗汉果斑枯病病原菌48和96 h后20 % bjq-a发酵液对罗汉果斑枯病的防治效果Fig.4 The control effects of bjq-a fermentation against S. cucurbitacearum on Siraitia grosvenorii leaves 48 and 96 hours after inoculation
2.4 bjq-a无菌发酵液对罗汉果斑枯病的离体抑制效果
由表5可知,接种罗汉果斑枯病病原菌24 h时,20 % bjq-a无菌发酵液处理及CK4均未发病;接种48 h时,CK4全部发病,20 % bjq-a无菌发酵液处理未发病(图4-A和图4-B);接种72 h时,CK4全部发病,病斑平均直径为2.50 cm,20 % bjq-a无菌发酵液处理有6个接种点发病,平均病斑直径为0.40 cm,罗汉果斑枯病病原菌抑制率为84.0 %;接种96 h时,CK4病斑颜色加深至黄褐色,直径为4.50 cm,20 % bjq-a无菌发酵液处理发病数有8个接种点发病,病斑直径比接种72 h时略有扩大,为0.80 cm,但叶片尚为正常绿色(图4-C和图4-D),罗汉果斑枯病病原菌抑制率为82.2 %;接种168 h时,CK4叶片整张发病,而20 % bjq-a无菌发酵液处理的病斑数及病斑直径不再扩大。说明接种20 % bjq-a无菌发酵液168 h可有效防治罗汉果斑枯病。
2.5 bjq-a产酶能力及生长素活性的测定
图5显示,在含酪蛋白、羧甲基纤维素钠和几丁质的培养基中,bjq-a菌落周围均形成透明的水解圈,表明bjq-a菌株同时产生了蛋白酶、纤维素酶和几丁质酶,能分解培养基中的相应成分。表6结果表明,bjq-a发酵液原液中含有较高剂量的几丁质酶(56.70 pg/mL)、纤维素酶(62.68 pg/mL)、蛋白酶(14.34 pg/mL)及吲哚乙酸(3.62 pmol/L),且均显著高于对照。其中蛋白酶、纤维素酶和几丁质酶是细孢壁的主要水解酶,推测这些水解酶即为bjq-a抗菌活性物质的一部分,是其产生拮抗活性的机理之一;而吲哚乙酸是促进植物生长的有效生长激素,因此bjq-a发酵液除能抑制罗汉果斑枯病病原菌生长外还具有促进罗汉果生长的潜能。
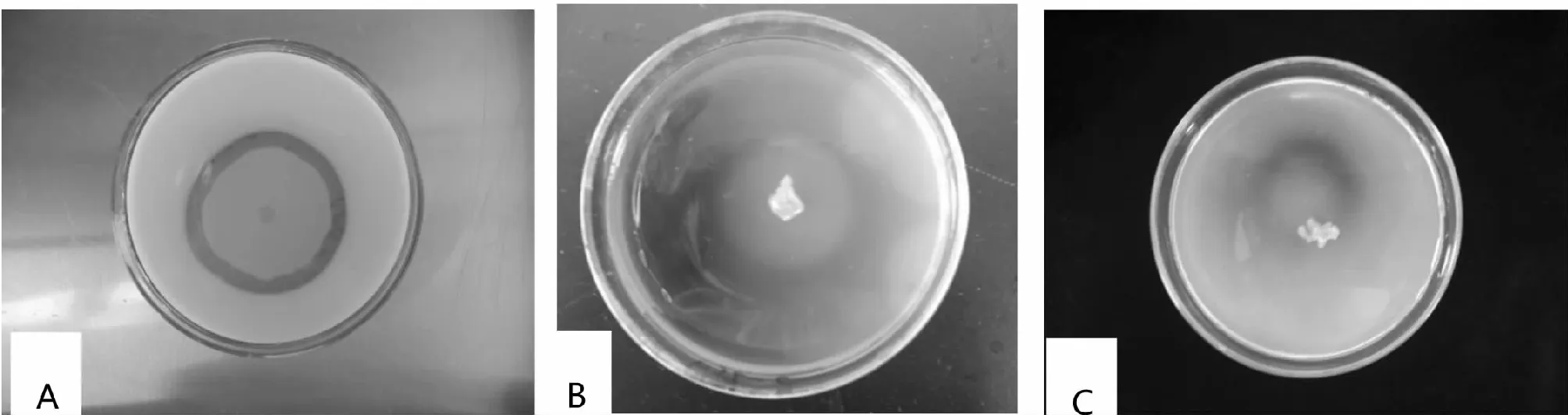
A:酪蛋白培养基;B:羧甲基纤维素钠培养基;C:几丁质酶培养基A:Casein medium;B:Sodium carboxymethylcellulose medium;C:Chitinase medium图5 bjq-a的产酶能力Fig.5 The enzyme-producing ability of strain bjq-a

表6 bjq-a发酵液中的细孢壁水解酶酶活性Table 6 The activity of cell wall hydrolase and IAA in the bjq-a fermentation liquid
3 讨 论
甲基营养型芽孢杆菌(Bacillusmethylotrophicus)是2010年Madhaiyan等[21]从水稻根系土中分离出的芽孢杆菌属新种,由于具有良好的抗逆能力,在生防菌剂的开发利用中备受关注。目前报道的甲基营养型芽孢杆菌大多从土壤、植物根系及海洋中分离得到,从植物内生菌中分离得到的报道相对较少,而从药用植物分离的目前也仅见对人参、夏枯草和山牵牛等的报道[9,16,22-24]。已有研究认为,植物内生菌作为生防菌具有效果显著、有效作用时间长、更易定殖等多种优势[25]。本研究应用山牵牛内生细菌——甲基营养型芽孢杆菌bjq-a菌株防治罗汉果斑枯病,其发酵液对罗汉果斑枯病病原菌菌丝生长的抑制率达99.5 %,孢子萌发抑制率达90.5 %,对离体接种罗汉果斑枯病病原菌的抑制率达84.0 %,表现出较强的拮抗活性,且通过后期观察发现防效稳定,持效期长,可见药用植物内生甲基营养型芽孢杆菌bjq-a菌株是一株具有较好应用前景的生防菌株。
目前关于甲基营养型芽孢杆菌对病原菌的作用机理的报道主要集中在竞争作用、拮抗作用和诱导抗性3个方面,其中报道较多的是拮抗作用,诱导抗性其次,竞争作用最少[24]。本研究中,菌株bjq-a与罗汉果斑枯病菌平皿进行对峙培养,对罗汉果斑枯病病原菌的抑制率为63.8 %,显著低于40 % bjq-a发酵液对罗汉果斑枯病菌病原菌的抑制率99.5 %,从初步的研究结果来看,bjq-a的空间竞争优势不及拮抗作用显著,而bjq-a是否具有诱导抗性将在下一步工作中开展相关研究。已有大量研究认为,甲基营养型芽孢杆菌的拮抗作用主要是通过产生各种代谢产物来抑制甚至杀死病原菌,目前报道较多的代谢产物是抗菌肽、蛋白酶和纤维素酶等[24-26]。本研究通过相关试剂盒检测bjq-a无菌发酵液中几丁质酶、纤维素酶和蛋白酶的活性分别为56.70、62.68和14.34 pg/mL,均显著高于空白对照。bjq-a发酵液中含有较高剂量的细孢壁水解酶类,推测这些水解酶即为抗菌活性物质的一部分,与吴一晶等[27]报道的结果相似。Liu等[28]提取纯化枯草芽孢杆菌B-916产生的抗菌物质,分离到一种新蛋白(Bacisubin),发现其能使立枯丝核菌菌丝顶端肿大、破裂。本研究显微观察结果表明,在bjq-a无菌发酵液作用下罗汉果斑枯病病原菌菌丝和孢子都有不同程度的畸形膨大表现,但是否由此类新蛋白(Bacisubin)或其他代谢产物引起,还需进一步探究。近年来陆续有报道称甲基营养型芽孢杆菌具有很好的抑菌作用和促生活性[24-26],如甲基营养型芽孢杆菌LW-4和H34对烟草青枯病的防治效果分别达70.37 %和60.98 %,且能不同程度地促进烟株生长[29-30];利用甲基营养型芽孢杆菌N5制备的生物有机肥不仅可以有效防治番茄青枯病,防效达69.00 %,还可促进番茄生长及提高根系活力[31]等。本研究还发现,bjq-a发酵液中含有一定剂量能促进植物生长的吲哚乙酸,故推测bjq-a不仅具有抑菌活性,可能也有一定的促生作用。该发现为将生防菌bjq-a开发成防病促生的生防菌剂或者微生物菌肥提供参考依据。
4 结 论
源自药用植物山牵牛的内生细菌——甲基营养型芽孢杆菌菌株bjq-a无菌发酵液对罗汉果斑枯病菌具有较强的拮抗作用,能使其病原菌丝及孢子畸形膨大,无菌发酵液中能检测出蛋白酶、纤维素酶和几丁质酶等多种细孢壁水解酶,是其产生拮抗作用的机理之一。因此,甲基营养型芽孢杆菌菌株bjq-a在罗汉果斑枯病生物防治中具有潜在应用价值。
