新发糖尿病治疗后短期出现进展性视网膜病变1例报告并文献复习
2020-04-21罗蓓蒙碧辉黄松
罗蓓,蒙碧辉,黄松
糖尿病视网膜病变(diabetic retinopathy,DR)的发生发展与糖尿病病程密切相关。陈霞琳等[1]研究显示,糖尿病病程5~10年者DR发生率为42.86%,10年以上者为75.81%。但2型糖尿病治疗前视网膜检查正常,治疗后数个月即出现视网膜病变并进行性恶化者文献报道较为少见。本文随访1例2型糖尿病患者4年余,初诊时以胰岛素短期强化治疗,6个月后即发生视网膜病变且进度迅速,现将其临床特点、诊疗经过进行总结,结合文献探讨其可能的发病机制,为临床医生提供参考。
1 病例介绍
患者,男,34岁,因多饮、多尿伴体质量下降半年于2014-03-12到广西医科大学第一附属医院就诊,查空腹血糖21.71 mmol/L收住院。否认高血压史,既往嗜烟、酒,病后已戒。家族中父母及兄弟姐妹无糖尿病史。无家族遗传病史。查体:血压 125/84 mm Hg(1 mm Hg=0.133 kPa,身高 162 cm,体质量 80 kg,腰围 101 cm,体质指数(BMI)30.48 kg/m2,其他无异常。
入院完善相关检查:餐后 2 h 血糖 27.21 mmol/L,糖化血红蛋白10.3%。血脂:总胆固醇4.8 mmol/L(参考值:3.1~5.2 mmol/L),低密度脂蛋白胆固醇 2.54 mmol/L(参考值:2.70~3.10 mmol/L),高密度脂蛋白胆固醇 1.09 mmol/L(参考值:1.16~1.42 mmol/L),三酰甘油 3.62 mmol/L(参考值 0.56~1.70 mmol/L)。肾功能:尿酸 499 μmol/L(参考值:204~428 μmol/L),其他指标无异常。肝功能、凝血功能无异常,甲状腺功能无异常,生长激素无异常。胰岛自身抗体:抗胰岛细胞抗体(ICA)阴性,抗胰岛素IgG抗体(IAA)阴性,谷氨酸脱羧酶抗体(GAD)阴性。C肽释放试验:0、30、60、120、180 min C 肽分别为 1.81、2.22、3.15、4.80、3.88 ng/ml,内源性胰岛素分泌峰值延后,提示胰岛功能下降,符合2型糖尿病性改变。尿常规:酮体阴性,24 h尿清蛋白27.9 mg。双侧颈动脉超声和双下肢动脉超声检查无异常。眼底照相结果无异常(见图1),肌电图/诱发电位检查无异常。入院诊断:代谢综合征、2型糖尿病、肥胖症、血脂代谢异常、高尿酸血症。
初期治疗措施:患者为新发2型糖尿病,根据2017年版中国2型糖尿病防治指南,糖化血红蛋白10.3%(>9.0%),空腹血糖21.71 mmol/L(>11.1 mmol/L),有多饮、多尿症状,体质量下降,有胰岛素强化治疗适应证[2],予胰岛素泵(门冬胰岛素)强化降糖治疗5 d,胰岛素总量48.2~50.6 U/d。血糖控制达标后撤泵改为皮下注射门冬胰岛素(三餐前各8 U)+地特胰岛素(睡前12 U)+二甲双胍片0.5 g(3次/d)。监测空腹血糖 5.3~6.2 mmol/L,餐后 2 h 血糖 7.7~9.6 mmol/L,带药出院,门诊随访。
患者出院后坚持按照以上治疗方案控制血糖,监测血糖控制良好,出院后6个月逐渐出现明显视力下降,2014-09-22眼底照相提示双眼底出血。眼底荧光造影(FFA)结果提示双眼视网膜病变,具体改变如下:右眼造影早期可见视网膜广泛分布点状血管瘤样强荧光;视盘表面及其周围可见团状强荧光;视网膜后极至中周部广泛分布大片无灌注区;部分视网膜静脉呈串珠样改变;视网膜血管末梢扩张,通透性增强;随时间延长,视网膜血管末梢及强荧光均增强,荧光素渗漏,晚期示视网膜后极部呈斑驳样团块样片状强荧光。左眼造影检查示视网膜后极至中周部广泛点状视网膜前遮蔽荧光(出血),其他改变与右眼大致相同。眼底造影诊断:双眼DR(增殖期,见图2)。
患者从2014-09-23开始分期进行双眼激光光凝治疗。当天检查空腹血糖 6.2 mmol/L,餐后 2 h 血糖 8.8 mmol/L,糖化血红蛋白7.5%,BMI 28.9 kg/m2。降血糖方案调整为二甲双胍1.5 g/d,格列美脲2 mg/d,罗格列酮4 mg/d。监测血糖、血脂均控制良好。
2015年12月突然出现右眼视力下降,于2016-02-20返院复查眼底照相示右眼视网膜脱离,左眼为激光光凝术后表现(见图 3)。查体:血压 118/85 mm Hg,体质量 65 kg,BMI 24.76 kg/m2,腰围 90 cm。右眼视力为 0,左眼视力 0.8。空腹血糖 5.3 mmol/L,餐后 2 h 血糖 6.8 mmol/L。总胆固醇 2.75 mmol/L,低密度脂蛋白胆固醇1.47 mmol/L,高密度脂蛋白胆固醇0.96 mmol/L,三酰甘油1.45 mmol/L。住院行右眼玻璃体切割术(PPV)、复杂网膜修补术,硅油填充,前膜剥离术。术后右眼视力未能恢复,左眼视力维持原状。出院后继续用药如下:格列齐特缓释片30 mg/d(1次/d)、二甲双胍肠溶片0.25 g(3次/d)、阿托伐他汀钙片10 mg/d(1次/d)、阿司匹林肠溶片0.1 g/d(1 次 /d)。
2018-03-02随访,患者空腹血糖5.1 mmol/L,餐后2 h血糖 6.8 mmol/L,糖化血红蛋白 6.2%,BMI 23.6 kg/m2。右眼失明,左眼视力未再下降。
2 讨论
2002年国际眼病学会制定了DR分级标准[3]。非增殖性DR(non-proliferative diabetic retinopathy,NPDR)分为 3 级。轻度:仅有微动脉瘤。中度:微动脉瘤,存在中度NPDR表现。重度:出现下列任何一种改变,但无增殖性DR(PDR)表现:(1)在4个象限中都有多于20处视网膜内出血;(2)在2个以上象限中有静脉串珠样改变;(3)在1个以上象限中有明显的视网膜内微血管异常。出现以下1种或多种改变者为PDR:新生血管形成、玻璃体积血或视网膜前出血。
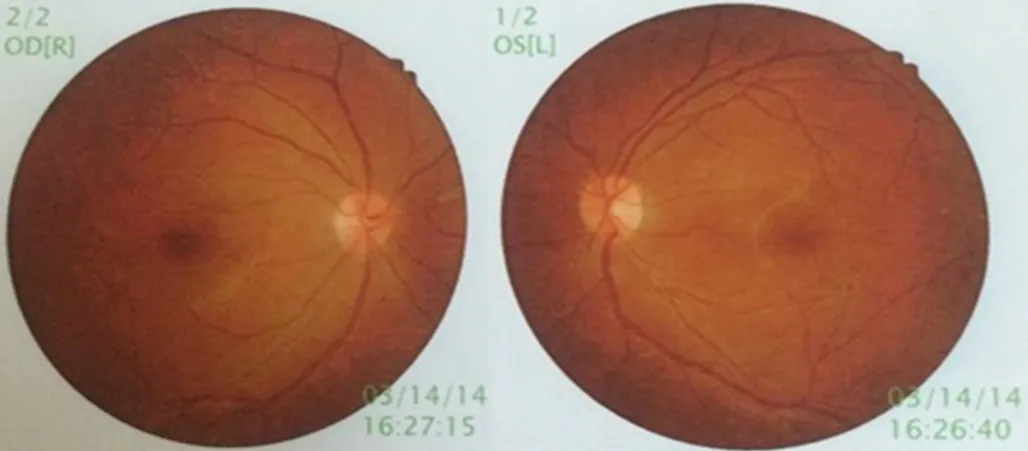
图1 2014-03-14治疗前眼底照相未见异常Figure 1 No abnormalities were found in pre-treatment fundus photography performed on 14 March 2014

图2 2014-09-22眼底荧光造影示增殖性视网膜病变Figure 2 FFA performed on 22 September 2014 showed proliferative retinopathy

图3 2016-02-20眼底照相示右硅油眼,左眼视网膜光凝术后改变Figure 3 Fundus photography performed on February 20,2016 showed right silicone oil eye and left retinal changes after photocoagulation
目前认为DR发生发展的主要危险因素包括血糖控制不佳、血压升高、糖尿病病程超过10年、微量清蛋白尿、高脂血症、贫血、妊娠等。但是,严格控制了血糖、血压、血脂,且没有贫血、非妊娠状态,仍有很多糖尿病病程小于10年的患者出现了与糖尿病肾病不平行的DR。因此,DR的发生发展仍有许多未明确的因素,如使用外源性胰岛素、机体胰岛素抵抗、血管内皮细胞功能紊乱、炎症免疫机制及遗传基因多态性等。
本例患者为新发2型糖尿病,中年男性,诊断糖尿病前肥胖多年,治疗后体质量逐渐下降到理想范围,并已戒烟、酒。患者初诊时空腹血糖、餐后2 h血糖、糖化血红蛋白均明显增高,无高血压、肾脏疾病或创伤史。按目前指南的建议,有使用胰岛素短期强化降血糖治疗的指征,初治时采取以胰岛素为主的降糖治疗,在病程中曾同时口服二甲双胍。治疗后血糖、血脂、BMI均得到了良好控制,治疗前眼底照相无异常,但治疗后6个月即出现视力下降,眼底检查示严重视网膜病变,且进展迅速。同步检查尿清蛋白正常,也无大血管病变的证据。显然,本例患者视网膜病变与一般DR发生发展规律不同。目前尚无二甲双胍等口服降糖药引起糖尿病视网膜病变发生发展的报道,难道胰岛素是DR的元凶?
胰岛素自商业化生产将近100年来,其全面推广应用挽救了成千上万的糖尿病患者生命,可以预见,在今后的相当长时间内尚难有可替代性的药物。胰岛素治疗可使血糖较快达到或接近参考范围,从而恢复或保护残存的胰岛β细胞功能,延缓糖尿病并发症的出现[4]。另外,因胰岛素可控制血糖、减少糖基化终产物(advanced glycation end products,AGEs)的形成,长期使用对l型糖尿病患者来说,肯定是利大于弊。然而,胰岛素治疗是一把“双刃剑”,发挥降糖作用的同时,还可导致低血糖的发生。另外,胰岛素相关性DR也已引起临床医生的广泛关注,开始胰岛素强化治疗的2~3年内可能使DR恶化[4]。
喀麦隆、土耳其、德国学者的前瞻性研究显示胰岛素是DR发生的危险因素[5]。王玲等[6]的研究也表明,大剂量使用外源性胰岛素是DR发生的独立危险因素,但机制尚未完全明了。其可能机制简述如下:(1)促进视网膜细胞生成。孙伟英等[7]体外培养发现,胰岛素超过一定水平时可明显促进Mailer细胞增殖,而Mailer细胞增殖与视网膜病变呈正相关。此外,外源性高水平的胰岛素可刺激视网膜血管内皮细胞异常增殖,从而促使视网膜新生血管生成[8]。(2)参与氧化应激。氧化应激反应是DR发生发展的重要因素[9]。WU等[10]在培养离体的牛视网膜色素上皮细胞实验中发现,胰岛素剂量与细胞内氧自由基的产生、血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达呈正相关。另有资料显示,胰岛素可通过体内磷脂酰肌醇-3-激酶(Phosphatidyl Inositol 3-kinase,PI3K)和蛋白激酶C反应途径刺激成纤维细胞与内皮细胞产生更多的氧自由基[11]。高水平的氧自由基可通过一系列氧化还原反应破坏细胞膜、促进细胞凋亡、破坏血-视网膜屏障;同时刺激视网膜色素上皮细胞内VEGF mRNA和相关蛋白高表达,抑制有保护作用的视网膜周细胞内色素上皮衍生因子(pigment epithelium-derived factor,PEDF)mRNA 的表达,继而反馈性地促进DR新生血管的形成[12]。(3)促进新生血管形成。胰岛素通过各种内分泌途径调节视网膜内多种不同细胞高表达VEGF,加速并促进生成视网膜新生血管。作为眼内最高效的促血管生长因子,VEGF也是视网膜内皮细胞的特异性分裂原,其水平增高会导致视网膜新生血管的大量生成,从而加快DR的发生发展。宋鄂等[13]体外培养发现,视网膜Mailer细胞VEGF水平与胰岛素呈剂量和时间依赖性升高。另外,胰岛素对VEGF表达的正性作用也在小鼠肌细胞内得到证实[14]。(4)影响“谷氨酸-谷氨酰胺循环”代谢。张晓梅等[15]研究发现,体外培养的兔视网膜Mailer细胞内谷氨酸、谷氨酰胺及谷胱甘肽水平随胰岛素水平升高及作用时间延长而下降。Mailer细胞是视网膜中唯一能合成谷氨酰胺合成酶的细胞[16],通过“谷氨酸-谷氨酰胺循环”维持细胞内外谷氨酰胺浓度恒定,避免视神经细胞损伤。当胰岛素水平增高,Mailer细胞谷氨酸-谷氨酰胺循环代谢障碍,便加速了视网膜神经细胞凋亡[17]。(5)胰岛素样生长因子-1(insulin like growth factor-1,IGF-1)作用。IGF-1是一种全能强效的细胞增殖调控因子,同时还具有胰岛素类似的促有丝分裂作用[18]。正常情况下,血-视网膜屏障可阻隔血液中IGF-1进入眼组织。在高糖环境下,血-视网膜屏障功能丧失,血循环中IGF-1渗漏到眼内。在视网膜修复损伤的过程中,IGF-1参与加速各种细胞的分裂、增殖,从而导致眼内新生血管形成和纤维增生[19]。LANDI等[20]研究证实,人眼内IGF-1能促进和加速视网膜内皮细胞形成新生血管。同时,IGF-1还可以刺激糖尿病患者视网膜的血管平滑肌细胞产生并释放某种纤溶酶原激活剂,降解血管基膜,从而诱导新生血管形成[21]。CHEN等[22]指出,IGF-1不但促进细胞迁移和增殖,还可溶解视网膜的胶原、基质及基膜,进而促进新生血管生成和视网膜病变的出现。
因此,如何扬长避短、科学合理应用胰岛素已成为重要的临床课题。目前认为出现了胰岛素强化治疗相关的DR,可考虑采取以下补救措施:(1)减少胰岛素剂量。CHANTELAU等[23]研究发现,胰岛素强化治疗能引发伴有急性黄斑水肿的DR,并且这些病变可以通过减少胰岛素剂量来改善。(2)改用激光治疗、基础药物和手术等综合治疗可阻止病情进展及对视力的进一步损害。但目前尚无特效药。本例患者出现严重DR后,及时减少了胰岛素剂量,同时配合激光、药物和手术治疗,但最终仍出现右眼失明,所幸是基本保留了左眼视力。
这里仍需要指出的是,不是所有经胰岛素强化治疗的患者都会发生进展迅速的视网膜病变。临床如何筛查并识别这些高风险个体,从而避免在这些个体中进行胰岛素强化治疗是未来需要研究的课题。目前,临床医生需要注意的是,一旦给患者进行了强化和/或常规胰岛素治疗,即应履行知情告知职责,告诉患者注意视力的改变,至少在进行胰岛素强化治疗后3~6个月或更长的一段时间内增加眼底检查的频率。
作者贡献:罗蓓、蒙碧辉、黄松负责文章的构思与设计;黄松负责文章的可行性分析;罗蓓、蒙碧辉负责文献收集,并对文章整体负责,监督管理;罗蓓负责文献整理、撰写论文;蒙碧辉负责论文修订、文章的质量控制及审校;蒙碧辉、黄松负责英文的修订。
本文无利益冲突。
