人参多糖对脑出血模型大鼠的干预效果及对海马区细胞凋亡的影响
2020-04-20郑希院翟洁敏李会琪赵龙斌高章代
郑希院,翟洁敏,李会琪,赵龙斌,高章代
脑出血是非外伤性脑组织内血管破裂引起的出血,是一种常见疾病、多发疾病,发病率与病死率呈上升趋势,属于急性脑血管病中的危重类型,严重危害人类的身体健康[1]。 患者在脑出血时,不但会出现血肿性病变,还会继发脑水肿、缺血、炎性反应、血肿周围组织能量代谢紊乱等一系列脑损伤[2]。脑出血患者发病年龄逐渐年轻化,即使幸存者亦会遗留不同程度的神经功能障碍,对患者的生活质量造成了严重影响,带来了沉重的经济负担[3]。脑出血造成的脑损伤,主要由血肿扩大导致的机械性压迫所致周围组织缺血及在血块形成过程中和形成后导致[4]。现观察人参多糖对脑出血模型大鼠的干预效果及对海马区细胞凋亡的影响,报道如下。
1 材料与方法
1.1 材料 (1)动物:健康雄性SD大鼠50只,月龄6~10(8.8±0.7)月,体质量340~480(360.0±58.6)g,由北京科奥力饲料有限公司提供[合格证号:京动(2000)第015号]。大鼠均生活于(24.0±2.1)℃的环境、无病原菌的饲养笼中,予高温及高压消毒的食物和水喂养。(2)试剂:人参多糖(陕西斯诺特生物科技有限公司),水合氯醛[生工生物工程(上海)股份有限公司],酶联免疫试剂盒(北京维德维康生物技术有限公司),TBARS试剂盒(江苏江莱生物科技有限公司)。(3)仪器:光镜(美国Ted Pella);冰箱(Eppendorf艾本德中国有限公司,型号 ep000000);电子天平(北京金达阳光科技有限公司,型号 CP153);恒温干燥箱(东菀市谱标实验器材科技有限公司,型号 SPCC);SuperMaze Morris水迷宫实验装置(上海欣软信息科技有限公司,型号 XR-XM101);BD FAC SCanto Ⅱ流式细胞仪(北京德利卡生物科技有限公司,型号 DLK0002051)。
1.2 实验方法 2019年5—7月于西安医学院第二附属医院神经内科实验室进行实验。
1.2.1 人参多糖提取物制作: 人参50 g加入蒸馏水100 ml中,冷浸过夜后,加热煮沸30 min,留取清亮液体小火加热浓缩到10 ml,制成含生药2 g/ml的药液,阴凉后以滤纸过滤药液,再用一次性针头滤器过滤后,分装于安瓿灭菌后放入冰箱备用。
1.2.2 大鼠脑出血模型建立:随机选取大鼠10只作为正常组, 余大鼠40只使用Rosenberg法制作脑出血模型[5],以10%水合氯醛400 mg/kg于大鼠腹部注射麻醉,固定在立体仪上,在头部正中进行纵行切口,剥离骨膜,使冠状缝和前囟裸露;在前囟前中线右侧2.0~3.0 mm处钻直径>1.0 mm小孔。使用微量注射器抽取股动脉50 μl血液,在钻孔处垂直进针6.0 mm左右,注入10 μl血液,2 min后以10 μl/min的速度将剩余的40 μl血液注入,留针10 min后,将针退出,并用消毒针将切口缝合,完成建模。大鼠脑横断面中出现明显血肿,血液无针道反流情况,无蛛网膜下腔出血,无血肿破入脑室视为造模成功。
1.2.3 分组及用药:将建模成功的大鼠40只以随机数字表法分为模型组及人参多糖低剂量组、中剂量组、高剂量组,各10只。人参多糖低剂量组给予2 mg/kg人参多糖,中剂量组4 mg/kg,高剂量组8 mg/kg,均灌胃3周。正常组及模型组大鼠均给予同等体积的无菌生理盐水灌胃。治疗期间所有大鼠均自由饮食。
1.3 观测指标与方法
1.3.1 大鼠脑出血组织观察: 大鼠在最后1次给药后4 h进行麻醉断头处理,取脑组织放置于4℃冰箱固定48 h,石蜡包埋切片、常规脱蜡、乙醇浸水,HE染色,光镜下常规组织学检查。
1.3.2 脑含水量、神经缺损评分及学习记忆能力评分测定:(1)脑组织含水量:使用干湿质量法检测,用精确度0.1 mg的电子天平分别测量5组大鼠的脑组织湿重,放在100℃的恒温干燥箱烘24 h至脑组织不再减轻为止,然后测量烘培后大鼠脑组织质量。脑组织含水量=(脑组织湿质量-脑组织干质量)/脑组织湿重×100%。(2)神经功能评分:使用Longa评分法[6],分为0~4级即为0~4分,无体征为0级,记0分;大鼠不能完全伸直前肢为1级,记1分;大鼠一侧肢体瘫痪,有追尾现象为2级,记2分;大鼠不能打滚或者站立为3级,记3分;无自发性活动,有意识障碍为4级,记4分。分值越高说明大鼠神经功能损伤越严重。(3)学习记忆能力评分:参照彭璇等[7]介绍的方法采用Morris水迷宫实验装置进行动态图像采集,分析大鼠学习记忆能力评分。大鼠在Morris水迷宫中训练5 d后,在第6天记录时间均值作为最终测定效果。
1.3.3 大鼠海马区细胞凋亡率检测: 使用流式细胞仪检测细胞凋亡,以37 ℃、5% CO2环境中进行培养传代至5孔板中的细胞,加入0.25%胰蛋白酶进行消化,使用2 000 r/min的离心机处理海马区细胞5 min后使用PBS缓冲液清洗2次,在避光常温环境中收取离心的海马区细胞,加入PI染液1 ml,放置1 h,然后用特异荧光标记后,使用鞘液包裹,在高速流动条件下,严格按照流式细胞仪操作说明检测细胞凋亡率。
涂料生产过程中VOCs的产生量取决于溶剂种类、生产设备和生产工艺等。一般而言,涂料生产过程中低沸点溶剂的用量越多,涂料生产过程为开放式、生产温度较高、生产时间越长,并且因生产自动化程度低而需要频繁清洗设备,那么VOCs的产生量就越多。
1.3.4 脑匀浆TNF-α、MDA含量检测: 取大鼠血肿周围的新鲜脑组织200 mg加入PBS缓冲液,离心处理15 min后弃去清液,待测。使用酶联免疫吸附实验法检测TNF-α浓度,严格按照酶联免疫试剂盒说明书操作。将采集后的脑组织匀浆使用硫代巴比妥酸法检测MDA含量,严格按照TBARS试剂盒说明书进行操作。
1.3.5 大鼠海马区相关蛋白Bcl-2、Akt、PI3K表达检测: 采用Western-blot法检测各组大鼠海马组织中Bcl-2、Akt、PI3K表达量,以GAPDH作为内参蛋白。

2 结 果
2.1 5组大鼠脑出血组织观察比较 与正常组比较,模型组出现脑出血组织细胞间隙增大,神经细胞固缩,胶质细胞增生等变化。与模型组比较,低剂量组、中剂量组、高剂量组脑组织的神经细胞和胶质细胞肿胀、间质水肿和炎性细胞浸润等均减轻。与低剂量组、中剂量组比较,高剂量组脑组织排列规整,间质水肿、胶质细胞肿胀等明显消退,见图1。
2.2 5组大鼠脑含水量、脑神经缺损评分及学习记忆能力评分比较 模型组大鼠脑含水量、脑神经缺损评分及学习记忆能力评分高于正常组(P均<0.05),低剂量组、中剂量组、高剂量组低于模型组(P均<0.05),中剂量组低于低剂量组,高剂量组低于中剂量组(P均<0.05),见表1。

表1 5组大鼠脑含水量、脑神经缺损评分及学习记忆能力评分比较
2.3 5组大鼠海马区细胞凋亡率比较 模型组细胞凋亡率高于正常组(P均<0.05),低剂量组、中剂量组、高剂量组低于模型组(P均<0.05);中剂量组低于低剂量组,高剂量组低于中剂量组(P均<0.05),见表2。
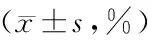
表2 5组大鼠海马区细胞凋亡率比较

图1 5组大鼠脑出血组织形态观察(HE染色,×400)

表3 5组大鼠脑匀浆TNF-α、MDA含量比较
2.5 5组大鼠海马区相关蛋白Bcl-2、PI3K/Akt表达比较 模型组大鼠海马区相关蛋白Bcl-2、PI3K/Akt表达均低于正常组(P均<0.05),低剂量组、中剂量组、高剂量组均高于模型组(P均<0.05),中剂量组高于低剂量组,高剂量组高于中剂量组(P均<0.05),见表4。

表4 5组大鼠海马区相关蛋白Bcl-2、PI3K/Akt表达比较
3 讨 论
脑出血属于一种急性疾病,发病率、病死率、致残率均较高,是神经系统的常见疾病,近年来我国脑出血的发病率逐渐升高,发病年龄也逐渐年轻化[8]。脑出血是重要的脑卒中类型,全世界范围的发病人数每年约有200万,脑出血占脑卒中的30%左右,病死率极高,即使幸存下来也会发生非常严重的神经功能障碍[9]。脑出血是指非外伤性脑实质内血管破裂引起的出血,脑组织神经细胞凋亡在病理生理过程中极其重要[10]。
人参在中医领域的应用历史悠久[11]。研究发现,人参除了根以外,茎、叶、花及果中都含有比例各异、组分不同的生物活性分子[12]。人参中主要有人参皂甙、人参多肽、人参多糖和人参花挥发油等生物活性物质,降解分离可以获得多种必需的氨基酸、脂肪酸及微量元素等[13]。人参多糖是最早研究的多糖类生物活性成分,主要作用是对免疫功能的影响及所产生的免疫性抗肿瘤活性[14],还能增加免疫力、降血糖、促进造血、抗衰老、抗菌、抗炎等[15]。
TNF-α可在组织损伤中增加脑血管内皮细胞一氧化氮的毒性作用,增加血管内皮的通透性,破坏血脑屏障,使血管源性脑水肿加重。TNF-α可以趋化中性粒细胞、单核细胞及淋巴细胞从而导致白细胞聚集阻塞微血管,导致继发性缺血缺氧,从而使脑水肿和继发性脑损伤加重[16]。基于人参多糖具有抗炎、增强免疫力的药理作用,在本研究中分析人参多糖对脑出血大鼠脑匀浆TNF-α含量的影响,结果显示,人参多糖干预后,脑出血大鼠脑匀浆中TNF-α含量显著降低,且剂量越高脑出血大鼠脑匀浆中TNF-α含量越趋近于正常。此结果说明,人参多糖可通过降低脑出血大鼠脑匀浆中TNF-α含量,来抵抗大鼠机体炎性反应,增强免疫力,修复大鼠脑损伤。MDA属于自由基与生物膜不饱和脂肪酸发生脂质过氧化反应的代谢产物,反映氧自由基含量的指标[17]。脑出血患者发病后血肿周围存在组织损伤和水肿区域,该区域内脑组织会发生复杂的病理变化,对脑出血患者病情程度及预后造成了严重影响,在病理因素中,自由基的作用非常重要[18]。脑出血发生后,大鼠脑组织匀浆中MDA含量显著增加,其增加实质为自由基所引起的神经细胞过氧化,而人参多糖可增强机体清除自由基的能力,降低MDA含量,进而减轻脑损伤。本研究结果显示,运用人参多糖干预的脑出血大鼠脑匀浆中MDA含量均显著降低,且剂量越高脑出血大鼠脑匀浆中TNF-α、MDA含量越趋近于正常,此结果说明,人参多糖可通过降低自由基所引起的神经细胞过氧化,来抑制MDA表达,降低脑损伤程度。
神经细胞凋亡的发生与氧自由基、细胞内钙超载及兴奋性氨基酸毒性等因素引起线粒体的损伤等有关,通过抗氧自由基、抑制细胞内钙超载等措施来减少细胞凋亡能起较好的神经保护作用。而人参多糖可降低自由基所引起的神经细胞过氧化。本结果显示,人参多糖干预脑出血模型大鼠海马区细胞凋亡率相对较低,并随着时间的推移,细胞凋亡率不断下降,说明使用人参多糖干预脑出血模型大鼠对海马区细胞起到抑制凋亡的作用。PI3K不仅具有脂类激活酶活性,还具有蛋白激酶的活性。脑出血后,机体释放一些具有酪氨酸激酶受体激活物质,激活PI3K从而磷酸化细胞膜上的肌醇。Akt属于PI3K下游的效应分子,活化后可通过控制凋亡的方式,促进细胞存活生物效应并实现调控生长因子来诱发细胞生长[19]。Bcl-2属于重要的抗凋亡基因。本结果显示,人参多糖对脑出血模型大鼠进行干预后,脑出血模型大鼠Bcl-2、Akt、PI3K表达量相对较高,说明人参多糖能够促进海马区细胞的增殖,进而修复脑损伤。
综上所述,人参多糖治疗脑出血,能够改善大鼠记忆能力,减少脑含水量,抑制海马区细胞凋亡,降低脑出血后继发性损伤,为临床治疗脑出血提供理论依据。
利益冲突:无
作者贡献声明
郑希院、翟洁敏:设计研究方案,实施研究过程,论文撰写;李会琪、赵龙斌:提出研究思路,分析试验数据,论文审核,进行统计学分析;高章代:实施研究过程,资料搜集整理,论文修改
