补骨脂及其主要成分对人正常肝细胞L02的损伤作用研究*
2020-04-20王晓艳李伟霞张书琦宋少华唐进法
王晓艳,李伟霞,张 辉,张书琦,宋少华,王 炎,唐进法
(1.河南中医药大学第一附属医院中药临床评价技术河南省工程实验室,河南 郑州 450000; 2.河南中医药大学药学院,河南 郑州 450008)
补骨脂为豆科植物补骨脂PsoraleacorylifoliaL.的干燥成熟果实[1],其性温,味苦、辛,具有温肾助阳、纳气平喘、温脾止泻的功效,为临床常用补益类中药,目前已开发形成220种中成药制剂。近年来,补骨脂相关制剂致肝损伤现象屡见报道[2-3],国家药品不良反应监测中心多次通报警示补骨脂相关制剂(壮骨关节丸和仙灵骨葆胶囊)临床应用致肝损伤,此外,还有单味补骨脂引发肝损害的临床病例报道[4-5],给临床用药带来风险。随着对补骨脂的深入研究,已从中分离出香豆素类、黄酮类及单萜酚类三大类主要化合物成分近百种。研究发现,各类主要成分中均具有肝细胞毒性物质[6-7],但缺乏各类成分对肝细胞毒性作用差异的比较研究。本实验以人正常肝细胞系(L02肝细胞)为评价模型,对比研究补骨脂及其主要香豆素类成分(补骨脂素、异补骨脂素、补骨脂定)、查尔酮类成分(补骨脂甲素、补骨脂乙素)和单帖酚类成分(补骨脂酚)对人正常肝细胞系L02的毒性差异,为阐明补骨脂致肝损伤的物质基础提供实验依据。
1 材料与方法
1.1 细胞与细胞培养
人正常肝细胞系L02,由河南中医药大学科研实验中心惠赠。常规培养在含有体积分数100 mL/L胎牛血清、100 U/ mL青霉素和100 U/ mL链霉素的DMEM完全培养液中,放置于37 ℃、体积分数50 mL/L的CO2的饱和湿度培养箱中进行培养,隔天换液,后续实验均在状态良好的细胞生长对数期进行。
1.2 药品、试剂与仪器
生补骨脂购自亳州广源堂中药饮片有限公司,批号180601,经河南中医药大学第一附属医院李学林主任药师鉴定,确认为豆科植物补骨脂的干燥成熟果实。补骨脂以体积分数为950 mL/ L乙醇回流提取,浸泡0.5 h后,加10倍量溶剂,回流提取2次(分别为2 h、1.5 h),纱布过滤收集滤液,合并2次乙醇提取液,经旋转蒸发仪减压浓缩后真空干燥,制得干膏,备用。补骨脂素(批号16062808)、异补骨脂素(批号16062807)、补骨脂甲素(批号16110701)、补骨脂乙素(批号17022701)、补骨脂定(批号16042601)和补骨脂酚(批号160331),均购自成都普菲德生物技术有限公司,HPLC纯度均≥98%;磷酸缓冲液(PBS),购自博斯特生物技术有限公司,批号PYGOO21;四唑盐(MTT,批号911L051)、二甲基亚砜(DMSO,批号1213C0330)和青链霉素混合液(批号20190320),均购自北京索莱宝科技有限公司;胎牛血清(批号NYMI1035)、胰酶(批号J170003)和DMEM(批号AL209346),均购自HyClone公司;乳酸脱氢酶(LDH)检测试剂盒(批号20190312)、丙氨酸氨基转移酶(ALT)检测试剂盒(批号20190408)和天门冬氨酸氨基转移酶(AST)检测试剂盒(批号20190407),均购自南京建成生物工程研究所。CO2恒温培养箱、酶标仪、-80 ℃超低温冰箱、离心机,均为Thermo赛默飞世尔科技(中国)有限公司产品;超净工作台,苏州净化设备有限公司产品;倒置相差显微镜,Motic麦克奥迪实业集团有限公司产品;细胞培养瓶、细胞培养板均为美国康宁公司产品;加样槽,BIOFIL广州洁特生物过滤股份有限公司产品;电热恒温水浴锅,上海森信实验仪器有限公司产品。
1.3 检测指标
1.3.1 给药质量分数和时间确定
配制适量补骨脂母液(按生药量换算,下同),分别稀释至2,1,0.5,0.25,0.125,0.06,0.03,0.015 g/L备用。取对数生长期的L02,经质量分数2.5 g/L的胰酶消化,用完全培养液制成细胞悬液,取10 μL置显微镜下计数,调整细胞浓度为5×104个/mL,接种于96孔培养板中,每孔100 μL,每组设置6个复孔。待12 h细胞贴壁后,吸弃96孔板中旧的培养液,对照组用含体积分数1 mL/L DMSO的培养液,给药组用含补骨脂提取物质量分数为2,1,0.5,0.25,0.125,0.06,0.03,0.015 g/L的培养基分别培养24,48,72 h。每孔加入20 μL的MTT溶液(5 g/L),37 ℃孵育箱孵育4 h,细胞内形成蓝紫色结晶,吸弃孔内含MTT的培养液,每孔分别加入100 μL的DMSO,轻微震摇5 min,使结晶完全溶解,采用酶标仪检测吸光度(波长为570 nm),并计算细胞抑制率。
1.3.2 细胞抑制率
取补骨脂素、异补骨脂素、补骨脂甲素、补骨脂乙素、补骨脂酚和补骨脂定样品适量,每种成分以DMSO分别配制成6.25,12.5,25,50,100,150和200 mg/L药液,对照组为含体积分数1 mL/L的DMSO。调整细胞密度,接种在96孔培养板中,放置于37 ℃、体积分数为50 mL/L 的CO2培养箱中培养12 h;吸弃各孔中培养液,分别加入各质量分数样品培养液200 μL,每个质量分数设置6个复孔,放置于37 ℃、体积分数为50 mL/L的CO2培养箱中分别孵育24,48,72 h;各孔均加入预先配制好的MTT溶液20 μL,继续培养4 h;吸弃含MTT的培养液,每孔加入100 μL的DMSO,轻微震摇5 min,使结晶完全溶解;于酶标仪570 nm波长处读取吸光度(A),计算细胞抑制率,并计算IC50值。
1.3.3 AST、ALT活性及LDH释放率
取补骨脂素、异补骨脂素、补骨脂甲素、补骨脂乙素、补骨脂酚和补骨脂定样品适量,每种单体均以DMSO分别配制成25,50和100 mg/L药液,对照组用体积分数为1 mL/L的DMSO。以每孔5 000个细胞的密度接种于96孔培养板中,放置于37 ℃、体积分数为50 mL/L的CO2培养箱中培养24 h,收集细胞上清液,采用生化试剂盒检测AST、ALT活性及LDH释放率。
1.4 统计学方法

2 结 果
2.1 不同质量分数的补骨脂对L02肝细胞的抑制作用
补骨脂醇提物药液作用于L02肝细胞24 h,补骨脂质量分数从15 mg/L以2倍速增至60 mg/L的过程中,其对L02肝细胞增殖的抑制作用并不明显(P>0.05),均低于10%;而补骨脂质量分数增至125 mg/L时,抑制作用显著增加(P<0.05),当质量分数增加至2 g/L时,细胞抑制率高达60%左右。对比相同质量分数补骨脂作用不同时间,发现24和48 h之间差异无统计学意义(P>0.05),而与72 h相比,个别质量分数对L02肝细胞的抑制率变化明显(P<0.05)。见图1。因此本研究选择24,48和72 h为给药时间,进一步考察补骨脂及其主要成分对L02肝细胞的毒性。

图1 不同作用时间及不同质量分数补骨脂对L02肝细胞的抑制作用
2.2 补骨脂主要成分对L02肝细胞的抑制作用
分别给药培养24,48和72 h后检测,发现补骨脂素、异补骨脂素、补骨脂甲素、补骨脂乙素、补骨脂酚及补骨脂定对L02肝细胞抑制率均较高(P<0.05)。24 h的IC50值排序为补骨脂定<补骨脂甲素<补骨脂酚<补骨脂乙素<补骨脂素<异补骨脂素。补骨脂定25 mg/L给药时对肝细胞的抑制率已达到49%,50 mg/L时抑制率高达77%,但持续增加质量分数至200 mg/L其对肝细胞的抑制率保持不变;而补骨脂甲素50 mg/L时抑制率为67.29%,100 mg/L时抑制率高达81.95%,但持续增加质量分数至200 mg/L其对肝细胞的抑制率保持不变。结果显示:质量分数50 mg/L以下时,相同给药质量分数条件下比较,补骨脂定对L02肝细胞抑制率较其他成分大;50 mg/ L以上时,补骨脂甲素对L02肝细胞抑制率较其他成分大。结果见图2。
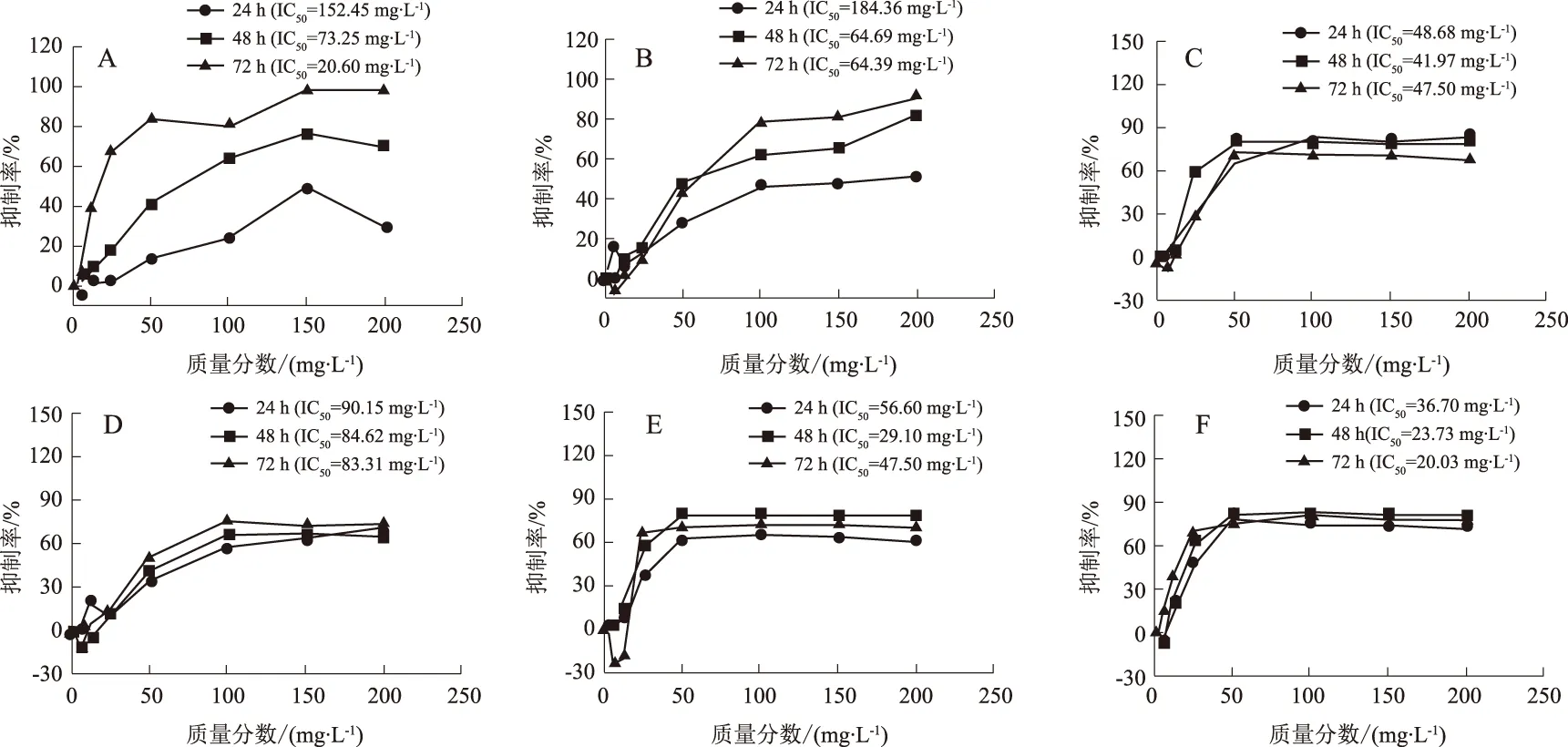
图2 补骨脂主要成分补骨脂素(A)、异补骨脂素(B)、补骨脂甲素(C)、补骨脂乙素(D)、补骨脂酚(E)及补骨脂定(F)对L02肝细胞的抑制作用
2.3 补骨脂及其主要成分对AST、ALT活性及LDH释放率的影响
因24,48,72 h补骨脂主要成分对L02肝细胞增殖抑制率差异不大,故选择给药培养24 h对补骨脂素、异补骨脂素、补骨脂甲素、补骨脂乙素、补骨脂酚及补骨脂定对L02肝细胞的毒性进行评价。当以质量分数50 mg/ L给药时,补骨脂定对LDH的影响(升高15%)大于其他5个成分,而对ALT和AST的变化影响则小于异补骨脂素、补骨脂酚及补骨脂乙素;给药100 mg/ L时,补骨脂定对LDH的影响大于补骨脂甲素,但小于补骨脂乙素(升高42%),而对ALT和AST无明显影响。见图3。
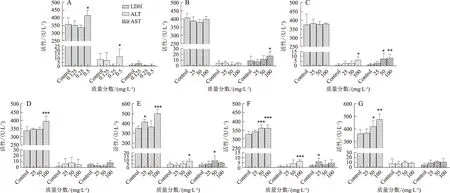
注:与对照组相比*P<0.05,**P<0.01,***P<0.001
3 讨 论
补骨脂作为传统补益类中药,临床运用广泛,历代医家用于治疗肾虚、冷泻、遗精滑精、小便频数、腰膝冷痛等,外用治疗皮肤病、白癜风等。现代药理学研究表明,补骨脂具有扩张冠状动脉、抗氧化、抗肿瘤、抗菌、抗炎、抗抑郁、促进骨生长、神经保护、雌激素样等多种作用[8-9]。据统计,含补骨脂的常用中成药多达30余种。近年来补骨脂及其制剂的肝毒性引起了国内外学者的广泛关注[10]。在动物实验中,大剂量补骨脂水提物[11]、盐补骨脂生粉、补骨脂生粉[12]、补骨脂醇提物[13]均表现出肝毒性,但补骨脂诱发肝损伤的毒性物质基础及确切机制尚不明了。
L02肝细胞对外源化合物具有较强的代谢能力,且该细胞株成熟、稳定,易于培养,被广泛用于药物的细胞毒性筛选[14]。MTT法是一种检测细胞存活和生长常用的简便且准确方法,其检测原理为活细胞线粒体中的琥珀酸脱氢酶能使外源性MTT还原水不溶性的蓝紫色结晶物甲臜,并沉积在细胞中,而死细胞无此功能。异丙醇、二甲亚矾、SDS等有机溶剂能溶解细胞中的甲臜,在570 nm处有较强吸收[15],可间接反映活细胞数量。
本实验采用能够最接近模拟药物诱发人正常肝细胞毒性作用的L02作为研究对象,根据补骨脂产生肝损伤作用的药理特征,通过检测补骨脂及其不同类成分对L02细胞增殖的影响,以细胞抑制率作为检测指标,通过对细胞密度、药物质量分数、药物作用时间等一系列影响因素的筛选,建立了补骨脂肝毒性的细胞检测方法。此方法操作简单快捷,灵敏度较高,可作为评价补骨脂体外肝毒性的有效方法。通过对补骨脂及其主要成分的肝损伤评价,可初步认为异补骨脂素、补骨脂素、补骨脂甲素、补骨脂乙素、补骨脂酚和补骨脂定可能是补骨脂致肝细胞损伤的潜在成分。同等质量分数条件比较,补骨脂定和补骨脂甲素对肝细胞抑制率高于补骨脂素、异补骨脂素、补骨脂乙素、补骨脂酚。对生化指标的影响显示:25 mg/L时,补骨脂定对LDH的影响大于其他5个成分;100 mg/ L时,补骨脂定对LDH的影响大于补骨脂甲素,但小于补骨脂乙素,但对ALT和AST无明显影响。抑制率与生化指标检测结果基本一致。
综上所述,异补骨脂素、补骨脂素、补骨脂甲素、补骨脂乙素、补骨脂酚和补骨脂定是补骨脂导致肝细胞损伤的潜在成分,且补骨脂甲素和补骨脂定毒性强于其他4个成分。本研究还存在一些局限性,采用肝脏实质细胞进行体外实验并不能完全模拟机体对药物的吸收、分布、代谢及排泄等各过程,并且肝脏组织中还存在其他类似肝窦内皮细胞和枯否细胞等非实质细胞;因此,后续实验将基于以上结果,一方面研究补骨脂及其主要成分对非实质细胞的影响及作用机制,另一方面对其进行体内实验的研究,为深入研究补骨脂致肝损伤的物质基础及作用机制提供实验依据。
