RNA干扰维生素D受体基因表达对HK-2细胞中钠/二羧酸协同转运蛋白1表达的影响
2020-04-20
昆明医科大学第一附属医院泌尿外科(昆明650032)
泌尿系结石是泌尿外科最常见的疾病,当泌尿系结石是潜在的代谢紊乱的症状时,复发风险较高[1]。低枸橼酸尿症是泌尿系结石病因之一,枸橼酸是尿液草酸钙结晶生长的最重要也是最强抑制物,它能有效的抑制尿液中草酸钙结晶的生长和聚集[2-3]。约有19%~63%的含钙结石患者常常伴有低枸橼酸尿症[4],因此低枸橼酸尿是促进草酸钙结石形成的重要危险因素之一[2,5-6]。
目前研究表明,枸橼酸经肾小球滤过后在近端肾小管被重吸收,而近端肾小管几乎不分泌枸橼酸,因此尿中枸橼酸的浓度主要决定于近端肾小管的重吸收能力。近端肾小管上皮细胞存在一种能介导枸橼酸重吸收的载体,即钠/二羧酸协同转运蛋白[Na(+)-dicarboxylate cotransporter,NaDC][7]。位于肾脏近端小管刷状缘侧的低亲和力NaDC1是调控尿液枸橼酸排泄的关键蛋白,有学者也提出维生素D受体(vitamin D receptor,VDR)在二羧酸转运蛋白的蛋白激酶调节途径中起到重要作用[8-10],而NaDC1 正是一种二羧酸转运蛋白,但VDR 基因表达改变后是否能调节NaDC1的表达或者活性从而产生了低枸橼酸尿症有待研究。故此本课题组假设VDR 通过与NaDC1的关联,参与了尿枸橼酸的调控。本课题组前期研究发现VDR和NaDC1 分别在人肾近曲小管上皮细胞(HK-2细胞)核膜和胞膜表达,所以HK-2细胞是低枸橼酸尿症病因学体外研究的理想细胞[11]。本研究拟运用RNA干扰技术减低HK-2细胞中VDR的表达,并通过分子生物学技术检测NaDC1的表达变化,从细胞水平探讨VDR 与NaDC1 在尿枸橼酸调控中的关系,从而为揭示低枸橼酸尿症的发病机制奠定基础。
1 材料与方法
1.1 主要材料HK-2细胞购自中国科学院昆明动物研究所细胞库,Lipofectamine 2000(美国Thermo Fisher 公司),DMEM 细胞培养液与胎牛血清(美国Gibco 公司),RT-PCR 试剂盒(日本Takara 公司),RNAiso Plus 溶液(日本Takara 公司),VDR 单克隆抗体(美国CST 公司),NaDC1 多克隆抗体(英国abcam 公司),β-actin 单克隆抗体(美国CST 公司)。
1.2 方法
1.2.1 siRNA的设计与合成根据GeneBank 提供的VDR 基因序列设计合成VDR的6 条siRNA,序列如下:siRNA-1:5′-GUGCCAUUGAGGUCAUCAUTT-3′;siRNA-2:5′-CCUGCUCAGAUCACUGUAUTT-3′;siRNA-3:5′-GCUUUCACUUCAAUGCUAUTT-3′;siRNA-4:5′-GCAGCGCAUCAUUGCCAUATT-3′;siRNA-5:5′-GGAGUUCAUUCUGACAGAUTT-3′;siRNA-6:5′-GCUCGAAGUGUUUGGCAAUTT-3′;negative control:5′-UUCUCCGAACGUGUCACGUTT-3′,由上海吉玛制药技术有限公司合成。
1.2.2 细胞培养在生物安全柜中严格无菌操作培养细胞。将冻存的HK-2细胞复苏后,用枪头转移到放有5 mL 培养基(DMEM,含2 mmol/L L-glutamine和10%胎牛血清)的培养瓶中置于湿度培养箱于37℃、5%二氧化碳条件下培养,之后每天于倒置显微镜下观察细胞状态,3~4 d 待HK-2细胞生长至80%~90%汇合时传代1次。首先弃去培养液,用PBS 洗2次。然后加1 mL 胰酶于培养瓶中,倒转放于37℃培养箱1~3 min 预热,然后将培养瓶翻过来让胰酶与细胞面接触大约10~30 s,在倒置显微镜下观察细胞消化情况,见细胞大部分变圆,迅速拿回操作台,轻敲几下培养瓶后加少量完全培养基终止消化,分到新的培养瓶中继续培养。
1.2.3 转染及分组参照Lipofectamine 2000 说明书,将细胞接种于六孔板内,培养24 h 后细胞汇合度达50%~70%,弃旧培养基,更换1.5 mL 无血清的DMEM 培养基,准备作为脂质体转染的细胞板。将250 μL 无血清的Opti-MEM 培养基加入到无菌的1.5 mL EP 管中,再加入5 μL Lipofectamine 2000,轻轻混匀,于室温放置5 min。将250 μL 无血清的Opti-MEM 培养基加入到无菌的1.5 mL EP管中,再加入5 μL siRNA 溶液,混匀。将上述两种EP 管中的溶液放一起混匀,室温孵育20 min。将500 μL 混合液加入到上述六孔板细胞中,摇匀,放置37℃,5%CO2的孵箱内培养。6 h 后换含10%FBS的DMEM 培养基培养48 h。siRNA有效筛选实验分为阴性对照组(转染阴性对照siRNA)与siRNA干扰组(siRNA-1~siRNA-6)。筛选出有效siRNA 后检测NaDC1的mRNA及蛋白表达水平实验分为阴性对照组(转染阴性对照siRNA)与siRNA干扰组(siRNA-2~siRNA-4)。
1.2.4 细胞总RNA提取收集转染48 h的HK-2细胞,向收集的细胞中加入1 mL RNAiso Plus 溶液,混匀,室温孵育10 min,充分裂解细胞。收集细胞裂解液入1.5 mL 离心管中,加入200 μL 氯仿,振荡,室温静置5 min,13 000 r/min,4℃离心15 min。吸取离心好的上清,并转移至新的离心管中,加入等体积异丙醇500 μL。充分混匀,冰上放置30 min。13 000 r/min,4℃离心10 min。小心弃上清,可见管底有白色沉淀,加入1 mL 预冷的75%乙醇。7 500 r/min,4℃离心5 min。弃上清,倒立离心管于吸水纸上,超净工作台中晾干后,加入20 μL DEPC 水溶解沉淀,即为总RNA 样品。
1.2.5 RT-PCR 及qPCR 检测取总RNA 样品,运用RT-PCR 逆转录合成cDNA 后用特异引物扩增内参和目的条带,并进行对比。将mRNA 表达标准化至GAPDH 水平表达。在mRNA的表达的变化可以根据计算2-ΔΔCT方法(CT,循环阈值),与ΔCT=CTtargetgene-CTGAPDH和ΔΔCT=ΔCT实验-ΔCT空白。分别记录内参基因GAPDH、VDR及NaDC1 mRNA的表达水平,重复3次检测取平均值,以内参基因GAPDH表达量为参照,对各mRNA 表达量作描述。引物序列见表1。实验重复3次。
1.2.6 Western Blot检测收集处理后的细胞,加入细胞裂解液,提取蛋白质。调整蛋白浓度一致,加等量的3×上样缓冲液,配制12%的聚丙烯酰胺分离胶,每孔上样50 μg 蛋白,电泳分离蛋白,转膜,5%脱脂牛奶封闭2 h 后,加入相应的一抗(anti-VDR,1∶1 000;anti-NaDC1,1∶1 000)4℃孵育过夜,以β-actin 作内参(1∶5 000)。洗涤3次,加入相应二抗(兔抗)37℃孵育2 h,洗膜8次,用ECL 发光法检测目的条带的表达。以内参蛋白β-actin 表达量为参照,对各蛋白表达量作描述。实验重复3次。
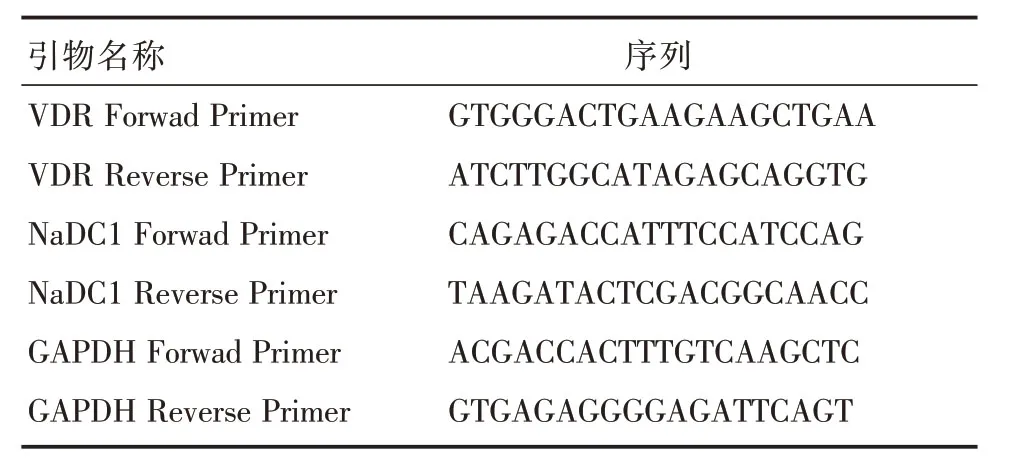
表1 引物序列Tab.1 Primer sequence
1.3 统计学方法应用SPSS 22.0 软件进行统计学分析,计量结果以均数±标准差表示,VDR及NaDC1的mRNA和蛋白表达量差异即计量资料之间采用单因素方差分析检验总体平均数间是否存在差异,采用Tukey 检验确定哪两个资料间存在差异,P<0.05 为差异具有统计学意义。
2 结果
2.1 筛选出有效的siRNA在细胞转染后,通过RT-PCR 检测干扰HK-2细胞后VDR的mRNA 水平,以内参基因GAPDH 表达量均值为参照值1.0,siRNA-1 至siRNA-6 六组中VDR的mRNA 相对表达水平分别为(0.77±0.09)、(0.11±0.08)、(0.07±0.01)、(0.03±0.02)、(0.76±0.13)及(0.87±0.07)。结果7组mRNA 比较差异有统计学意义(F=69.50,P<0.05),其中发现siRNA-2(q= 17.50)、siRNA-3(q= 18.24)和siRNA-4(q= 19.10)能够显著降低VDR的mRNA 水平,且差异具有统计学意义(P<0.05),其中siRNA-4 效果最为显著。阴性对照组(NC)与siRNA-1(q= 4.56)、siRNA-5(q=4.82)和siRNA-6(q=2.58)之间差异无统计学意义(P>0.05)。见图1。
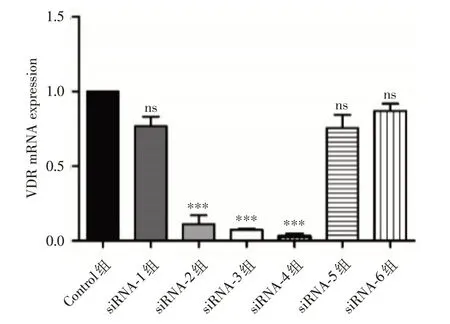
图1 RT-PCR 检测siRNA转染后VDR mRNA的表达Fig.1 The expression of VDR mRNA after siRNA transfection by RT-PCR
进一步采用Western Blot 方法检测了6 条siRNAs 在HK-2细胞中对VDR的敲降效率,以内参基因β-actin 表达量为参照(1.16 ± 0.08),siRNA-1至siRNA-6 六组中VDR的蛋白表达水平分别为(0.97 ± 0.05)、(0.44 ± 0.06)、(0.44 ± 0.13)、(0.43± 0.13)、(0.83 ± 0.06)及(0.98 ± 0.05)。结果7组VDR 蛋白比较差异有统计学意义(F= 25.37,P<0.05),其中发现siRNA-2(q= 11.78)、siRNA-3(q=11.78)和siRNA-4(q=11.98)能够显著降低VDR的蛋白质水平,且差异具有统计学意义(P<0.05)。但siRNA-1(q=3.11)、siRNA-5(q=5.43)和siRNA-6(q=3.05)却不能显著降低VDR的蛋白水平(P>0.05),因此选择siRNA-2、siRNA-3和siRNA-4 这3 条siRNA 进行后续实验。见图2。
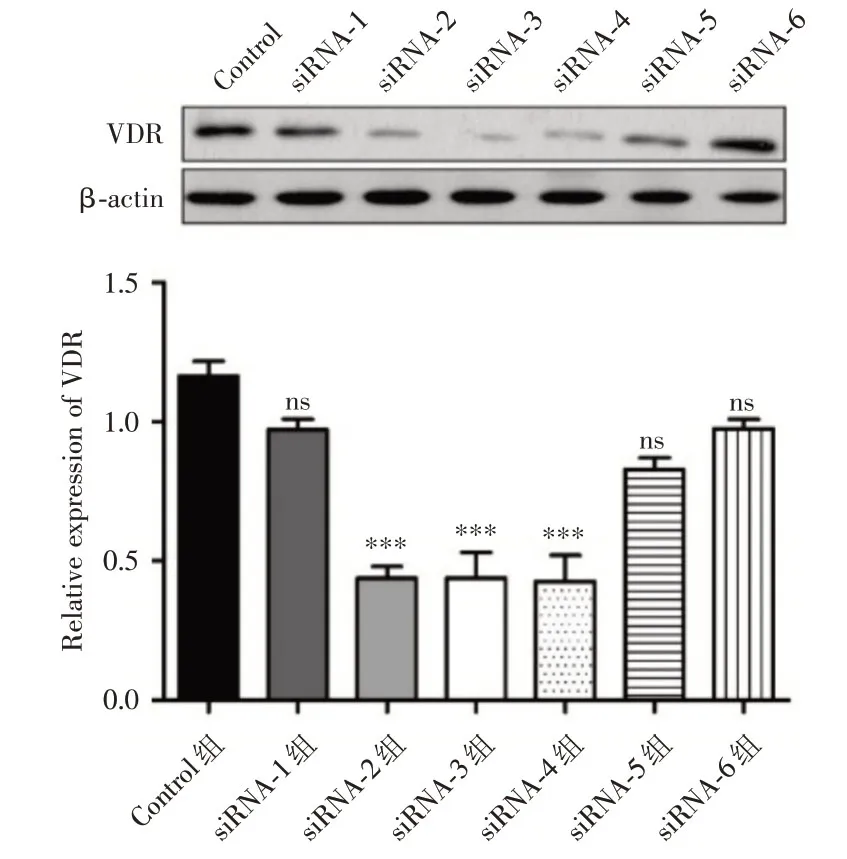
图2 WB检测siRNA转染后VDR 蛋白的表达Fig.2 The expression of VDR protein after siRNA transfection by WB
2.2 RT-PCR检测转染siRNA 后对NaDC1mRNA表达的影响 选择siRNA-2、siRNA-3和siRNA-4三条已经筛选有效的siRNA 进行转染实验,转染48 h后。运用qPCR检测NaDC1的mRNA表达水平,以内参基因GAPDH 表达量均值为参照值1.0,siRNA-2至siRNA-4三组中NaDC1的mRNA相对表达水平分别为(0.04 ± 0.02)、(0.11 ± 0.18)及(0.05 ± 0.01)。结果4组NaDC1 mRNA 比较差异有统计学意义(F=2213,P<0.05),siRNA-2(q=96.65)、siRNA-3(q = 89.69)和siRNA-4(q= 95.31)组NaDC1的mRNA 表达水平显著降低,且差异均具有统计学意义(P<0.05)。见图3。
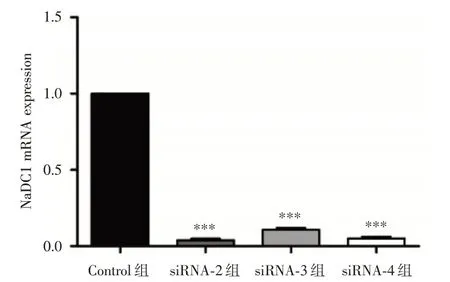
图3 RT-PCR 检测siRNA转染后NaDC1 mRNA的表达Fig.3 The expression of NaDC1 mRNA after siRNA transfection by RT-PCR
2.3 WesternBlot检测转染siRNA 后对NaDC1 蛋白表达的影响 运用Western Blot检测NaDC1的蛋白表达水平,以内参基因β-actin 表达量为参照(1.81±0.29),siRNA-2 至siRNA-4 三组中VDR的蛋白表达水平分别为(1.26±0.09)、(0.92±0.10)及(0.94±0.03)。结果4组NaDC1 蛋白比较差异有统计学意义(F= 13.71,P<0.05),siRNA-2(q= 4.86,P<0.05),其中siRNA-3(q=7.95,P<0.05)和siRNA-4(q= 7.74,P<0.05)组NaDC1的蛋白表达水平显著降低,且差异具有统计学意义(P<0.05)。见图4。
3 讨论
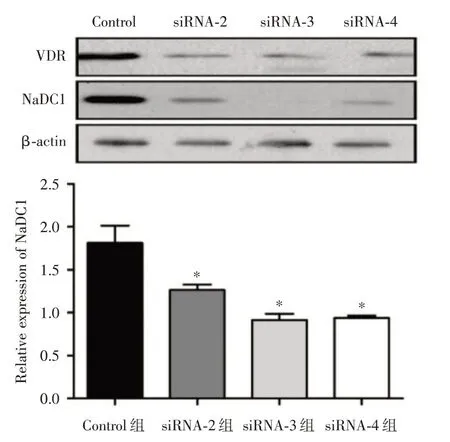
图4 WB检测siRNA转染后NaDC1 蛋白的表达Fig.4 The expression of NaDC1 protein after siRNA transfection by WB
泌尿系结石的发病机制受多种代谢、营养、环境和遗传因素的影响[12]。低枸橼酸尿症是含钙结石常见且公认的代谢风险因素,但枸橼酸在肾脏中的代谢尚未完全阐明,已知枸橼酸排泄是肾脏过滤、重吸收、肾小管细胞合成等作用联合发生的。已有研究发现儿童肾结石也与低枸橼酸尿症有着密不可分的联系,且联系愈加紧密[13]。因此,遗传因素导致的代谢异常继发泌尿系结石症状的疾病更应从病因上考虑疾病的发生。而低枸橼酸尿症作为含钙类结石的重要病因之一,被越来越多证据证实与VDR及NaDC1的表达有关。ARUGA等[14]研究表明,慢性代谢性酸中毒能增加近端肾小管枸橼酸的重吸收,引起低枸橼酸尿症,导致肾结石的形成。有研究发现尿pH 正常的结石患者也有低枸橼酸尿症存在,STROHMAIER等[15]考虑可能是NaDC1 缺陷引起。关于VDR与枸橼酸代谢的关系,已有实验证实VDR的配体1,25(OH)2D3直接影响着参与枸橼酸细胞内代谢和跨膜转运的相关酶类的活性[16-17],另外,VDR 本身可能直接参与到了枸橼酸盐的快速排泄途径[18-19]。此外VDR参与调节编码磷酸烯醇丙酮酸羧激酶基因的转录,而磷酸烯醇丙酮酸羧激酶参与了调节细胞内枸橼酸盐及尿枸橼酸盐水平[20]。关于VDR 与NaDC1 之间的联系,已有实验通过基因型分析证明VDR 基因和NaDC1 编码基因SLC13A2 之间在草酸钙结石患者特发性低枸橼酸尿症的发病机制中存在上位互相作用[21]。通过桑格测序发现特发性低枸橼酸尿症与中国汉族、白族人群中的VDR基因单核苷酸多态性(SNP)相关[22-23]。然而,直接通过分子生物实验来证实VDR 与NaDC1 表达间的联系的研究尚未见报道,以及通过动物目的基因敲除,构建低枸橼酸尿症动物模型,进行针对病因的治疗研究将是本课题组下一步研究的重点。
在本实验中,合成针对VDR的siRNA,对HK-2细胞株进行转染,并通过检验干扰HK-2细胞后VDR的mRNA和蛋白质的表达水平,筛选出有效的3 条siRNA,可为后续实验挑选VDR的siRNA 提供参考。接着应用了这3 条有效的siRNA,通过检验干扰HK-2细胞后NaDC1的mRNA和蛋白质的表达水平,发现NaDC1的表达水平下调,差异具有统计学意义。说明在HK-2细胞中,在一定表达水平范围内,VDR 调控NaDC1的表达,两者表达水平呈正相关。由此也能推断,由于VDR的表达上调引起了NaDC1的表达也相应上调,从而使NaDC1的转运活性增加,尿枸橼酸在肾近曲小管的重吸收也增加,表现为低枸橼酸尿症。
然而本实验所用的肾近曲小管上皮细胞(HK-2细胞)已为理想细胞,但是并不能代表整个肾脏枸橼酸的代谢状况。并且具体调节途径及机制还未清晰,下一步实验尚需在其他肾脏细胞株中进行检测,更进一步动物实验需设计目的基因敲除动物与低枸橼酸尿症动物模型之间NaDC1 表达是否存在差异,证实VDR 基因是否是导致低枸橼酸尿症的上游基因,更加深入探索VDR 基因与NaDC1之间是如何联系。VDR 基因通过何种通路或者方法来影响NaDC1的机制尚未明确。总的来说,本实验通过检测敲低了VDR 基因表达的HK-2细胞中NaDC1的表达,为低枸橼酸尿症病因学及泌尿系结石的病因的探索又迈出一步。
综上所述,本研究发现VDR 基因表达下调后NaDC1 在HK-2细胞中表达也下调。通过分析NaDC1 与低枸橼酸尿症的联系,提示VDR 有通过调节NaDC1 表达,进而影响枸橼酸的代谢,但通过何种通路或者方法实现上述调节的机制尚未明确,动物实验亦为实施,有待后续研究。
