多花黄精种子结构与休眠及萌发的关系研究
2020-04-202史素影葛盼盼邢世海2韩荣春2吴振东周安2
2史素影葛盼盼邢世海2韩荣春2吴振东周 安2
(1.安徽中医药大学药学院,合肥 230012;2.安徽省中医药科学院中药资源保护与开发研究所,合肥 230012;3.安徽省青阳县九华中药材科技有限公司,安徽 青阳 242800)
多花黄精(PolygonatumcyrtonemaHua)为《中国药典》[1]2015年版收录的黄精药材的原植物之一,具补气、养阴、健脾、润肺、益肾等功效,用于脾胃气虚,体倦乏力,精血不足等症,黄精药材具药用价值的同时兼食用价值。目前,多花黄精的无性繁殖主要以根茎繁殖为主,有性繁殖主要以种子繁殖为主。根茎繁殖的产量高,一年即可出苗,但其繁殖系数低,损耗大量根茎,长期使用根茎繁殖方式会造成种质退化,病虫害加剧。种子繁殖可节约根茎资源,其繁殖系数高[2,3],但种子存在休眠现象,导致种子繁殖困难及成本太高等实际问题。加快多花黄精种子繁殖速度,已成为亟需解决的问题。
目前,认为种子休眠主要为外部的种皮及胚乳等的机械阻碍和内部的激素水平调控等[4-6]。多花黄精种子存在休眠现象,种胚存在生理后熟,属于综合休眠[7]即结构性和生理性并存的休眠类型。打破机械休眠、处理种子的方式有机械处理、激素处理、化学试剂处理、层积处理等方法[7]。本实验通过对多花黄精种子解剖学结构的研究,进一步采用机械和化学试剂处理种皮等方法,深入探究多花黄精结构性休眠机理,提高其种子发芽率和出苗率,以期对多花黄精的繁育种植提供一定的理论基础。
1 材料与方法
1.1 材料与设备
试验材料于2017年7月采自安徽省青阳县栽培基地,经安徽中医药大学俞年军教授鉴定为黄精属多花黄精(P.cyrtonemaHua)。
设备与试剂为苏丹黑B(源叶生物);番红、固绿(南京奥多福尼);碘液(海博生物);间苯三酚(阿拉丁);苏丹三(源叶生物);番红固绿制片(洛阳甲子制片);E 5系列生物显微镜(宁波舜宇);SZ 780连续变倍体视显微镜(重庆奥特);AX 324 ZH型电子天平(奥豪斯);高压蒸汽灭菌锅(上海博讯);GHP-300型智能光照培养箱(上海三发)。
1.2 实验方法
1.2.1种子处理
取多花黄精果实,自然发酵成熟后清水漂洗,种子与果肉剥离。种子洗净阴干,于湿砂中4 ℃保存。
1.2.2种子基础特性测定
统计果实含种子数:测定种子大小(0.5 mm刻度直尺,种脐与种阜直线距离为纵径,相垂直距离为横径);采用百粒重法测定种子千粒重;常规红墨水染色法测定种子胚的生活力;直接烘干法测定种子含水量:随机取种子20粒,平行3次,将种子烘干至18 h后测定质量,间隔1 h测定至恒重。
吸水率测定:随机取种子50粒,平行3次,加水吸胀,置于25 ℃恒温箱中,定期取出,滤纸吸干种子表面水分,至恒重,计算吸水率(每8 h和每1 h各1组实验)。
1.2.3种子结构特征的研究
1) 种子微性状。随机取种子若干,体视显微镜下观察种子表面特征、横切面、纵切面,记录并拍照。
2) 种子显微结构特征。随机取种子若干,徒手切片,电子显微镜下观察种子胚、胚乳细胞及种皮结构,组织化学染色法(碘液、苏丹三、苏丹黑、番红固绿、间苯三酚-盐酸)鉴别种子内营养物质[8,9],记录并拍照。
1.2.4种子发芽率实验
1) 机械法去除种皮。将种子处理成全剥皮和去种脐,用5%NaClO消毒20 min。培养皿中放置灭菌滤纸,无菌水稍润湿,每皿放置已消毒的各处理种子30粒,各组3次重复,实验均要求无菌操作定期浇灭菌水,空白组为无处理的完整种子。培养条件为25 ℃遮光处理,1个月后统计发芽率。
2) 化学试剂处理种皮。硫酸处理种皮:将多花黄精种子用10%、45%、60%硫酸分别浸泡1 min,10 min,30 min,60 min,90 min,处理期间不断搅拌,处理后用无菌水冲洗。将滤纸平铺于培养皿中,每皿30粒,每个处理3次重复,无菌水冲洗的未经硫酸处理的种子作为对照。培养条件为25 ℃暗处理,2个月后统计发芽率。
NaOH处理种皮:将多花黄精种子用10%、45%、75%NaOH分别浸泡30 min,60 min,90 min,120 min,150 min,处理期间不断搅拌,种子处理后用无菌水冲洗。将滤纸平铺于培养皿中,每皿30粒,3次重复,无菌水处理的种子作为对照。培养条件同上,2个月后统计发芽率。
1.2.5数据处理
发芽率数据采用Excel 2010软件进行数据处理,SPSS 25软件进行方差分析及显著性分析。
2 结果与分析
2.1 种子的基础特性
多花黄精浆果球形,表面具棱,3条,为腹缝线,沿中轴线径向延伸,表面众多点状斑点。果实所含种子为7~8个,极差为2~14个。据此结果可测算多花黄精株均结实数约为250个。多花黄精种子粒径大小为(3.950±0.422)mm×(3.683±0.404)mm。鲜种子千粒重为(25.036±2.117)g。经常规红墨水染色法测定,多花黄精种子的生活力为(83.33±5.51)%。种子经湿砂贮存,生活力较高,说明该种子质量较好。多花黄精鲜种子含水量为(45.29±2.76)%。
吸水率测定结果见图1。如图1 A,多花黄精种子在1 d中的吸水趋势持续上升,在第1小时内涨幅最大,之后缓慢上升,而达到第12小时后,仍在呈上升趋势,说明种子仍未达到饱和吸胀程度。如图1 B,种子在前16 h内吸水速度迅猛,在8 h内达到最高,16 h内继续吸胀,但在16~24 h有下降趋势,这可能和种子在此时的呼吸作用有关。在56~64 h间出现第2次下降趋势,在80 h后渐趋于平稳。由图1 B可知,多花黄精种子吸水时间大约为4 d,吸胀速度缓慢。

图2 多花黄精不同种皮与干燥种子
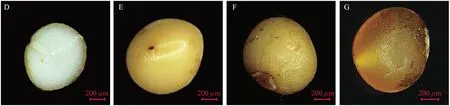
图3 多花黄精种子微性状
2.2 种子结构特征的研究
2.2.1种子微性状
多花黄精种子多为不规则卵球形,似绿豆大小,大多种子表面平整,部分种子表面有棱,呈棱状不规则卵球形。种皮多呈淡黄色,少数浅绿(图2 A,B),干种子种皮皱缩,呈干瘪状,体积较小,颜色较深(图2 C)。
多花黄精种子外部结构主要有种脐、种阜及种皮,种子内部结构为棒状胚结构和胚乳(图3)。大多鲜种子表面平整光滑,种皮淡黄色,种脐呈小黑圆点状,平整,不明显突出(图3 E)。干种子种皮皱缩呈深黄色,种脐突出呈深褐色,部分胚及胚乳清晰可见(图3 G)。种脐与种阜相对,胚位于种脐内侧凹入。多花黄精种的胚均呈棒状结构,新鲜种胚呈微乳白色,干燥种胚呈乳白色,多数皱缩状。胚乳大面积包裹胚,胚与胚乳间存在间隙。从种脐纵切可见,种胚与胚乳呈分离状态。胚所在位置呈凹槽,被胚乳整体包裹,胚占据种子纵径约1/2的位置。
2.2.2种子显微结构特征
多花黄精种子结构完整,经显微观察由外到内结构为:角质层、木质化种皮、栅状细胞、胚乳细胞和种胚,后含物有脂肪油、蛋白质结晶、糊粉粒。种皮是由一层木质化的死细胞组成,最外层为一层薄膜状的角质层构成,连接种皮与胚乳中间一层为栅状细胞依次排列,向内为大面积的胚乳细胞相互连接,胚为单一的胚细胞构成(图4 H~M)。

图1 多花黄精种子日间吸水率(A)、间隔8 h的多花黄精种子吸水率(B)
种皮经染色见由明显的单细胞构成,无核,无细胞壁,内含大量脂肪类物质(图4 L)。胚乳经染色,可见内部分布大量脂肪油(图4 O)。种皮、胚乳、胚内部均含有大量的脂肪油状物质。纵切面中胚乳细胞呈射线延伸至种胚,种胚位列中轴线上偏向一侧。横切面中,胚乳细胞放射状延伸至中心,胚位列中心(图4 N,O)。
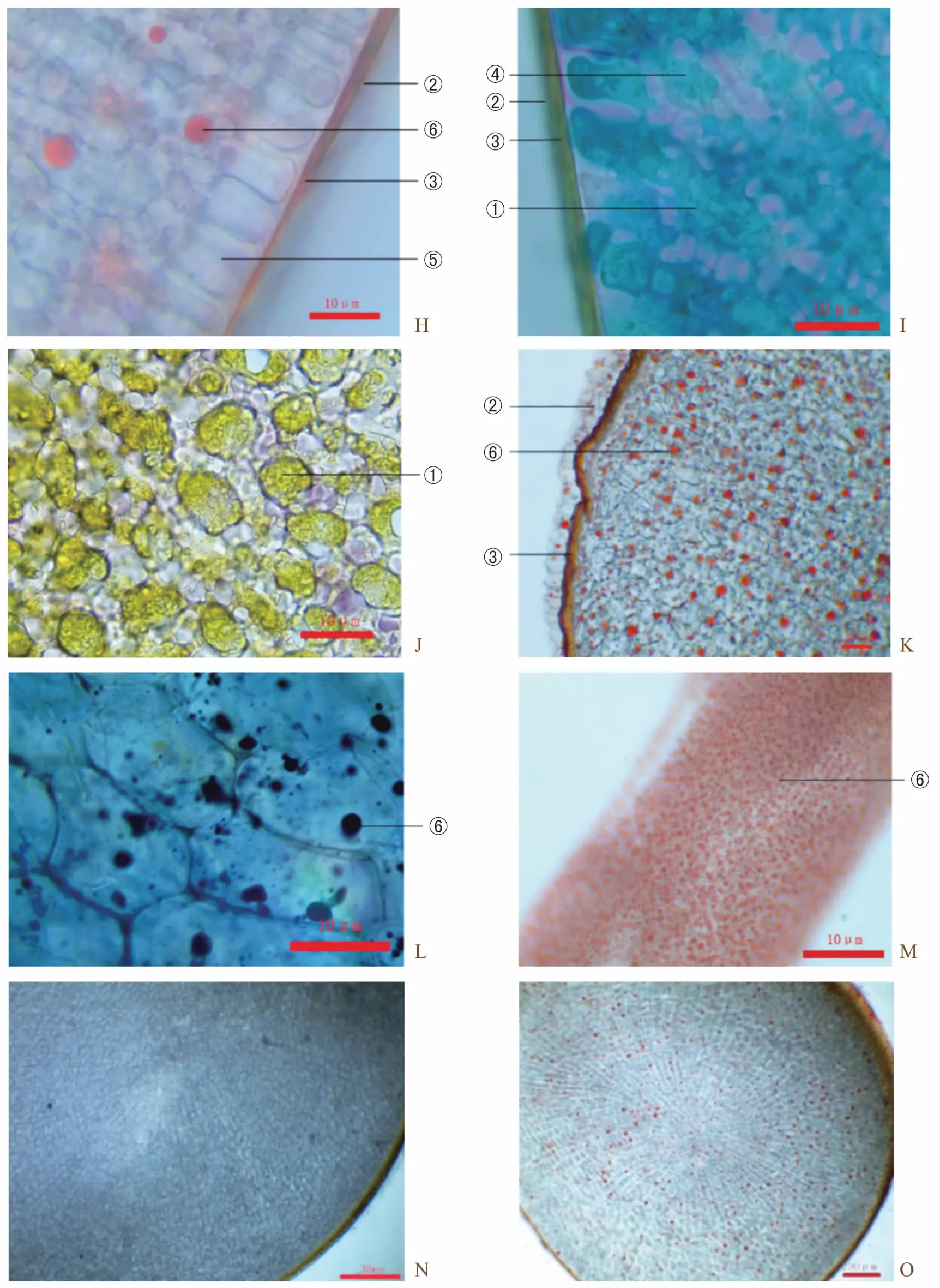
注:H为苏丹三染纵切面;I:番红固绿染纵切面;J为稀碘液染纵切面;K为苏丹三染种胚纵切面;L为苏丹黑染种皮;M为苏丹三染纵切面;N为间苯三酚盐酸染纵切面;O为苏丹三染横切面:①胚乳细胞;②角质层;③木质化种皮;④蛋白质结晶与糊粉粒;⑤栅状细胞;⑥脂肪油。
2.2.3发芽率实验
1) 机械法处理种皮。如图5所示,除种皮的种子发芽率较高,除种脐的发芽率与空白组相差不大。由t检验可得,p<0.05,说明处理方式对发芽率的影响存在显著差异。因此,解除种皮束缚是提高种子萌发率的关键。
2) 化学试剂处理种皮。由图6可得,10%硫酸处理1 min平均发芽率最高,且10%处理组的发芽率均较空白组明显提升。45%硫酸处理1 min时的发芽率也有明显提升。60%硫酸处理总体发芽率较低。45%和60%处理90 min均出现萌发极度抑制现象,发芽率为0。
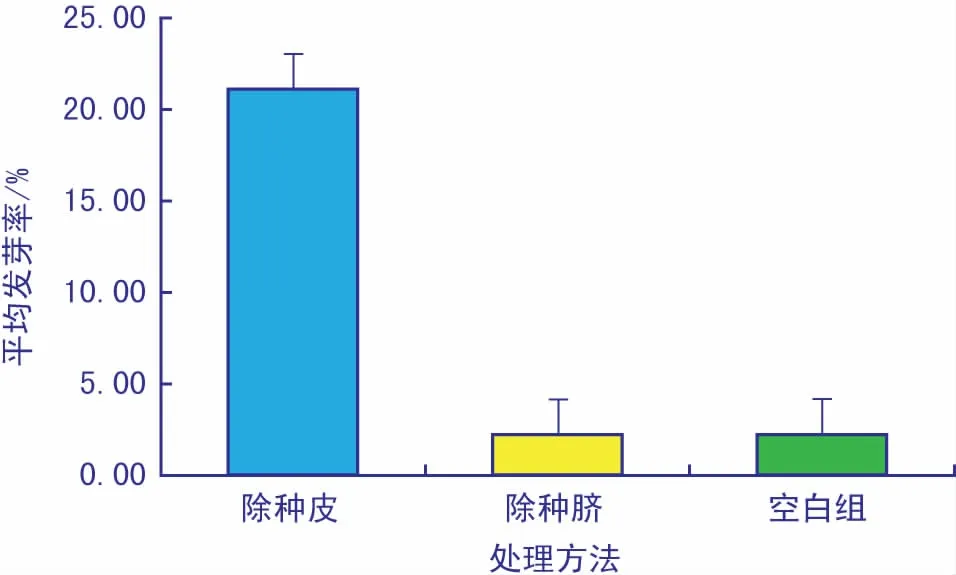
图5 机械法除种皮的发芽率
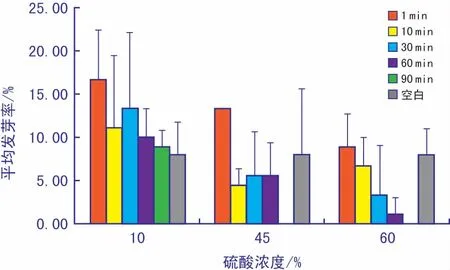
图6 不同浓度硫酸处理的发芽率
据方差结果(表1)显示,硫酸的浓度和时间均对发芽率有极显著差异,p<0.01,分析结果具有统计学意义。因此,硫酸的浓度和时间对种子萌发均具有显著影响,且使用10%硫酸处理1 min时可有效提高多花黄精种子的发芽率。

表1 不同浓度硫酸处理方差分析
NaOH处理种皮:由图7可知,使用不同浓度NaOH处理种子对其发芽能力具抑制现象。使用10%的NaOH处理种子时发芽抑制现象相较其他处理组不太明显,最高发芽率未达10%。而越高浓度的处理越长时间时,种子萌发抑制越明显。由方差分析(表2)结果得:浓度因素中,F=3.659,p<0.05;时间因素中,p<0.01,因此,说明浓度对发芽率的影响存在显著性差异,时间对发芽率的影响存在极显著差异性。NaOH的浓度与时间对多花黄精种子发芽率均具有显著性影响,结果证明NaOH不能提高多花黄精种子发芽率。

图7 不同浓度NaOH处理的发芽率
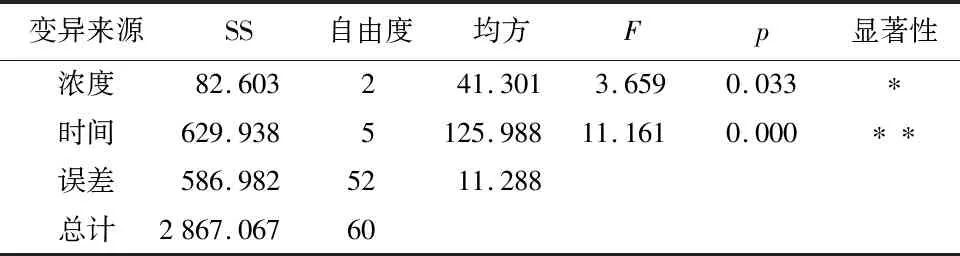
表2 不同浓度NaOH处理方差分析
3 讨 论
3.1 多花黄精形态特征与萌发的关系
研究表明,种子的萌发与其外部形态及生长的环境有直接的联系[10]。种子成熟后因其不易受到风力及外力影响自行脱落至土壤,其表面积较大以增大土壤接触可充分吸收水分和其他所需养分,并潜伏于土壤中吸取养分维持种子活力,等到环境条件适宜再启动萌发[10]。多花黄精种子为近球形,千粒重可达25 g以上,体积较大,存在休眠且萌发率低;野外调查发现,多花黄精多生长在腐殖质土壤中,喜阴湿,种群多群聚生长,这可能和多花黄精种子体积较大,难以随风力自由散开繁殖有关;同时,多花黄精与土壤接触面大等到营养水分充足且环境适宜时容易萌发。因此,多花黄精种子的形态特征与环境因素均有可能影响其种子的萌发。
研究表明,种皮的透水性影响种子的萌发[11-13]。张玉翠等[11]研究认为,黄精种子存在吸水缓慢的特性,从而影响其呼吸及代谢酶的启动。多花黄精种子吸胀时间较长,种皮结构同样存在吸水障碍,这与该研究中使用硫酸可以有效提高种子萌发的结论吻合,可以证明其种皮机械障碍较大,很大程度上阻碍种子萌发。
3.2 多花黄精种子结构与萌发的关系
种皮结构将是影响发芽率的关键。种皮由一层角质层、木质化种皮细胞构成,其中,种皮上附有大量的脂肪油类物质。周健研究表明,种皮中的角质层、栅栏细胞、种脐等特殊结构对种子吸胀过程有影响[14]。黄精种子与多花黄精种子结构相似,研究表明,黄精种子的种皮具有木质化的细胞层,是阻碍种子吸胀的主要原因。种子的吸水能力与萌发紧密相关,吸水是种子萌发的起始阶段[11]。研究表明,种子内的胚乳细胞结构[11]、脂类物质[14]对种子萌发均有影响。多花黄精种子内胚乳细胞紧密连接,脂类物质大量分布,与其难以萌发紧密相关,其在种胚和种皮上也有分布,且胚内部的脂类物质排列致密,这与阻断种胚吸收营养物质及吸水并启动相关呼吸酶的表达也有关联。多花黄精种子胚乳最外层栅栏状的栅状细胞,依次排列致密,内含多数拟晶体,其特殊的结构与栅栏细胞相似,故认为栅状细胞可能与阻碍其吸水及启动萌发等机制有关。
3.3 种皮处理对多花黄精种子休眠与萌发的关系
种子休眠有2种因素:机械(即种皮及胚乳)障碍和内部激素调控[4-6]。从多花黄精的种子结构可以发现,种脐内侧即为种胚所在的位置。但在研究中发现,全部去除种皮的种子发芽率要显著高于只去除种脐处种皮的发芽率,故种胚吸水并不能启动萌发的机制,因此,多花黄精种子在解除休眠过程中,需要胚乳细胞吸收营养供给胚的发育成熟,其种胚不存在休眠,休眠主要是胚之外的因素引起,张玉翠等也有一致的观点[11]。胚乳在种子中起着支撑的作用,并提供胚维持生命力所需的营养物质,同时对胚的生长有一定的控制作用。程秋香认为,胚在打破自身休眠状态过程中不断发育成熟,会释放信号到胚乳细胞并对胚乳自身贮藏的物质产生降解,并认为胚完成自身发育的过程同时会弱化胚乳自身的效应,是个双向启动的机制[15]。
大多硬实种子均用酸蚀或机械处理[16-18],均能有效提高种皮的机械障碍,从而解决其存在的结构性休眠问题从而提高萌发率。研究者发现种子经酸蚀后,种皮结构逐渐疏松,角质层变薄,木质化结构变得疏松[17],出现种皮炭化变黑现象,从而种子可以解除种皮障碍而较快吸水。在多花黄精种子酸蚀过程中发现,高浓度酸处理越长时间种皮上出现炭化变黑的现象,与上述作者研究的结果一致[17]。在本实验中,使用酸处理多花黄精种子种皮时,其种皮结构和内部的胚乳细胞和脂肪油可能都会发生这一系列的裂解变化,从而可以有效提高其种子的发芽率,打破种皮障碍导致的结构性休眠。直接机械处理种皮后,可以直接解除种皮带来的阻碍。
本实验中,使用NaOH处理多花黄精种子后,均表现出抑制萌发效应。研究表明,植物过度摄取Na+、K+等盐离子,会使植物细胞内的酶丧失活性,同时会影响质膜的选择透过性,损害细胞膜的运作,对植物机体产生不利影响,同时,植物细胞在高盐高pH值条件下也不宜生存[19,20]。李欣瑞等研究发现,对武陵假俭草种子以50 g·L-1NaOH溶液处理5 min发芽率最高,低浓度的NaOH溶液可以增加种皮纤维素的溶胀,增加种皮的吸水性并有利于内部抑制物质外排[21]。本研究中多花黄精种子种皮的结构由木质化和角质等组成,其成分主要为木质素和纤维素[22],与上述种皮结构不太一致,但成分相似;可认为多花黄精种子使用强碱处理后可能增加了种皮的溶胀,碱液极易进入胚乳及胚内,细胞内产生不适胚生长发育的pH条件,从而种子出现抑制萌发现象。
4 结 论
由微性状观察,多花黄精种子结构完整,包括种子外部结构为种皮、种脐、种阜,内部结构为胚乳和胚;显微结构由外到内依次为角质层、木质化种皮、栅状细胞、胚乳细胞、蛋白质拟晶体和糊粉粒、脂肪油、胚细胞及胚内部的脂类物质。由种子吸水规律可得种子具有吸水障碍,将种皮破除进行验证,全部去除种皮的种子发芽率较高,去除种脐种子及无处理种子的发芽率几乎为0。此结果表明,种皮是影响种子萌发的关键因素。使用硫酸和NaOH处理种子,10%硫酸处理1 min为最佳处理方式,可有效打破休眠状态,并提高萌发率,NaOH处理后抑制种子萌发;因此,本实验证明多花黄精种子属于结构性休眠类型,短时间内使用酸可有效打破其种皮的机械障碍,而使用碱液不利于多花黄精种子的萌发。
