促结缔组织增生性小圆细胞肿瘤的临床病理特征分析*
2020-04-18王玲玲姬忠贺高颖昌红周全孙萍萍张颖李雁
王玲玲 姬忠贺 高颖 昌红 周全 孙萍萍 张颖 李雁
促结缔组织增生性小圆细胞肿瘤(desmoplastic small round cell tumor,DSRCT)是一种高度恶性的肿瘤,1991年被正式命名[1-2]。该肿瘤缺乏特异性临床表现,确诊困难,大多数患者确诊时已发生转移。本文旨在总结7 例DSRCT 的临床病理特征,为病理诊断及临床治疗提供参考。
1 材料与方法
1.1 研究对象
收集2012年1月至2019年11月7例于首都医科大学附属北京世纪坛医院诊断的腹腔DSRCT患者的临床病理资料,全部为男性,其中6 例为住院、1 例为会诊。所有住院患者均经两位病理主任医师确诊。
1.2 方法
1.2.1 治疗方案 患者均行肿瘤细胞减灭术(cytoreductive surgery,CRS)加腹腔热灌注化疗(hyperthermic intraperitoneal chemotherapy,HIPEC)。术后根据Sugarbaker 标准行腹膜癌指数(peritoneal cancer index,PCI)及肿瘤减灭完整性(completeness of cytoreduction,CC)评分[3]。
1.2.2 相关定义 PCI评分:将腹腔分成13个区域并对每个区域的肿瘤负荷进行评分,无癌结节为0 分,癌结节直径≤0.5 cm 为1 分、直径0.6~5.0 cm 为2 分、直径>5.0 cm或癌结节融合为3分,最高分为39分(13区×3 分)。CC 评分:CRS 后未见肿瘤为0 分,残余肿瘤直径≤0.25 cm 为1 分、直径0.25~2.5 cm 为2 分,直径>2.5 cm 或残留无法切除或姑息切除病灶均为3分。CC评分0~1分为肿瘤细胞减灭满意,2~3分为肿瘤细胞减灭不满意。
1.2.3 组织病理学标本 经中性甲醛固定,常规病理切片,H&E染色,显微镜观察。免疫组织化学法采用Envision二步法,检测指标包括CK、EMA、Vimentin、Syn、CgA、CD56、S-100、CD99、CD117、CD34、Dog-1、Desmin、WT1、Ki-67、P53。
1.2.4 分子病理学 荧光原位杂交(fluorescence in situ hybridization,FISH):检测石蜡包埋组织中的EWSR1-WT1融合基因,探针购自广州安必平生物技术有限公司,按产品说明书操作。红色信号(R)代表WT1基因、绿色信号(G)代表EWSR1基因,FISH阳性细胞为一红一绿两融合(1R1G2F)、阴性细胞为两红两绿(2R2G)。诊断标准:计数200个细胞,出现1R1G2F为典型信号类型,比例达到10%以上为阳性。
1.2.5 随访 随访记录主要为患者的生存情况,末次统一电话随访日期为2019年10月,无失访病例。
2 结果
2.1 DSRCT的临床特征
7 例患者均为男性,中位年龄为29 岁,就诊时有腹水者5 例(71.4%)。术中PCI 评分的中位值为27分。7例患者CC评分0~1分者3例(42.9%),2~3分者3例(42.9%)。患者临床资料见表1。
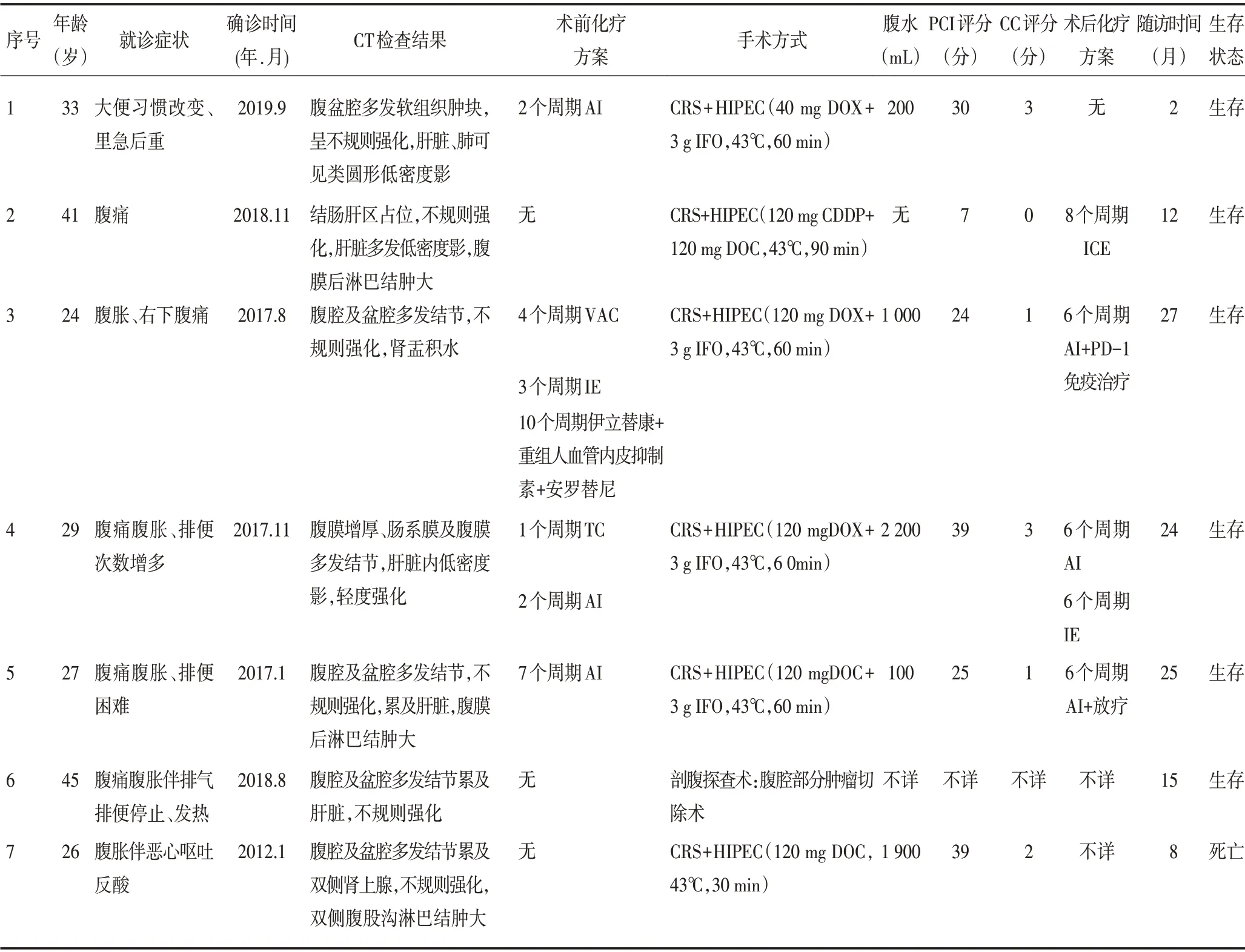
表1 7例DSRCT患者的临床资料
2.2 DSRCT的病理学特征
2.2.1 大体特征 肿瘤表面光滑,切面灰白、实性、质中,局灶可见出血、坏死及囊腔。7例患者中6例均表现为大网膜或肠系膜上多发、播散性灰白结节(图1A~B),最大径1~10 cm(图1C);1例表现为结肠浆膜单个肿瘤伴大网膜结节。
2.2.2 镜下及免疫组织化学特征 镜下显示肿瘤由大小不一、形态不规则的细胞巢组成(图2A),部分大细胞巢中央可见灶状坏死或伴有囊性变(图2B),也可见假腺样、单排状、条索状、梁状或滤泡状结构,或假菊形团样排列(图2C),间质多为玻璃样变性的致密纤维结缔组织(图2D),部分区域纤维性间质不明显,较疏松。肿瘤细胞多边界不清,胞浆稀少,核圆形或卵圆形、深染,核仁不明显(图2E),部分区域瘤细胞胞浆透亮或呈印戒样;大部分病例可见脉管(包括血管或淋巴管)瘤栓,6 例可见血管瘤栓,4 例可见淋巴管瘤栓(图2F)。
采用免疫组织化学法检测显示,5例患者的肿瘤细胞CK阳性(图3A),6例EMA、Desmin(图3B)和Vimentin(图3C)阳性,2例Syn和CD56阳性,1例CgA阳性,1 例细胞浆中WT1 阳性,Ki-67 指数为20%~80%不等,S100、CD117、CD34、Dog-1均阴性。
2.2.3 分子病理特征 采用FISH 检测EWSR1-WT1融合基因阳性(图4)。
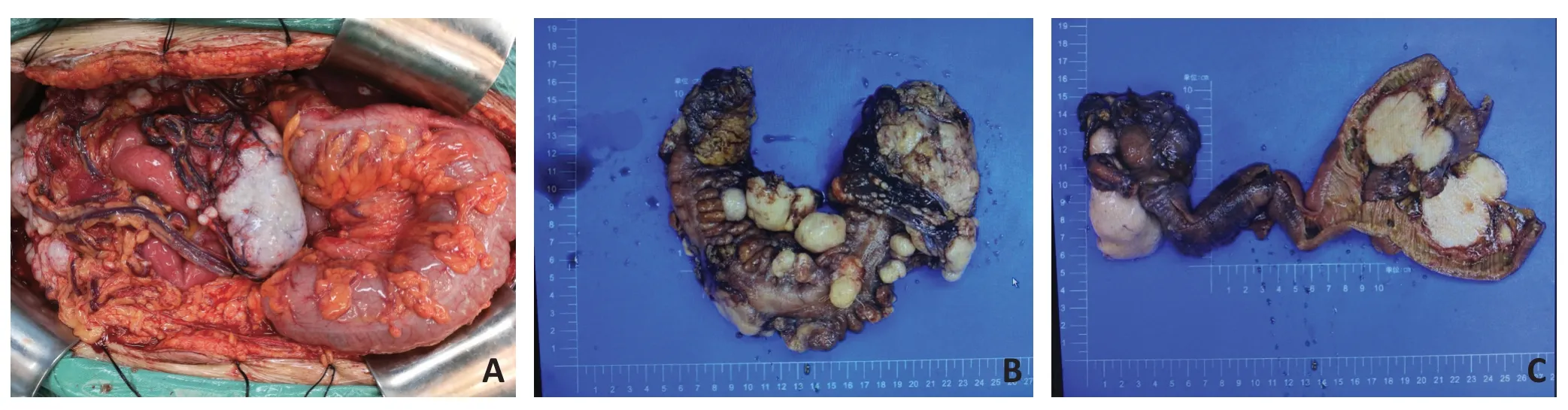
图1 DSRCT术中及术后的大体特征

图2 DSRCT的镜下病理特征

图3 DSRCT的免疫组织化学法标记特征
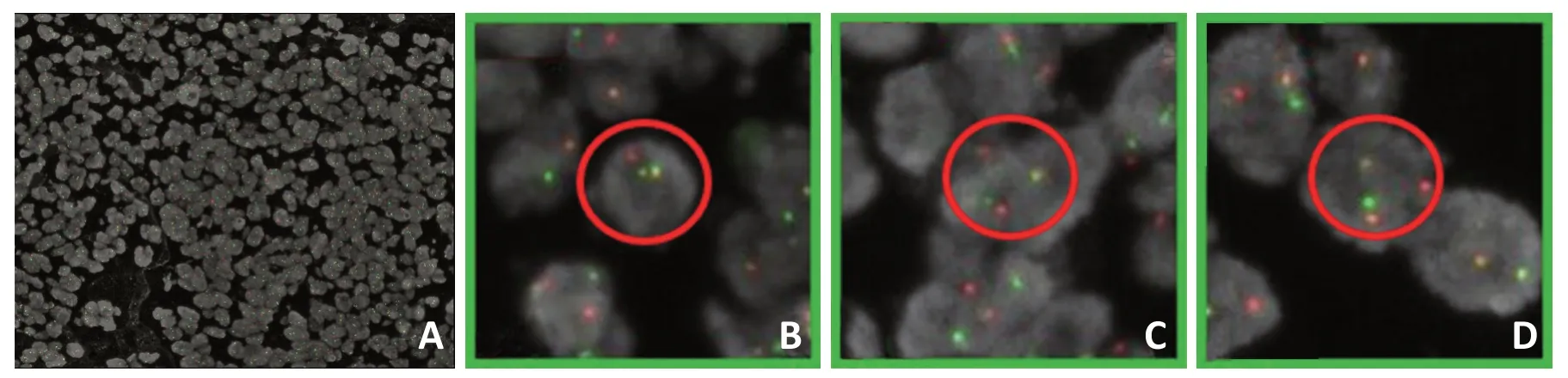
图4 DSRCT的FISH检测结果
3 讨论
DSRCT 罕见,起源不明、临床症状无特异性,但病理形态、免疫表型及分子生物学改变相对特异。国内多为个案报道[4-6],相关报道例数约500 例[7]。DSRCT 好发于腹腔及盆腔,其他罕见部位包括睾丸旁、胸膜、后颅窝、骨和软组织、卵巢、腮腺、肺、鼻腔等[7-8]。常见症状包括腹痛、腹胀及腹部包块,伴随症状包括顽固性腹水、肝肿大等[9-11]。本研究患者均为男性,部位、症状典型,中位年龄29 岁,6 例表现为腹胀、腹痛,1 例表现为肠梗阻,1 例因肾盂积水而表现为排尿困难,与报道相一致[10]。
DSRCT 病理学表现特异,小圆形肿瘤细胞被纤维组织分隔成大小不一的巢状结构,不同区域肿瘤和间质的比例不同。免疫组织化学法检测结果中CK阳性,Vimentin 及Desmin 核旁点灶阳性。研究发现,90%以上患者有特异性的染色体异位t(11;22)(p13;q12),使位于22q12上的EWSR1基因与位于11p13上的WT1基因融合[12],本研究经FISH检测发现EWSR1-WT1融合基因阳性。
DSRCT 尚无标准治疗方案,CRS、化疗、腹部放疗、HIPEC 及靶向治疗等总体疗效不满意。Hayes-Jordan等[13]认为肿瘤减灭的程度直接决定生存时间;Honoré 等[14]分析了100 例DSRCT,随访23~311 个月,中位生存期为25个月,其中CC评分为0~1分、中位PCI 评分<12 分提示预后良好。另一项研究[15]显示,术后全腹放疗为独立预后因素。Gani 等[7]对491例DSRCT 行多因素分析显示,临床分期、手术治疗(无论手术方式如何)、辅助放疗或化疗为独立预后因素,但并未提及CRS及HIPEC重要性;朱容萱等[16]研究结果显示,CRS 和化疗是预后良好的独立因素。上述研究结果显示,术前化疗、CRS、术后放化疗,可改善患者生存,而HIPEC 重要性则有待明确。本研究6 例患者均行术后化疗,3 例行术前化疗,6 例行CRS+HIPEC,3 例CC 评分为0~1 分,提示肿瘤细胞减灭满意,而5例PCI评分均>12分则提示预后不良;1例死亡患者的生存期较短,原因可能为入院时腹水严重,术前未行化疗,术后CC评分为3分并提示肿瘤减灭不满意。
综上所述,本研究总结DSRCT的临床病理特征、诊断及治疗,推荐行术前化疗、CRS(可同时行HIPEC)、术后放化疗的综合治疗,同时提出需探讨新的治疗方法以延长患者的生存期。
