靶向NSCLC EGFR exon20插入突变的新抗原疫苗筛选和功能研究
2020-04-18刘丹丹韩雷于津浦
刘丹丹 韩雷 于津浦
表皮生长因子受体(epidermal growth factor receptor,EGFR)是非小细胞肺癌(non-small cell lung cancer,NSCLC)中常见的驱动基因[1],其突变发生率约占东南亚NSCLC患者的40%~60%[2-3]。研究表明EGFR 突变与NSCLC 患者接受EGFR 酪氨酸激酶抑制剂(EGFR-tyrosine kinase inhibitor,EGFR-TKI)治疗后临床疗效之间存在显著相关性[4]。但是,在众多EGFR 突变中,10%~12%为EGFR exon20 非移码性框内插入突变(exon20 insertions,20ins)[5-7],其中90%的EGFR 20ins 位于C-螺旋终止点之后,表现为对EGFR-TKI 的原发耐药[8-10]。近年来,虽然免疫检查点抑制剂在NSCLC 治疗中发挥了越来越重要的作用,但其对携带EGFR 20ins 的NSCLC 患者治疗效果并不理想[11-12],需要寻求新的免疫治疗手段。
肿瘤新生抗原(tumor neoantigens,TNAs)疫苗的研究[13]可能为EGFR 20ins阳性NSCLC患者提供免疫治疗的机会。TNAs免疫治疗是通过生物信息学筛选出具有抗原性的肿瘤内源性基因突变,鉴定出此基因突变对应的TNAs,然后用此抗原刺激抗原特异性T 淋巴细胞大量增殖活化,以达到杀灭肿瘤细胞、令肿瘤消退的目的。目前,大多数TNAs 来源于罕见的非同义单核苷酸突变、框移突变、剪接变异和基因融合,缺乏针对框内移码突变的TNAs 疫苗研究[14]。本研究首次针对NSCLC中常见的EGFR 20ins设计靶向NSCLC 的TNAs,并通过细胞实验和动物模型证实其能够诱导特异性T淋巴细胞扩增和活化,识别并杀伤NSCLC 细胞,旨在为携带EGFR 20ins 的难治性NSCLC患者提供新的免疫治疗手段。
1 材料与方法
1.1 细胞和材料
1.1.1 主要试剂 RPMI 1640培养液(购自美国Corning公司);胎牛血清(购自以色列Biological Industries公司);细胞因子rhGM-CSF、rhIL-4、rhTNF-α、rhIL-2、rmGMCSF、rmIL-4、rmTNF-α、rmIL-2(购自美国PeproTech公司);鼠抗人单克隆抗体4-1BB、CD25、CD3/4/8、IFN-γ(购自美国Biolegend公司);Cytofix/CytopermTMPlus试剂盒(购自美国BD公司);CellTraceTMCFSE试剂盒(购自美国invitrogen公司);Zombie NIR染料(购自美国BioLegend公司);人和小鼠淋巴细胞分离液(购自北京索莱宝科技有限公司);Elispot试剂盒(购自北京达科为生物技术有限公司)。
1.1.2 细胞 人外周血单核细胞由HLA-A*02 健康供者捐赠;小鼠肺腺癌(lewis lung cancer,LLC)细胞株(购自广州赛库生物技术有限公司)培养于10%胎牛血清的RPMI 1640 培养基中,于37℃5%CO2恒温培养箱培养。
1.1.3 实验动物 4~6周龄雌性C57BL/6小鼠(购于北京维通利华实验动物技术有限公司),体质量16~22 g,在SPF级条件下饲养。
1.2 方法
1.2.1 HLA-A*02限制性EGFR 20ins表位肽的预测与设计合成 搜集NSCLC 相关文献及COSMIC 数据库(https://cancer.sanger.ac.uk/cosmic)中EGFR 20ins的突变类型。从NCBI数据库获取EGFR蛋白质序列(NP_005219.2),根据插入位置形成exon20突变序列,使用IEDB(http://tools.iedb.org/mhci/)[15]、NetMHC4.0(http://www.cbs.dtu.dk/services/NetMHC/)[16]和SYFPEITHI(htt p://www.syfpeithi.de/bin/MHCServer.dll/EpitopePrediction.htm)[17]软件对突变序列进行预测评分。参数设定:细胞毒性T淋巴细胞(cytotoxic T-lymphocyte,CTL)表位限制性MHC类型为HLA-A*02:01,预测表位肽长度为9~10氨基酸。根据预测评分筛选最具优势的抗原表位,设计一条短肽E-ASV-10和一条长肽E-ASV-19。多肽由上海生工生物工程有限公司合成,合成后进行脱盐处理,纯度≥95%,高效液相色谱及质谱证实其相对分子质量符合理论值。将合成多肽干粉溶解后,用无菌水配制成1 mg/mL的无菌溶液备用。
1.2.2 负载表位肽的树突状细胞(dendritic cells,DCs)诱导CTL 采集健康人外周血50 mL,加入淋巴细胞分离液Ficoll 离心分离外周血单个核细胞(peripheral blood mononuclear cell,PBMC),贴壁2 h 后,添加1 000 U/mL rhGM-CSF 和1 000 U/mL rhIL-4 培养6天。第3天半量换液并补充全量细胞因子。第6天加入1 000 U/mL rhTNF-α,继续培养24 h。观察形态,收集DCs,台盼蓝染色,计数。收集自体淋巴细胞,与DCs以5:1比例混合,并加入1 000 U/mL rhIL-2和20 μg/mL 的多肽共培养48 h,收集细胞,台盼蓝染色,计数。
1.2.3 流式细胞术法检测T 细胞表型 取部分抗原肽刺激后的淋巴细胞加入鼠抗人4-1BB-PE 和CD25-APC单抗染色,室温避光孵育30 min后PBS洗涤重悬细胞,流式检测4-1BB+CD25+T 细胞比例。取部分抗原肽刺激后的淋巴细胞,加入高尔基体蛋白转运体阻断剂,于37℃5%CO2恒温培养箱中培养。4~6 h 后,加入CD3-PerCP-CyTM5.5/CD4-FITC/CD8-PE单克隆抗体,室温避光孵育20 min。通透洗涤缓冲液洗涤,加入Cytofix/Cytoperm室温避光孵育20 min。通体缓冲液洗涤细胞后加入IFN-γ-APC 单抗染色,室温避光孵育20 min,PBS 洗涤重悬细胞,流式检测IFN-γ分泌细胞比例。
1.2.4 酶联免疫斑点法检测T 细胞中IFN-γ 的分泌 在酶联免疫斑点法(enzyme linked immunospot assay,ELISPOT)实验孔板中加入200 μL 无血清培养基进行封闭,静置5~10 min后弃去孔内液体。将刺激后淋巴细胞浓度调整至2.5×106/mL,每孔加入0.1 mL,37℃5%CO2孵育24 h。倾倒孔内培养基,加入预冷4℃的去离子水,200 μL/孔,4℃冰箱放置10 min,裂解细胞。弃去孔内液体,加入Washing Buffer(1×),200 μL/孔,放置1 min后洗涤6次。加入生物素标记的抗体工作液(100 μL/孔),37℃5%CO2孵育1 h 后洗涤,方法同上。加入酶标亲和素工作液(100 μL/孔),37℃5%CO2孵育1 h 后洗涤,方法同上。加入现配AEC 显色液(100 μL/孔),室温避光静置10~20 min,用水洗涤3~5 次,终止显色,放置阴凉处自然晾干后,应用ELISPOT图像分析仪进行斑点计数。
1.2.5 多肽诱导C57BL/6 小鼠抗原特异性 CTL C57BL/6 小鼠脱颈处死后,无菌取股骨骨髓,计数后培养于无血清RPMI 1640培养基中,37℃5%CO2恒温培养箱中孵育2 h。在贴壁细胞中添加rmGM-CSF和rmIL-4后培养DCs。同时,取小鼠脾T细胞与DCs以5:1 比例混合,并加入20 μg/mL 的多肽进行抗原负载,共孵育后收集计数CTL细胞,检测IFN-γ的分泌。
1.2.6 构建携带V769_D770insASV的小鼠NSCLC细胞LLCasv通过基因重组构建含有V769_D770insASV的小鼠EGFR全长序列的重组GV492质粒,测序正确克隆包装慢病毒。将LLC 细胞加入96 孔板中,37℃5%CO2培养24 h,至细胞融合率为20%~30%,加入病毒感染增强液97 μL,慢病毒(1×108/mL)0.003 mL,轻摇混匀,37℃5%CO2培养12 h后换液,转染72 h检测转染效率。抗性筛选V769_D770insASV 突变阳性细胞,有限稀释法建立稳定转染细胞系LLCasv。
1.2.7 小鼠淋巴细胞杀伤实验 收集多肽诱导后C57BL/6小鼠的CTL作为效应细胞。将靶细胞LLCasv计数后接种于6 孔板中,加入CSFE,室温避光孵育20 min。洗涤细胞后将效应细胞和靶细胞以10:1、2 0:1比例进行共培养,每组设置3个复孔。共孵育4 h后收集细胞于流式管中。每管加入100 μL NIRZombie 染液,室温闭光孵育20 min,离心洗涤后用200 μL 1%多聚甲醛重悬,BD FACSCanto Ⅱ分析型流式细胞仪检测。
1.3 统计学分析
采用SPSS 23.0软件进行统计分析。应用Graph-Pad Prism软件进行绘图。数据以表示,组间比较采用t检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 表位预测结果筛选及设计
根据文献和公共数据库信息,V769_D770insASV(19.35%)为高频率EGFR 20ins 突变类型[5,18-19]。通过IEDB、NetMHC 4.0 和SYFPEITHI 软件预测EGFR 20ins中V769_D770insASV的潜在HLA-A*02限制性CTL 表位,筛选出各软件中评分较高的表位肽(表1)。其中YV-9 与HLA-A*02:01 具有较好的结合力,因此基于此核心序列设计E-ASV-10 和E-ASV-19多肽疫苗,同时选取相应EGFR野生型肽段E-WT进行合成。
2.2 流式细胞术检测多肽刺激后T细胞的表型变化
分别设立实验组1(E-ASV-10 肽致敏T 细胞,TE-ASV-10)和实验组2(E-ASV-19肽致敏T细胞,TE-ASV-19),空白对照组(含1 000 U/mL rhIL-2的完全培养基RPMI 1640),无肽对照组(空白T细胞,T)、阴性肽对照组(野生型EGFR 20 外显子肽致敏T 细胞,TE-WT),和阳性对照组(PHA刺激的人T细胞或PMA刺激的小鼠T细胞,Tpositive),下同。采用流式细胞术,以单克隆抗体CD25 和4-1BB 标记T 细胞,检测EASV-10和E-ASV-19多肽与人DC细胞共孵育后,人T 淋巴细胞活化的情况。经E-ASV-10 刺激后的TE-ASV-10细胞和E-ASV-19 刺激后的TE-ASV-19细胞比未接触抗原肽刺激的T 细胞和负载野生型肽刺激的TE-WT 细胞活化水平均增高,即4-1BB+CD25+细胞数量增加(P<0.05,图1A)。同时以CD3、CD4、CD8抗体标记不同T 细胞亚群,检测E-ASV-10 和E-ASV-19 多肽诱导的T 细胞特异性IFN-γ 分泌情况。流式细胞术分析结果显示CD4+和CD8+T细胞活化比例亦增多,IFN-γ的分泌增加(P<0.05)(图1B,C),表明EASV-10和E-ASV-19均可在体外刺激T淋巴细胞的扩增和活化。
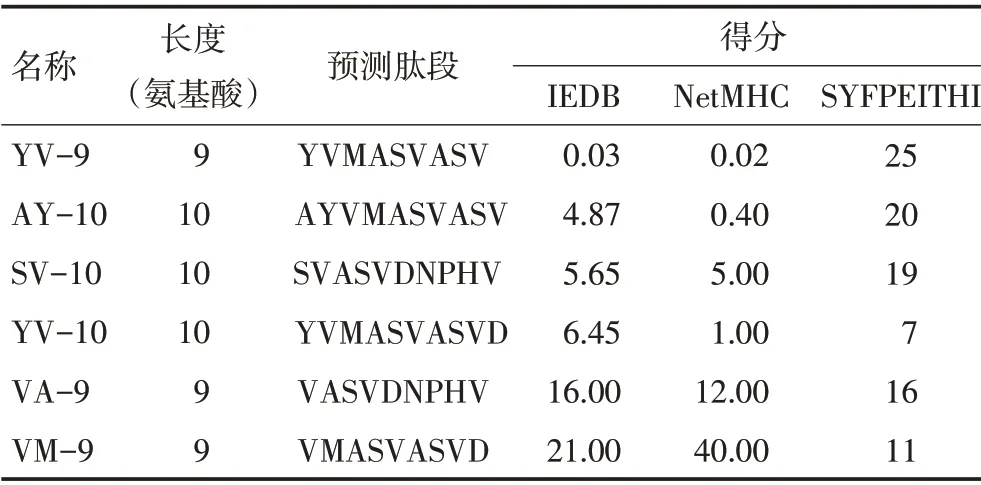
表1 EGFR V769_D770insASV HLA-A*02:01 限制性CTL 表位预测结果
2.3 酶联免疫斑点法检测T细胞中IFN-γ分泌
利 用ELISPOT 检 测E-WT、E-ASV-10 和EASV-19 多肽与人DC 细胞共孵育后人T 淋巴细胞分泌IFN-γ 的情况。结果显示,ELISPOT 实验中PHA刺激的阳性对照组Tpositive 细胞分泌IFN-γ 形成的点数过多。其中E-ASV-10 刺激后的TE-ASV-10细胞和E-ASV-19 刺激后的TE-ASV-19细胞均可特异性分泌IFN-γ(图2,表2)。并且随着T细胞抗原负载次数的增加,T淋巴细胞分泌IFN-γ量也随之增加,E-ASV-10 抗原负载3 次的TE-ASV-10-3细胞较负载2 次的TE-ASV-10-2细胞分泌IFN-γ增多(P<0.05),同样E-ASV-19 刺激的TE-ASV-19-3较TE-ASV-19-2细胞分泌IFN-γ 增多(P<0.05)。结果显示E-ASV-10 和E-ASV-19 均可在体外诱导出识别相应EGFR exon20 插入突变的TNA抗原的特异性T淋巴细胞。
2.4 动物实验
将小鼠骨髓来源DC 细胞与E-ASV-10 共孵育,在体外诱导小鼠CTL 细胞,并通过ELISPOT 法检测E-ASV-10诱导小鼠CTL活性。结果显示E-ASV-10均可以刺激C57BL/6 小鼠CTL 细胞活性(图3A),并特异性分泌IFN-γ(P<0.05)。同时,体外诱导CTL细胞与携带EGFR V769_D770insASV的LLC细胞系LLCasv 共培养时,在效靶比为20:1 时可显著杀伤靶细胞(P<0.05,图3B),表明E-ASV-10 可诱导特异性靶向携带相应EGFR 20ins细胞的杀伤性T细胞。

图1 流式细胞术检测E-ASV-10和E-ASV-19多肽体外诱导人T淋巴细胞的增殖和活化

图2 E-ASV-10和E-ASV-19体外诱导人T淋巴细胞分泌IFN-γ

表2 候选表位肽体外诱导人T淋巴细胞分泌IFN-γ的ELISPOT实验结果

图3 E-ASV-10体外诱导小鼠特异性杀伤T细胞的活性检测
3 讨论
TNAs疫苗作为一种主动免疫疗法,通过激活机体免疫系统产生抗肿瘤免疫应答[20]。相关TNAs疫苗治疗的研究成果[21-22]证明其能够引发免疫应答反应。但大多数TNAs来源于罕见的基因结构变异,发生频率较低,不利于通用型TNAs疫苗的研发[14,20,23]。目前,尚未有报道靶向发生频率较高的热点基因突变的TNAs疫苗制备,如EGFR 20ins。因此本研究设计靶向EGFR 20ins 的TNAs多肽E-ASV-10和E-ASV-19,通过细胞实验首次证实E-ASV-10和E-ASV-19具备诱导特异性T淋巴细胞扩增和活化、识别并杀伤携带相应EGFR exon20插入突变NSCLC细胞的活性,并提出TNAs多肽E-ASV-10和E-ASV-19可作为一种新的肿瘤疫苗用于治疗携带相应基因变异的NSCLC的潜在临床应用前景。
4-1BB是T细胞协同刺激分子,主要表达于活化的T细胞。CD25分子是IL-2R的α链,对形成高亲和力受体有重要意义,主要分布于活化的T细胞表面。故采用流式细胞术检测E-ASV-10和E-ASV-19多肽与人DC细胞共孵育后人T淋巴细胞活化,即单克隆抗体CD25和4-1BB标记的T细胞活化程度。同时以CD3、CD4、CD8抗体标记T细胞,检测细胞内IFN-γ的含量。结果显示多肽E-ASV-10和E-ASV-19在体外可诱导HLA-A*02限制性T细胞的扩增和活化,上调4-1BB+CD25+细胞比例,促进CD4+、CD8+T细胞IFN-γ的合成和释放。
小鼠EGFR 基因(NP_997538.1)和人EGFR 基因(NP_005219.2)高度同源,在EGFR20外显子V769_D770 insASV突变前后90AA范围内(L704-P794)碱基序列100%同源,生物分析软件预测E-ASV-10多肽可同小鼠H-2Kb和H-2Kd分子结合,提示E-ASV-10可刺激C57BL/6小鼠(H-2Kb)和Balb/c小鼠(H-2Kd)产生特异性杀伤T细胞。本研究选取C57BL/6小鼠骨髓来源DC细胞与E-ASV-10共孵体外诱导小鼠CTL细胞,通过与携带EGFR V769_D770insASV的LLCasv细胞系共培养,证实了多肽E-ASV-10体外可刺激C57BL/6小鼠的T细胞分泌IFN-γ,对携带V769_D770insASV的小鼠NSCLC细胞LLCasv具有杀伤活性。
本研究设计的多肽E-ASV-10和E-ASV-19能够在体外诱导特异性靶向携带V769_D770insASVNSCLC细胞的杀伤性T细胞,但仍然存在一些局限性。首先,由于本研究主要通过细胞实验和小鼠移植瘤模型进行论证,实验方法比较单一,后续将通过采集EGFR 20ins NSCLC患者原代组织构建小鼠PDX模型来对实验结果进行进一步验证。其次,针对TNAs的设计仍需优化,如提高CTL表位的免疫原性、克服人类白细胞抗原(human leukocyte antigen,HLA)限制性、延长多肽的长度以及改善HLA的低表达等[24-25]。大多数免疫疗法集中于通过直接激活效应T细胞或减轻其抑制来增强免疫应答,而肿瘤可以降低MHC-Ⅰ分子的表达,从而使肿瘤细胞逃逸机体的免疫监视,并增加免疫抑制性受体的表达[26]。因此,上调MHC-Ⅰ分子和靶细胞上的抗原呈递对于适应性免疫反应必不可少。通过调节有限抗原的表达,结合靶向调节MHC-Ⅰ通路的分子,如靶向NF-κB[27]、IL6/STAT3[28]和MAPK[29]的抑制剂等,可以开发出新的协同治疗策略,有望改善临床疗效。
总之,本研究通过生物信息分析和功能实验,证实E-ASV-10和E-ASV-19多肽不仅在体外诱导人HLAA*02限制性T细胞的扩增和活化,而且在C57BL/6小鼠可诱导特异性靶向携带V769_D770insASV突变的LLC肺癌的杀伤性T细胞,提示其作为一种新的肿瘤疫苗用于治疗携带相应EGFR exon20插入突变的NSCLC具有潜在临床应用前景,为肺癌免疫治疗提供新思路。
