FOXO1 和FOXO3a 基因靶向转导对缺氧/复氧小鼠心肌细胞的作用研究
2020-04-17李继红阿尔祖古丽米尔阿卜杜拉金晓倩黄莺通讯作者马依彤马翔刘芬陈邦党刘成
李继红 阿尔祖古丽·米尔阿卜杜拉 金晓倩 黄莺(通讯作者) 马依彤 马翔 刘芬 陈邦党 刘成
(1 新疆医科大学第一附属医院冠心病二科 新疆 乌鲁木齐 830054)
(2 新疆心血管病研究所 新疆 乌鲁木齐 830054)
心肌梗死是心力衰竭是主要原因之一。研究其发病机制,有助于寻找新的干预措施,来提高预防及治疗效率,达到提高患者的生存率及生活质量、改善冠心病心肌梗塞预后的目的。与衰老有关的氧化应激是缺血性心力衰竭的发病机制之一,氧化应激所产生的机体活性氧簇(ROS)促使动脉硬化斑块破裂,导致冠状动脉血栓形成;急性心肌梗塞发生时,ROS 会参与到组织损伤反应[1-2]。研究显示,ROS 的不良作用可能被抗氧化应激反应所抑制,起到改善缺血性心力衰竭预后的作用。叉形头转录因子O 亚族(forkhead box transcription factor O,FoxO)是重要的抗氧化应激调节因子,过表达FOXO1 可以抑制ROS 并减少心肌细胞死亡[3],但转基因的方法会导致胚胎致死,因此需要寻找合适的载体进行靶向基因转导。据报道,Fox O1、Fox O3a 及 Fox O4 对维持心功能和调节心脏应力有至关重要的作用[4]。其中,FoxO3a 能够抑制肿瘤进展,调节血管内皮细胞、心肌细胞及血管平滑肌的生物学功能,同时有明确的抗氧化应激作用,因此,可能可用于心血管疾病的诊治。因此本研究拟通过观察重组腺病毒靶向转导Fox O1、Fox O3a基因对缺氧/复氧(H/R)心肌细胞的作用,探讨其抗氧化作用及由此带来的细胞功能变化,报告如下。
1.资料与方法
1.1 一般资料
将H9C2 小鼠的心肌细胞先缺氧(H)3h 后,复氧(R)6h,然后建立缺氧/复氧损伤模型;然后随机分为5 个组:A 组为Control 组,B 组为缺氧/复氧(H/R)组),C 组为缺氧/复氧+FOXO1 组,D 组为缺氧/复氧+FOXO3a 组、E 组为缺氧/复氧+FOXO1+FOXO3a 组。
1.2 方法
1.2.1 检测细胞中的蛋白表达情况 细胞裂解后进行蛋白定量,20μg/孔,加上样缓冲液沸水浴后离心取上清上样,PAGE胶放入电泳槽并加缓冲液,加样,80V 20min;电泳后胶移入转膜缓冲液,剪下PVDF 膜,甲醇浸泡3min,水洗2min,剪6 块滤纸与PVDF 膜,然后在转膜缓冲液中平衡15min。转膜装置设定为恒流200mA,40min。膜洗1 次(放入TBST 中),然后置于丽春红染色液中,5min 后水洗膜至水变清无色蛋白条带清晰。5% BSA 室温封闭1 h,一抗和膜4 ℃中孵育过夜。孵育一抗的膜洗涤(实验室TBST)3 次后按1 ∶5000 稀释二抗,与膜37℃孵育1 h。洗涤3 次,于化学发光仪中进行拍照。
1.2.2 氧化应激相关指标活性氧的水平 稀释好的蛋白0.1ml 加入,4℃放置一夜。次晨,清洗。在已包被好的反应孔加 0.1ml稀释好的标本,37℃培育1h。将稀释好的酶标抗体 0.1ml加入到实验孔,37℃培育0.5 ~1h。把TMB 溶液滴人各反应孔中,培养(在37℃,10 ~30 min)后使用 H2SO4( 0.05ml)终止实验。对其吸光度OD 值进行测量:调整ELISA 检测仪波长为450nm,或用波长为410nm 的ABTS 显色。见图1。
图1 组织细胞中T-AOC 能力
1.2.3 检测细胞凋亡情况 爬片细胞固定(4%多聚甲醛)20 ~30min,进行室温(用百分之一TritonX-100)通透3 ~5min;滴加100μl DNase I 反应液,37℃30min,并且配制TdT 酶反应液: 37 度避光反应60 min,每个样本中滴加50μl Streotavidin-Fluorescein 标记液后放入湿盒,37 度避光反应30min,Hoechst 复染细胞核:用pH7.4 的PBS 洗涤3 次,去除PBS 后,加入Hoechst 染液。孵育10min(避光室温)。镜下观察并拍照。
1.2.4 Brdu 法检测细胞增殖活力 H9C2 细胞以5×104cells/ml细胞数接种于24孔板中,1ml/孔,温度为37 ℃,培养(在5% CO2培养箱中)24h。对各组细胞进行不同处理,在48h 后终止细胞培养之前,加入BRDU(50μM),37℃孵育40min。吸弃培养液,静置5min 后吸出液体,重复5 次。甲醇/醋酸固定10min。经固定的玻片空气干燥,用0.3% H2O2-甲醇30min 灭活内源性氧化酶。用封闭(5%的BSA)。变性核酸5min(100℃的甲酰胺)。冷却。使用PBS 洗涤,加入抗大鼠BrdU 单抗,4℃过夜孵育。加PBS 洗涤,并重复5 次。加荧光二抗,在37℃中孵育1h。加PBS洗涤,再重复5 次。使用Hoechst 33258 染液孵育30min(室温避光)后,镜下观察拍照保存。
2.结果
2.1 转染后H9C2 细胞蛋白表达
WB 结果显示:FOXO1 在B 组表达最低,FOXO1 病毒作用后表达会明显的上升,且高于A 组;FOXO3a 病毒基本不会影响FOXO1表达;FOXO3a 蛋白在B 组中表达也是会最低,FOXO3a 病毒作用后其表达则会明显的上升,且高于A 组,FOXO1 病毒对FOXO1 蛋白的表达有一定影响。见图2。
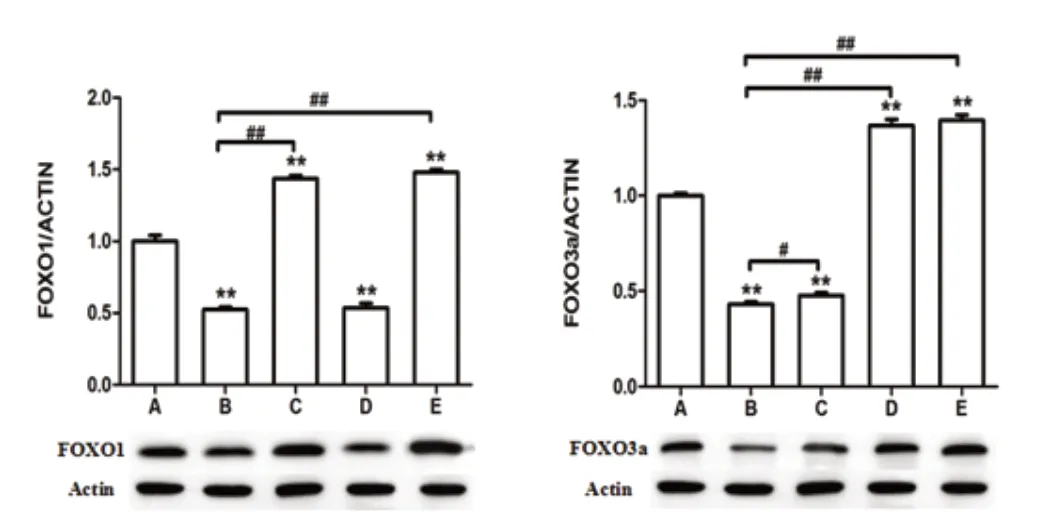
图2 Western blot 检测细胞中FOXO1 与FOXO3a 的表达
2.2 FOXO1 与FOXO3a 对H9C2 细胞缺氧/复氧时氧化应激相关指标的影响
ELISA实验结果提示:SOD与T-AOC活性的表达趋势基本相同,均为B 组中表达最低。FOXO1 与FOXO3a 基因转导后表达升高明显;MDA 含量、ROS 活性及NO 含量检测趋势基本相同,均为B 组中表达最高,FOXO1 或/与FOXO3a 基因转导后表达降低明显。见图3。
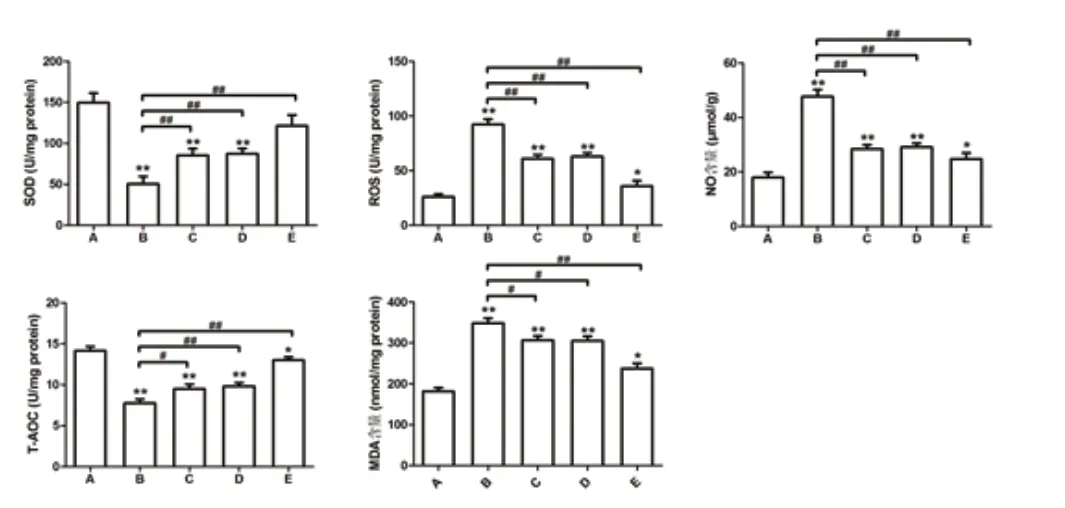
图3 用ELISA 法检测细胞氧化应激相关指标的水平
2.3 FOXO1 与FOXO3a 的基因转导对缺氧/复氧H9C2 细胞凋亡的影响
TUNEL 结果提示:蓝光代表正常细胞核,绿光代表凋亡的细胞核;A 组的凋亡是最少的,B 组的凋亡情况最多,C 和D 组的凋亡率显著低于B组,而E组的凋亡进一步下降,但仍高于A组。见图4。
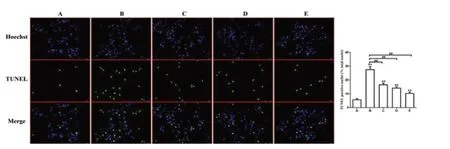
图4 TUNEL 检测H9C2 细胞的凋亡情况
2.4 FOXO1 与FOXO3a 基因转导对于缺氧/复氧H9C2 细胞增殖活力的影响
Brdu 检测结果提示:蓝光代表正常的细胞核,红光代表增殖的细胞核,A 组的增殖能力显著高于其他四组;B 组的增殖能力最低;C、D 组的增殖能力要显著高于B 组,但比A 组低;E 组的增殖能力高于C 组及D 组,比A 组略低。见图5。
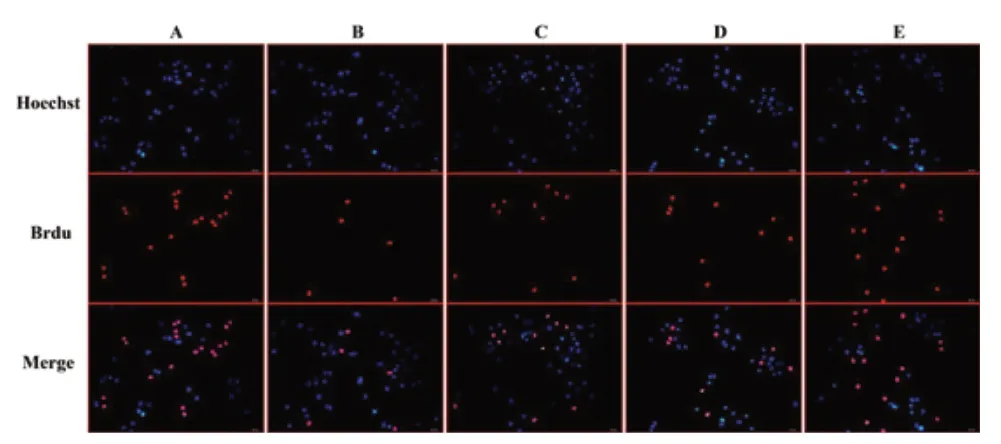
图5 Brdu 法检测缺氧/复氧H9C2 细胞的增殖活力
3.讨论
目前,缺血性心肌损害已成为心力衰竭的首要病因,而氧化应激反应在心力衰竭的发生及进展中起到了至关重要的作用。FoxO 是重要的抗氧化应激调节因子。既往研究显示:在肝细胞中,通过上调FOXO1 的蛋白的表达,可抑制裸鼠皮下移植性肝肿瘤的生长[3];成骨细胞中增强FOXO1 的活性可降低Bcl-2 表达,使成骨细胞生长受到抑制。有研究表明,FOXO1 还可激活FasL、CD95、Bim 促凋亡蛋白的表达[5-6],提示了FOXO1 重新激活可能是细胞存活与凋亡的关键调节因子之一。而通过调节FOXO3 的表达,能够阻碍缺血性损伤和心肌梗死患者病情的进展。FoxO3a转录因子已被证实可抑制 VSMCs 增殖并有抗氧化应激作用,继而可能会降低高血压对机体的影响[7]。心血管疾病中Fox O3a 有保护和损伤的双重作用,如何更好地利用其调控机制治疗心血管疾病值得进一步研究。
本研究显示,FoxO1、FoxO3a 被重组腺病介导后转染缺氧/复氧心肌细胞,有效的减少了细胞的凋亡。据此得出结论,FOXO1 与FOXO3a 的基因转导,减轻了氧化应激反应对H9C2 心肌细胞的损伤。H9C2 心肌细胞的增殖、存活能力明显的改善。此研究结果,为缺血性心脏病心力衰竭的基因治疗提供了新的研究数据,并开拓了新的研究领域,为药物研究提供了新的靶点。
