联合治疗方案对原发性失眠病人睡眠质量、抑郁情绪及睡眠结构指标的影响
2020-04-16谢宇宽李杨陈艳琼李雪英
谢宇宽,李杨,陈艳琼,李雪英
原发性失眠是一类因多种原因引起入睡困难或无法入睡、睡眠质量下降的临床常见疾病类型;流行病学报道显示,原发性失眠病人人数约占正常人群20%~25%,已成为影响日常生活质量的重要原因[1-2]。目前对于原发性失眠临床治疗主要包括药物和物理手段两大类,其中药物长期应用后易形成耐药性或依赖性,停用后复发加重风险较高[3-4]。近年来以重复经颅磁刺激(rTMS)为代表物理治疗手段越来越受到医学界的关注;rTMS主要通过脉冲磁场所形成的电流对大脑皮质代谢状态及脑血流量进行刺激,从而达到调节大脑功能和症状控制目的[5];该手段多用于包括抑郁症在内多种精神疾病临床治疗,但在原发性失眠领域应用相对较少,亦缺乏相关随机对照研究证实[6-7]。本研究旨在探讨联合治疗方案对原发性失眠病人睡眠质量、负面情绪及睡眠结构指标的影响,为临床治疗方案制定提供更多循证依据,现报告如下。
1 资料与方法
1.1 一般资料 选取自贡市精神卫生中心2016年1月至2018年1月收治的原发性失眠病人共160例,纳入标准为:①符合《中国成人失眠诊断与治疗指南》(2012版)诊断标准[6-7];②病程≥3个月;③年龄≥18岁,④病人或其近亲属知情同意,本研究符合《世界医学协会赫尔辛基宣言》相关要求。排除标准为:①近4周应用镇静催眠类药物;②汉密尔顿抑郁量表17项(HAMD-17)评分>17分或汉密尔顿焦虑量表(HAMA)评分>14分;③研究药物过敏;④睡眠呼吸暂停综合征;④重症肌无力;⑤心脑肝肾功能障碍;⑥酗酒或药物依赖;⑦临床资料不全。
入选病人以随机数字表法分为对照组和观察组,每组各80例;对照组病人中男性21例,女性59例,年龄为(48.75±6.16)岁,病程为(9.75±1.30)个月,体质量指数(BMI)为(21.45±2.30)kg/m2,催眠药物使用评分为(2.30±0.87)分,根据失眠严重程度划分,轻度52例,中度28例;观察组病人中男性24例,女性56例,年龄为(48.30±6.07)岁,病程为(9.84±1.33)个月,BMI为(21.51±2.35)kg/m2,催眠药物使用评分(2.24±0.84)分,根据失眠严重程度划分,轻度55例,中度25例;两组病人一般资料比较差异无统计学意义(P>0.05)。
1.2 治疗方法 观察组病人采用唑吡坦+低频rTMS方案治疗,包括:①唑吡坦前2天剂量为每天5 mg,第3天起加量至10 mg/d;②rTMS刺激部位、频率及强度分别为右侧前额叶背外侧,1 Hz,90%运动阈值,每次刺激2 s,间隙1 s,每天刺激1 400次,每周5 d,休息2 d再行下一疗程。对照组病人则采用唑吡坦+rTMS假性刺激方案治疗,唑吡坦用法用量,rTMS刺激部位、频率、强度及次数均于观察组相同,但rTMS线圈垂直于颅骨。两组疗程均为4周,唑吡坦为江苏豪森药业股份有限公司生产,生产批号20150344,规格5 mg。
1.3 观察指标[6]①睡眠质量评价采用匹茨堡睡眠质量指数量表(PSQI)评分;②睡眠抑郁情绪评价采用简单自测抑郁量表(PHQ-9)评分;③多导睡眠监测,监测时保证房间安静且室温维持18~25℃[5];③睡眠结构指标包括Ⅰ期、Ⅱ期、Ⅲ期及快速动眼;④不良反应类型包括头晕、头痛、乏力及刺激疼痛。
1.4 疗效判定标准[6]①治愈,睡眠效率指数≥80%;②显效,睡眠效率指数为70%~79%;③有效,睡眠效率指数为60%~69%;④无效,睡眠效率指数<60%。睡眠效率指数计算公式为(实际入睡时间/记录时间)×100%。总有效率=[(治愈例数+显效例数+有效例数)/总例数]×100.00%。
1.5 统计学方法 数据分析选择SPSS22.0软件。计数资料以例(率)描述,组间比较为χ2检验(常规资料)或秩和检验(疗效等级资料)。计量资料以±s描述,两组间比较为成组t检验。组内前后比较为配对t检验。多时点观测资料则行重复测量方差分析。检验水准为α=0.05。
2 结果
2.1 近期疗效比较 随访过程中7例病人失访,其中对照组4例,观察组3例:观察组病人近期治疗总有效率为96.25%,明显优于对照组的84.21%(P<0.05),见表1。

表1 原发性失眠病人153例近期疗效比较
2.2 PSQI评分和PHQ-9评分比较 整体比较(两因素重复测量方差分析)知:各指标组间差异、时间差异及交互作用均有统计学意义(P<0.05)。两两精细比较并结合主要数据分析:观察组病人治疗后各时点的PSQI评分和PHQ-9评分均显著优于对照组(P<0.05)。见表2。
2.3 两组病人治疗前后多导睡眠监测指标和睡眠结构指标水平比较 两组治疗前后的多导睡眠监测指标和睡眠结构指标水平均明显变化(P<0.05),且观察组病人治疗后多导睡眠监测指标和睡眠结构指标水平均显著优于对照组(P<0.05),见表3,4。
表2 原发性失眠病人153例治疗前后PSQI评分和PHQ-9评分比较/(分,±s)
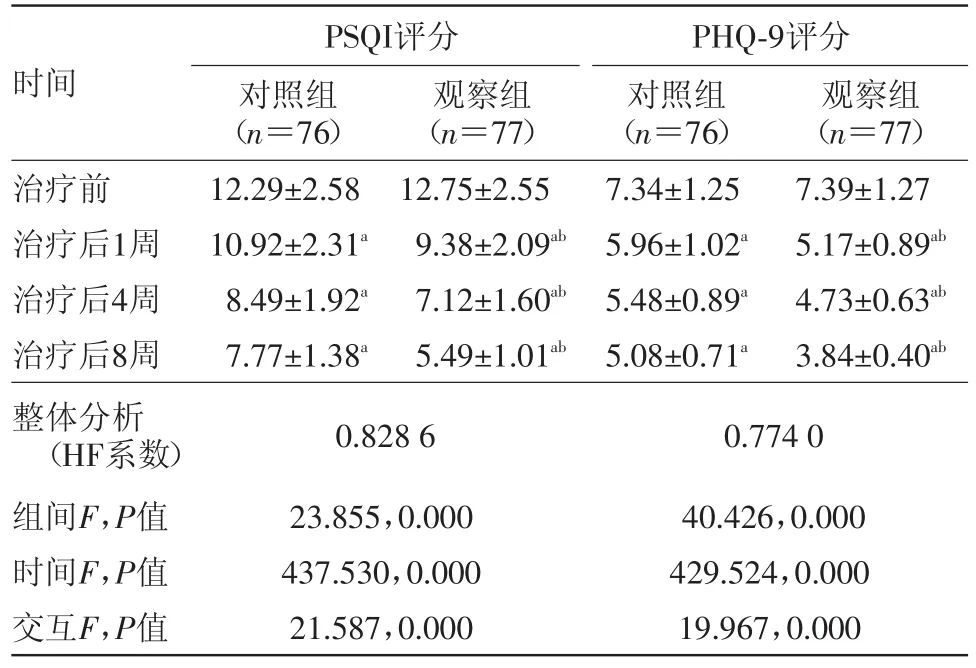
表2 原发性失眠病人153例治疗前后PSQI评分和PHQ-9评分比较/(分,±s)
注:时间精细比较为差值t检验,与组内治疗前比较,a P<0.05。组间精细比较为LSD-t检验,与两组同时点相比,b P<0.05
PSQI评分PHQ-9评分时间 观察组(n=77)7.39±1.27 5.17±0.89ab 4.73±0.63ab 3.84±0.40ab对照组(n=76)12.29±2.58 10.92±2.31a 8.49±1.92a 7.77±1.38a 0.828 6 23.855,0.000 437.530,0.000 21.587,0.000治疗前治疗后1周治疗后4周治疗后8周整体分析(HF系数)组间F,P值时间F,P值交互F,P值观察组(n=77)12.75±2.55 9.38±2.09ab 7.12±1.60ab 5.49±1.01ab对照组(n=76)7.34±1.25 5.96±1.02a 5.48±0.89a 5.08±0.71a 0.774 0 40.426,0.000 429.524,0.000 19.967,0.000
表3 原发性失眠病人153例治疗前后多导睡眠监测指标水平比较/±s
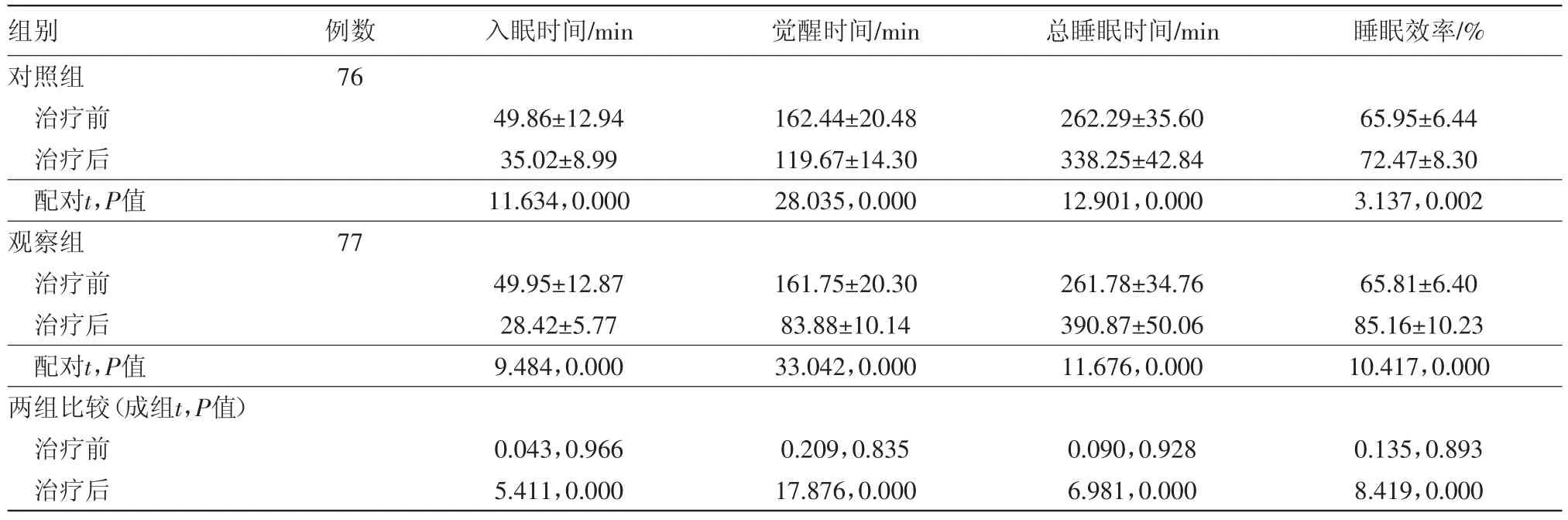
表3 原发性失眠病人153例治疗前后多导睡眠监测指标水平比较/±s
组别对照组治疗前治疗后配对t,P值观察组治疗前治疗后配对t,P值两组比较(成组t,P值)治疗前治疗后例数76入眠时间/min 觉醒时间/min 总睡眠时间/min 睡眠效率/%49.86±12.94 35.02±8.99 11.634,0.000 162.44±20.48 119.67±14.30 28.035,0.000 262.29±35.60 338.25±42.84 12.901,0.000 65.95±6.44 72.47±8.30 3.137,0.002 77 49.95±12.87 28.42±5.77 9.484,0.000 161.75±20.30 83.88±10.14 33.042,0.000 261.78±34.76 390.87±50.06 11.676,0.000 65.81±6.40 85.16±10.23 10.417,0.000 0.135,0.893 8.419,0.000 0.043,0.966 5.411,0.000 0.209,0.835 17.876,0.000 0.090,0.928 6.981,0.000
表4 原发性失眠病人153例治疗前后睡眠结构指标水平比较/(min,±s)

表4 原发性失眠病人153例治疗前后睡眠结构指标水平比较/(min,±s)
组别对照组治疗前治疗后配对t,P值观察组治疗前治疗后配对t,P值两组比较(成组t,P值)治疗前治疗后倒数76Ⅰ期 Ⅱ期 Ⅲ期 快速动眼77 66.29±6.58 35.52±4.72 22.187,0.000 66.85±6.84 188.14±503.11 240.20±62.94 0.757,0.451 187.69±49.84 36.95±5.02 42.13±6.23 6.651,0.000 37.05±5.06 38.90±5.87 45.75±7.63 9.287,0.000 38.64±5.83 27.17±3.39 39.748,0.000 305.07±84.76 13.599,0.000 70.48±9.31 29.131,0.000 72.31±10.41 15.526,0.000 0.516,0.607 12.581,0.000 0.008,0.994 5.369,0.000 0.123,0.902 22.107,0.000 0.275,0.784 17.980,0.000

表5 两组病人治疗前后不良反应发生率比较/例
2.4 两组病人不良反应发生率比较 两组病人不良反应发生率比较差异无统计学意义(P>0.05),见表5。
3 讨论
目前研究认为造成原发性失眠主要原因包括[8-9]:①特定体质如强迫、压抑等;②学习性失眠,即压力导致短暂性失眠后因担忧无法入睡而导致自主神经兴奋,进而引起持续失眠症状;③生活压力。对于原发性失眠临床尚无特效治疗手段,多采用心理疏导、运动疗法、药物疗法及物理疗法等手段进行干预[10]。唑吡坦是一类咪唑吡啶类镇静催眠药物,其主要通过对大脑GABA水平进行调节而达到诱导睡眠作用;已有研究显示,唑吡坦用于失眠病人可有效缩短入睡需要时间,降低夜醒频率,增加总睡眠持续时间,从而达到改善睡眠质量的目的;同时唑吡坦还能够显著延长Ⅱ期睡眠和深睡眠时间,且对快动眼睡眠时间影响较小[11-12]。但大量临床报道显示[13],单纯药物治疗存在疗效持续下降、复发反跳及易形成依赖性等问题,难以满足临床需要。
本研究结果中,观察组病人近期疗效、治疗后PSQI评分、PHQ-9评分、多导睡眠监测指标及睡眠结构指标水平均显著优于对照组(P<0.05),证实低频rTMS辅助用于原发性失眠治疗有助于提高睡眠质量、缓解抑郁情绪及改善睡眠结构;尽管rTMS假性刺激存在安慰剂效应,观察组总体疗效仍优于对照组。rTMS近年来被广泛用于精神系统疾病临床治疗,磁场形成感应电流,改变皮质神经细胞动作电位,进而影响颅内代谢和电生理活动[14]。已有研究显示[15],低频rTMS可有效拮抗大脑皮质兴奋性,刺激5-HT和GABA释放;而5-HT已被证实是诱导睡眠形成关键神经递质,故理论上该方法可用于失眠症状改善。
Ⅲ期睡眠属于深度睡眠,其时间延长可有效促进体力精力恢复,而快速眼动期睡眠则能够增强记忆力;相关临床报道证实,镇静催眠类药物对于睡眠时间延长主要在Ⅱ期睡眠方面,Ⅲ期和快速眼动睡眠效果较差,故病人主观感觉睡眠改善效果欠佳,甚至还可出现记忆力下降现象[16]。本次研究进一步证实低频rTMS在改善睡眠质量方面存在优势;采用低频rTMS对右侧前额叶背外侧进行刺激首先可诱导该区域神经元超极化,拮抗大脑皮质过度兴奋;其次能够通过刺激松果体褪黑色素合成分泌,上调神经元5-HT、NE及GABA水平,促进机体正常睡眠-觉醒周期恢复[17];5-HT在人体内广泛参与到睡眠-觉醒周期、情感障碍等生理活动中;而GABA属于生理性抑制神经递质之一,其水平下降能够诱发失眠和情感障碍出现[18]。此外低频rTMS还具有减轻海马区域神经功能损伤,加快神经再生及修复进程、改善慢性失眠状态等多种作用[19]。
本研究结果中,两组病人不良反应发生率比较差异无统计学意义(P>0.05),证实原发性失眠病人在药物应用基础上加用rTMS安全性良好,并未增加不良反应发生风险。以往学者认为rTMS存在诱导癫痫发作风险,但这一问题与刺激频率、强度有关,且总体发生率低于0.01%[15];本次研究观察组中2例病人出现刺激疼痛,笔者认为属于紧张性头痛,且停止治疗后自行消失。
综上所述,联合治疗方案用于原发性失眠病人治疗可有效提高睡眠质量,减轻抑郁情绪,改善睡眠结构,且安全性值得认可。
