碳酸镉转化制备氢氧化镉及产物光催化降解性
2020-04-15陈庆春万文杰晏乐安邓慧宇
陈庆春,邦 宇,万文杰,晏乐安,邓慧宇
(1.东华理工大学核资源与环境国家重点实验室,江西南昌330013;
2.东华理工大学材料科学与工程系;3.化工资源有效利用国家重点实验室)
纳米材料的传统制备方法由于实验参数众多,使得有效控制纳米材料的尺寸、形貌、结构和化学组成等变得较为困难[1-3]。纳米材料的化学转化方法可以将众多的参数变得单一和直接, 所以这一方法近年来引起了不少学者的广泛关注。 G.D.Moon 等[4-5]和J.Park 等[6]及时总结了固态纳米材料化学转化的4 种情形,其中的两种属于离子交换法,分别是阳离子交换法和阴离子交换法。 由于离子交换法制备纳米材料具有直接、普适性和高效的特点[4,7],诸多研究人员进行了富有成效的工作。如A.Klinkova[8]利用阳离子交换反应制备了半导体纳米晶;Z.Tan 等[9]利用离子交换法合成了用于锂离子电池高容量阳极的纳米氧化锡/微米碳复合结构;利用离子交换法还可制备用于能源领域的纳米材料[10];利用离子交换法制备中空微/纳米结构材料用于锂离子电池、光催化和生物医学等领域[11]。
氢氧化镉纳米材料由于具有较宽的能带间隙可以作为重要的能量材料应用于太阳能电池、光电晶体管、透明电极、能量存储和传感器。 此外,它还是一类主要的前驱物, 通过高温煅烧或相关化学反应转化为纳米氧化镉、硫化镉等。逯亚飞等[12]综述了氢氧化镉纳米材料的制备方法,而刘俊渤等[13]采用水热合成法制备了六方形的氢氧化镉纳米盘,笔者也在前期研究中利用支撑液膜法制备了氢氧化镉纳米线[14]。
有文献指出,已有氢氧化镉纳米材料的制备方法在以下方面有待改善:1)材料形貌的可控性;2)合成条件的温和和环境友好;3)生产方法的可工业化[12]。 针对以上合成方向,本研究以沉淀碳酸镉为模板,在室温下通过离子交换将碳酸镉转化为氢氧化镉,并参考相关文献[15-16],选定罗丹明B 染料作为降解物,比较研究沉淀碳酸镉和转化产物的光催化降解性。 本研究工作的开展,丰富了纳米材料的合成方法,为类似材料的制备提供借鉴。
1 实验部分
1.1 试剂与仪器
本研究所用硫酸镉、无水乙醇、氢氧化钠、碳酸钠、染料罗丹明B(RhB),均为分析纯;二次蒸馏水为自制。
FA2104N 型电子分析天平;KQ218 型超声波清洗器;TGL-16G 型台式高速离心机;DHG4106A 型电热恒温鼓风干燥箱;XPA-7 型多试管搅拌光催化反应仪。
1.2 步骤
1.2.1 沉淀碳酸镉的制备
首先配制0.3 mol/L 的碳酸钠溶液和0.4 mol/L的硫酸镉溶液。 将2 mL 0.3 mol/L 的碳酸钠溶液倒入1 mL 0.4 mol/L 的硫酸镉溶液中, 稍微摇晃后即加入到5 mL 水中,静置3 h 后洗涤样品,二次蒸馏水和无水乙醇交替洗涤6 次,产物记为CH0。
1.2.2 沉淀碳酸镉的转化
配制1.25 mol/L 的氢氧化钠溶液,备用。进行转化反应时,将上述碳酸钠溶液和硫酸镉溶液混合后反应5 min 即用水洗一次, 然后分散到5 mL 水中,按此步骤制备4 份, 第一份加5 滴1.25 mol/L 的氢氧化钠溶液静置3 h 后,用二次蒸馏水和无水乙醇交替洗涤6 次,记为CH1;第二份加15 滴1.25 mol/L 氢氧化钠溶液静置3 h 后,用二次蒸馏水和无水乙醇交替洗涤6 次,记为CH2;第三份加15 滴1.25 mol/L 氢氧化钠溶液静置12 h 后,用二次蒸馏水和无水乙醇交替洗涤6 次, 记为CH3; 第四份加30 滴1.25 mol/L的氢氧化钠溶液静置12 h 后,用二次蒸馏水和无水乙醇交替洗涤6 次,记为CH4。 所有样品在恒温鼓风干燥箱内60 ℃干燥6 h,待表征和性能测试。
1.3 结构表征及性能测试
实验所得全部产物由粉末X 射线衍射仪(D8-advance 型,CuKα 辐射,λ=0.154 056 nm)分析其晶体结构;用场发射扫描电子显微镜(FESEM,S4800型)观察产物形貌。
光催化降解实验在紫外光照射下进行测试。 紫外光为300 W 中压汞灯提供, 反应在室温下进行。典型过程如下:将20 mg 的光催化剂分散到50 mL 8 mg/L 的罗丹明B 染料中,在黑暗环境中磁力搅拌吸附120 min 达吸附平衡后开启汞灯, 每隔一定时间量取4 mL 溶液离心,离心液用紫外可见分光光度计测试罗丹明B 在553 nm 处吸光度。
2 结果与讨论
2.1 产物的XRD 表征结果分析
对所得沉淀碳酸镉和转化产物进行XRD 表征,得到如图1 所示的谱图。图1 表明,随着氢氧化钠滴加量的增加和转化时间的延长,碳酸镉(JCPDS 42-1342)逐步转变为氢氧化镉(JCPDS 20-0179)。 CH0为沉淀法得到的碳酸镉,不含杂质,而CH4 全为氢氧化镉。

图1 样品CH1、CH2、CH3、CH4 和CH0 的XRD 图
2.2 产物的FESEM 表征结果分析
图2 是沉淀碳酸镉的场发射扫描电镜图。 图2表明, 碳酸钠溶液直接混合硫酸镉溶液得到的沉淀碳酸镉是由粒径约为50 nm 的原级小颗粒组装的亚微球,亚微球尺寸在300~400 nm。
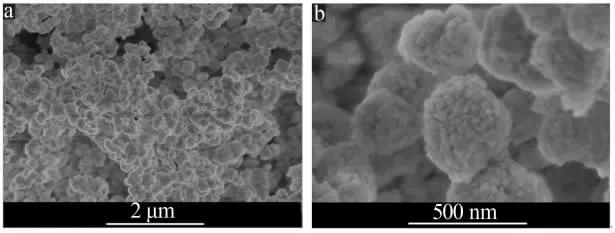
图2 样品CH0 的场发射扫描电镜图
由沉淀碳酸镉转化得到的产物的场发射扫描电镜图见图3。 由图3 可知,随着氢氧化钠溶液滴加量的增加和交换转化时间的延长, 碳酸镉的初始形貌遭到破坏, 逐渐转变为短棒状和薄片状组装的不规则球体。对于样品CH1、CH2 和CH3,从扫描电镜图中难以辨别出哪部分是碳酸镉,哪部分是氢氧化镉。根据XRD 结果分析,样品CH4 转化完全,为氢氧化镉。

图3 样品CH1(a)、CH2(b)、CH3(c)和CH4(d)的场发射扫描电镜图
2.3 产物的光催化降解性能测试
图4 是沉淀碳酸镉和各转化产物在紫外光照下对染料罗丹明B 的降解曲线(a、b、c、d 和e)和随时间变化各体系中残留染料与初始浓度之比曲线(f)。比较图中各曲线,可以发现,在3 h 内,直接混合得到的沉淀碳酸镉在紫外光照下几乎不会催化降解罗丹明B 染料,如图4a 所示;随着氢氧化钠的加入,部分碳酸镉转变为氢氧化镉,光催化能力也得到提升。 但碳酸镉全部转变为氢氧化镉的样品(图4e)并不是光催化降解能力最强的,降解效果最好的是CH2 样品,3 h 内可全部降解完,如图4c 所示。 其原因可能是光照氢氧化镉, 产生的光生电子-空穴对因为碳酸镉的存在而复合变慢, 提高了光催化降解能力。

图4 罗丹明B 在紫外光照下的降解曲线
需要指出的是, 图4 中各产物存在下染料的降解曲线(图4a、b、c、d 和e)都是从开灯30 min 后开始计时,每隔30 min 测量一次,总共计时3 h。 而体系中染料残留率曲线则包含了2 h 的吸附平衡时间, 所以30 min 时的点对应的是2 h 黑暗中的吸附平衡时间和30 min 的光催化降解时间。 一点小问题就是中间缺少2 h 吸附平衡结束时体系中染料相对浓度, 但是笔者认为这并不会影响到各产物之间光催化降解能力的比较。 后续研究在讨论光催化机理时,可以将实验设计得更为精细,看看吸附能力大小是否对降解结果有影响、影响多大。
2.4 讨论
在本研究中,主要对沉淀碳酸镉转化为氢氧化镉进行了实验,实验的理论基础是两种物质的溶度积常数(Ksp)的差异。 氢氧化镉和碳酸镉的溶度积常数分别为3×10-14和1×10-12,溶度积常数的差异使得利用离子交换法将沉淀碳酸镉转化为氢氧化镉制备纳米材料成为可能。 本研究的更多实验(本文未列出)表明,物质间的转换不仅仅受溶度积常数的影响,还受离子交换反应时间、前驱体颗粒大小的影响,比如前驱体颗粒尺寸较大时,一定时间内离子交换反应并不能彻底完成,即便物质间的溶度积常数差异很大。 对于氢氧化镉和碳酸镉共存情形下表现出更好的光催化降解性能,涉及到光催化机理问题,值得更深一步系统研究。
3 结论
1) 在室温常压条件下,用碳酸钠溶液直接混合硫酸镉溶液可以制备纳米颗粒组成的沉淀碳酸镉亚微球。 2)利用碳酸镉和氢氧化镉的溶度积常数差异,以沉淀碳酸镉为模板,氢氧化钠为交换剂,制备了转化产物。 转化产物组成随氢氧化钠溶液滴加量和转化时间的变化而变化。3)300 W 紫外光照射下,20 mg 光催化降解性能最好的转化产物可使50 mL 8 mg/L 的罗丹明B 染料在180 min 内降解完全,光催化降解机理值得进一步系统研究。
