新城疫病毒HN蛋白的酵母表达及其活性鉴定
2020-04-15李旭锋金前跃柴永笑丁培阳张改平
李旭锋,王 垚,金前跃,周 稳,柴永笑,陈 晓,丁培阳,张改平,3
(1.河南农业大学 牧医工程学院,河南 郑州 450002;2.河南省农业科学院 动物免疫学重点实验室,河南 郑州 450002;3.江苏高校动物重要疾病与人兽共患病防控协同创新中心,江苏 扬州 225009;4.西北农林科技大学 动物医学院,陕西 杨凌 712100)
新城疫(Newcastle disease,ND)是由新城疫病毒(Newcastle disease virus,NDV)引起的鸡高度接触性传染病,主要表现为浆膜黏膜出血、呼吸困难、下痢及神经紊乱等[1-3]。ND传播速度快、致死率高、接触传染性强、分布广泛,对家禽养殖业造成了巨大的经济损失,已被世界动物卫生组织(OIE)列为A类疫病[4]。
NDV是副黏病毒科、副黏病毒亚科的腮腺炎病毒属成员[5],是具有囊膜的单股负链RNA病毒。NDV基因组长约15 kb,包含6个基因,从3′到5′的顺序依次为NP-P-M-F-HN-L,分别编码核衣壳蛋白(NP蛋白)、磷酸化蛋白(P蛋白)、基质蛋白(M蛋白)、融合蛋白(F蛋白)、血凝素-神经氨酸酶蛋白(HN蛋白)、RNA聚合酶蛋白(L蛋白)6种结构蛋白[6-7]。F蛋白和HN蛋白是NDV主要的宿主保护性抗原,也是决定NDV毒力和致病性的关键因素[8-9]。HN蛋白位于病毒囊膜表面,是兼具血凝素(HA)活性和神经氨酸酶(NA)活性的糖基化蛋白[10],与病毒的附着和宿主免疫反应有关[11]。
在我国,疫苗接种使ND传播得到有效控制,但长期使用灭活疫苗和弱毒苗[12],容易发生毒株的变异,以及无法区分疫苗免疫和自然感染[13],给NDV检测工作带来困难。此外,国家的中长期免疫计划要求净化ND,需要研发更加安全、可靠的ND新型疫苗[14],而亚单位疫苗便于区分疫苗免疫和自然感染造成的血清阳性,为ND的净化提供了方便。随着DNA重组技术的发展,HN蛋白已在大肠杆菌、杆状病毒、哺乳动物等多种表达系统中成功表达[15-17]。相比之下,酵母细胞具有生长速度快、易于遗传操作、具有真核生物翻译后修饰等优点,被广泛应用于外源蛋白的制备[18-19]。鉴于此,使用毕赤酵母系统表达HN蛋白,优化蛋白质表达条件,将重组HN蛋白通过镍柱亲和层析一步纯化,旨在为进一步研究NDV HN蛋白亚单位疫苗奠定基础。
1 材料和方法
1.1 质粒和菌株
重组质粒pUC57-HN由上海生工生物工程有限公司合成,pPICZαA、毕赤酵母X-33菌株购自Invitrogen公司,大肠杆菌JM109感受态购自TaKaRa公司。
1.2 主要试剂
rTaq酶、T4 DNA连接酶购自TaKaRa公司,限制性核酸内切酶BsmBⅠ、NotⅠ和PmeⅠ购自NEB公司,琼脂糖凝胶核酸染料Super Gel Red购自US Everbright公司,质粒中提试剂盒购自康为世纪公司,胶回收试剂盒购自OMEGA公司,Ni-NTA填料、HisTrapTMexcel(5 mL)购自美国GE公司,羊抗鼠IgG-HRP二抗、羊抗鸡IgG-HRP二抗购自Abbkine公司,BCA蛋白质浓度测定试剂盒、ECL超敏显色液购自北京索莱宝科技有限公司。NDV标准阳性血清购自中国兽药监察所,NDV HN单克隆抗体5F2、NDV阴性血清均由本实验室制备并保存。
1.3 重组表达载体的构建及鉴定
以重组质粒pUC57-HN为模板设计引物,上下游分别引入BsmBⅠ和NotⅠ 2个限制性酶切位点,通过PCR扩增HN基因片段并回收。将回收HN片段和pPICZαA载体同时用BsmBⅠ和NotⅠ进行双酶切后回收,酶切产物经T4 DNA连接酶连接,构建pPICZαA-HN酵母表达载体。连接产物转化至JM109感受态后,将菌液均匀涂布在LLB(Zeocin 30 μg/mL)平板,37 ℃摇床(220 r/min)过夜培养,挑取单克隆菌落进行PCR鉴定并送公司测序。
1.4 毕赤酵母的转化和阳性克隆鉴定
将测序正确的阳性菌液按1∶1 000接种到250 mL LLB培养基中,37 ℃摇床(220 r/min)过夜培养,按质粒中提试剂盒说明提取质粒并测定浓度。质粒用PmeⅠ酶单酶切后回收,经测定其质量为6.9 μg,达到电转要求。将回收的质粒和X-33感受态混匀,加入到预冷的电转杯中,冰上静置5 min,按照电压1.5 kV、电容25 μF、电阻200 Ω、电击时间4.7 ms的程序进行电转,电转后迅速加入1 mL预冷的1 mol/L山梨醇,混匀后转移到1.5 mL EP管中30 ℃培养2 h。然后取适量细胞悬液均匀地涂布到YPD(Zeocin 100 μg/mL)平板上,30 ℃倒置培养2~4 d。
挑取YPD平板上10个单克隆分别接种到5 mL YPD培养基中,编号1—10,30 ℃过夜培养。各取1 mL菌液离心,菌体用NaOH(0.5 mol/L)处理,7 000 r/min离心后弃上清。用双蒸水重悬,离心弃上清,重复一次。沉淀中加入50 μL双蒸水重悬,沸水煮10 min后离心,取1 μL上清作为PCR模板,进行PCR鉴定。
对输电线路实施监控,实时掌握输电线路的各种运行参数是实现电力设备状态检修的前提,也是建设智能电网的一个重要组成部分。大多数输配电设备地处偏远,工作环境恶劣,检修设备的供电问题难以解决,特别是夜间照明设备是很难解决的问题。因此为电网检修设备设计高性能供电电源问题很有必要[1-2]。
1.5 蛋白质的诱导表达和鉴定
PCR鉴定阳性菌液按1∶10接种于BMGY培养基中,30 ℃摇床(220 r/min)培养24 h,将BMGY中菌液按1∶5接种至BMMY培养基中,并每天加入1%的甲醇进行诱导。
诱导第3天,各取2 mL菌液离心取上清,加入20 μL镍填料,4 ℃过夜孵育。离心弃上清,沉淀中加入100 μL 500 mmol/L咪唑(Imidazole)重悬,离心(12 000 r/min)取上清进行SDS-PAGE和Western blot鉴定。
采用半干法转膜,用含5%脱脂奶粉的PBST溶液4 ℃过夜孵育。一抗为1∶1 000稀释的5F2单抗,37 ℃孵育1 h,PBST洗5遍,二抗为1∶1 000稀释的羊抗鼠IgG-HRP,37 ℃孵育1 h,PBST洗5遍,ECL显色液显色。
1.6 蛋白质表达条件的优化
毕赤酵母作为外源重组蛋白表达系统,诱导剂浓度、诱导培养基初始pH值、诱导温度、诱导时间等条件均会影响外源蛋白的表达量,因此对上述条件进行优化,以提高HN蛋白的表达量。
1.6.1 诱导剂含量 甲醇含量大于3.0%会对细胞产生毒性作用,分别用终含量为0、0.5%、1.0%、1.5%、2.0%、2.5%、3.0%的甲醇进行诱导,在第3天收取上清,用Dot blot进行分析。
1.6.2 诱导培养基初始pH值 毕赤酵母生长的pH值范围为3.0~8.0,试验中培养基的初始pH值分别设置为2.0、3.0、4.0、5.0、6.0、7.0、8.0,诱导培养3 d收取上清,进行Dot blot分析。
1.6.4 诱导时间 毕赤酵母培养时间一般为3~5 d,试验中从第1天开始每天收取上清,收取6 d,进行Dot blot分析。
Dot blot操作步骤:取NC膜,用96孔板压出印迹,每个点按5 μL上清点样,将膜烘干后,用含5%脱脂奶粉的PBST溶液4 ℃过夜孵育。一抗为1∶1 000稀释的5F2单抗,37 ℃孵育1 h,PBST洗5遍,二抗为1∶1 000稀释的羊抗鼠IgG-HRP,37 ℃孵育1 h,PBST洗5遍,ECL显色液显色,通过显色强弱及灰度扫描进行结果判定。
1.7 蛋白质纯化
按1.6中研究出的最适条件进行诱导表达,菌液8 000 r/min离心30 min,取上清用0.45 μm滤膜抽滤。采用HisTrapTMexcel(5 mL)预装柱进行纯化,先用双蒸水冲洗柱子,再用平衡缓冲液(20 mmol/L Tris-HCl、150 mmol/L NaCl、pH值 8.0)平衡柱子,然后用蠕动泵上样,流速设为1.5 mL/min。上样结束后用AKTA pure纯化仪进行纯化,用平衡缓冲液(20 mmol/L Tris-HCl、150 mmol/L NaCl、pH值 8.0)和洗脱缓冲液(20 mmol/L Tris-HCl、150 mmol/L NaCl、500 mmol/L Imidazole、pH值8.0)为母液设置梯度,摸索最佳纯化条件。并用SDS-PAGE和Western blot鉴定。最后用BCA蛋白质浓度测定试剂盒测定浓度后,-80 ℃分装保存。
1.8 蛋白质活性鉴定
将纯化蛋白包被酶标板(10 μg/孔),含5%脱脂奶粉的PBST溶液4 ℃过夜孵育,一抗加入倍比稀释的NDV标准阳性血清,同时设阴性血清对照,37 ℃孵育1 h,PBST洗5遍,二抗为1∶1 000稀释的羊抗鸡IgG-HRP,37 ℃孵育1 h,PBST洗5遍,显色后酶标仪测定OD450。
1.9 蛋白质糖基化分析
取适量纯化蛋白,按PNGase F酶切说明操作,37 ℃酶切1 h后Western blot鉴定。
2 结果与分析
2.1 重组表达载体的鉴定
将HN基因片段经T4 DNA连接酶连接至pPICZαA载体,转化JM109感受态,PCR鉴定为阳性(图1),菌液测序结果正确,表明pPICZαA-HN表达载体构建成功。
2.2 酵母单克隆PCR鉴定
挑取的酵母单克隆经处理后,PCR鉴定结果显示,5株单克隆呈阳性(图2)。可见,目的片段成功整合至酵母基因组,可进行诱导表达。
2.3 HN蛋白诱导表达
取镍填料富集的上清80 μL加入20 μL 5×Loading Buffer,沸水煮10 min,进行SDS-PAGE(图3)和Western blot(图4)鉴定,结果显示,蛋白质条带大小正确,能被NDV HN单克隆抗体5F2特异性识别,由此表明,HN蛋白在毕赤酵母X-33中实现了分泌表达,且表达蛋白抗原性良好。
M:DL2000;1—4:单克隆菌落;5:阴性对照M:DL2000;1—4:The single colony strains;5:Negative control图1 pPICZαA-HN载体PCR鉴定Fig.1 Identification of pPICZαA-HN by PCR

M:DL2000;1—7:单克隆菌落;8:阳性对照;9:阴性对照M:DL2000;1—7:Single colony strains;8:Positive control;9:Negative control图2 酵母菌落PCR鉴定Fig.2 Identification of yeast colony strains by PCR

M:蛋白质Marker;1:空载体;2:未诱导;3—7:阳性克隆M:Protein Marker;1:Empty vector;2:Not induced;3—7:Positive clones图3 SDS-PAGE检测HN蛋白表达Fig.3 SDS-PAGE to detect HN protein expression
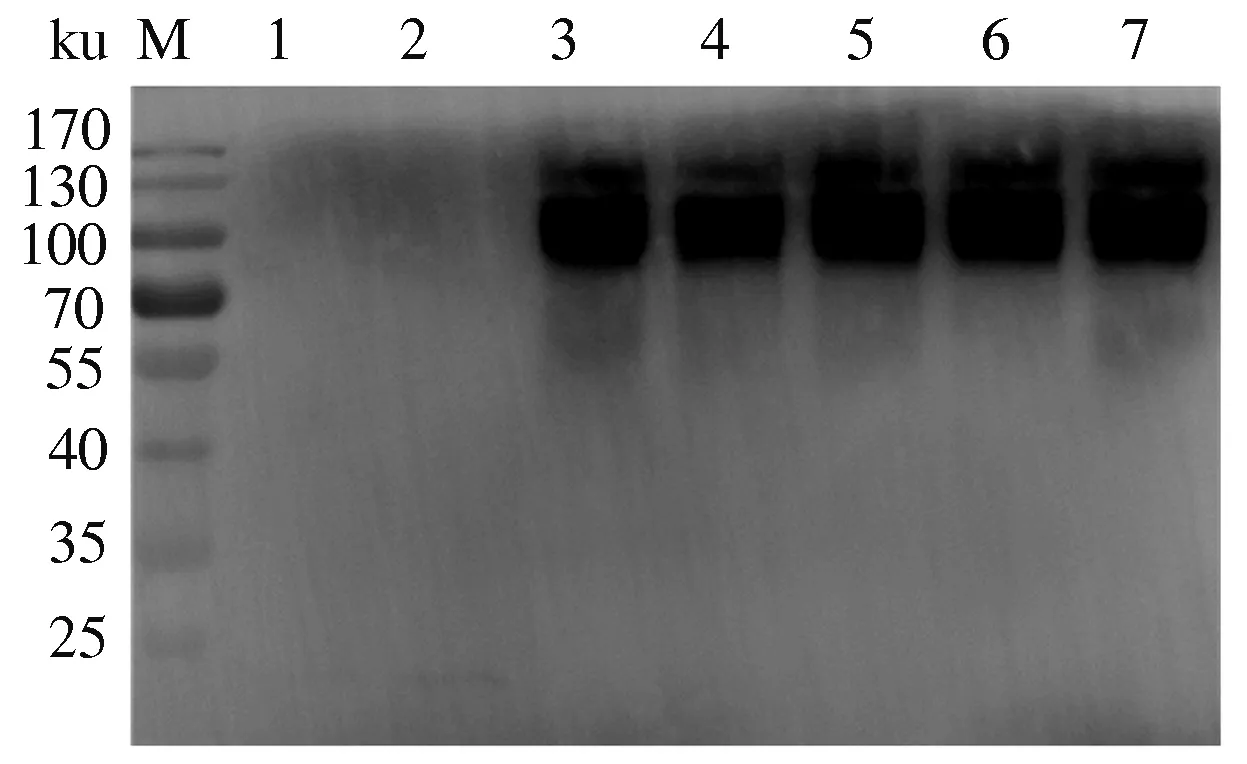
M:蛋白质Marker;1:空载体;2:未诱导;3—7:阳性克隆M:Protein Marker;1:Empty vector;2:Not induced;3—7:Positive clones图4 Western blot 检测HN蛋白表达Fig.4 Western blot to confirm the positive clones expressed HN protein
2.4 蛋白质表达条件优化
2.4.1 诱导剂含量 如图5所示,当甲醇含量为0.5%时,显色最亮,且1∶32稀释时仍有显色;当甲醇含量大于2%时,显色明显变弱。故本试验中HN蛋白表达的最适甲醇含量为0.5%。

图5 不同甲醇含量诱导表达效果Fig.5 Expression results of different content of methanol
2.4.2 诱导时间 如图6所示,随诱导时间递增,显色增强,说明HN蛋白表达量增加,但第5天和第6天没有明显差异,而随着诱导时间增长杂蛋白和代谢产物增多,不利于目的蛋白的纯化,故本试验选择的诱导时间是5 d。
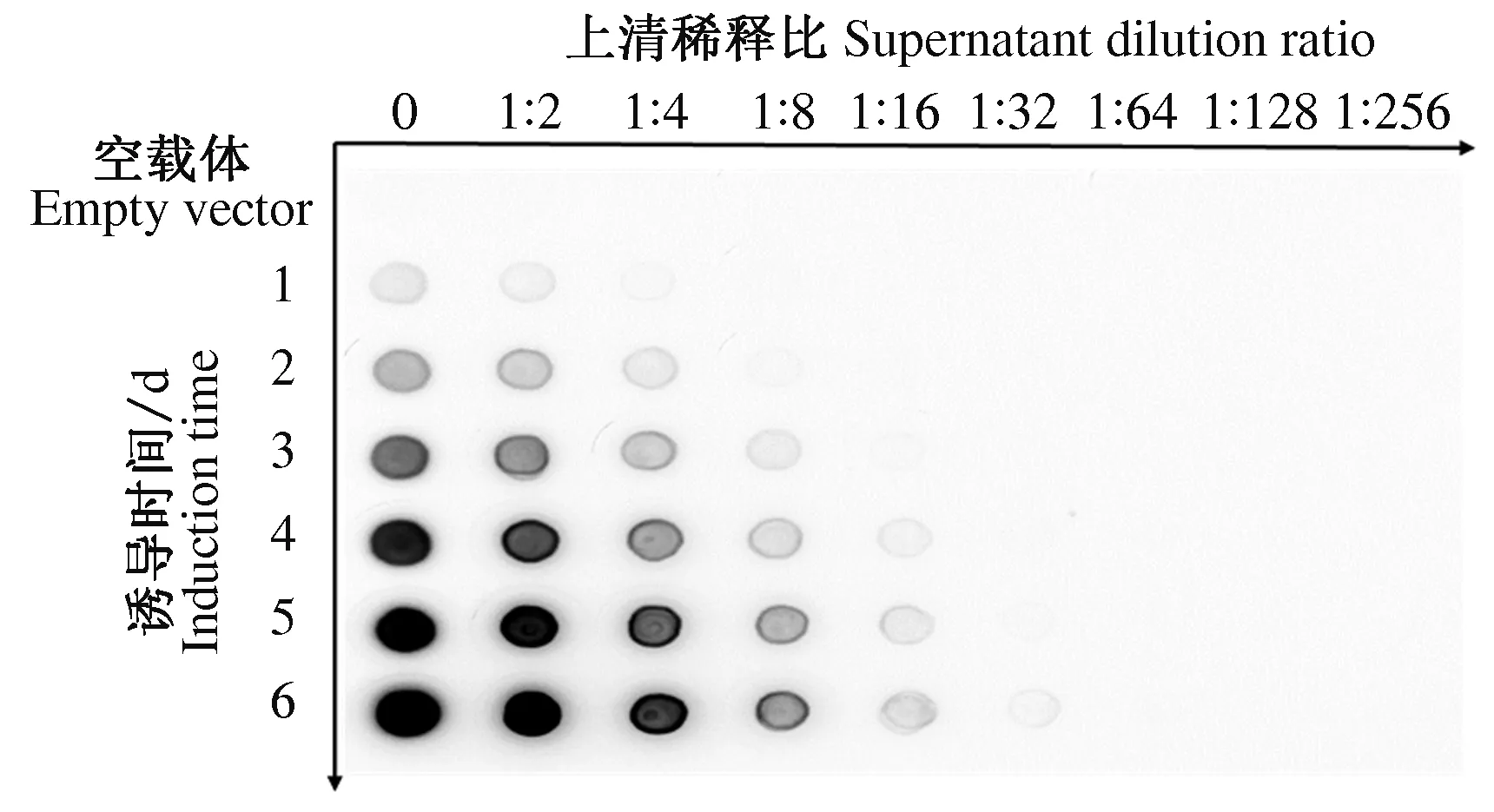
图6 不同诱导时间表达效果Fig.6 Expression results of different induction time
2.4.3 培养基初始pH值 如图7所示,HN蛋白在pH值3.0~8.0均能表达,而pH值为7.0时显色最亮,故本试验中HN蛋白表达的最适培养基初始pH值为7.0。

图7 不同培养基初始pH值表达效果Fig.7 Expression results of different initial pH value of culture medium
2.4.4 诱导温度 如图8所示,诱导温度在28 ℃时显色较亮,但相比其他温度差异不明显,说明温度对HN蛋白表达量影响较小,同时毕赤酵母的最适生长温度为28~30 ℃,故本试验中HN蛋白表达选用28 ℃。

图8 不同温度诱导表达效果Fig.8 Expression results of different temperature
上述结果表明,在28 ℃条件下,培养基初始pH值为7.0,用0.5%甲醇诱导5 d,为重组HN蛋白的最佳表达条件。
2.5 蛋白质纯化
采用AKTA pure纯化仪纯化目的蛋白,以20 mmol/L咪唑洗杂蛋白,200 mmol/L咪唑洗脱目的蛋白,SDS-PAGE结果显示(图9A),经镍柱纯化的目的蛋白纯度达到90%以上,Western blot验证洗脱峰为HN蛋白(图9B)。纯化的HN蛋白经BCA蛋白质浓度测定试剂盒测定,其产量可达25 mg/L。
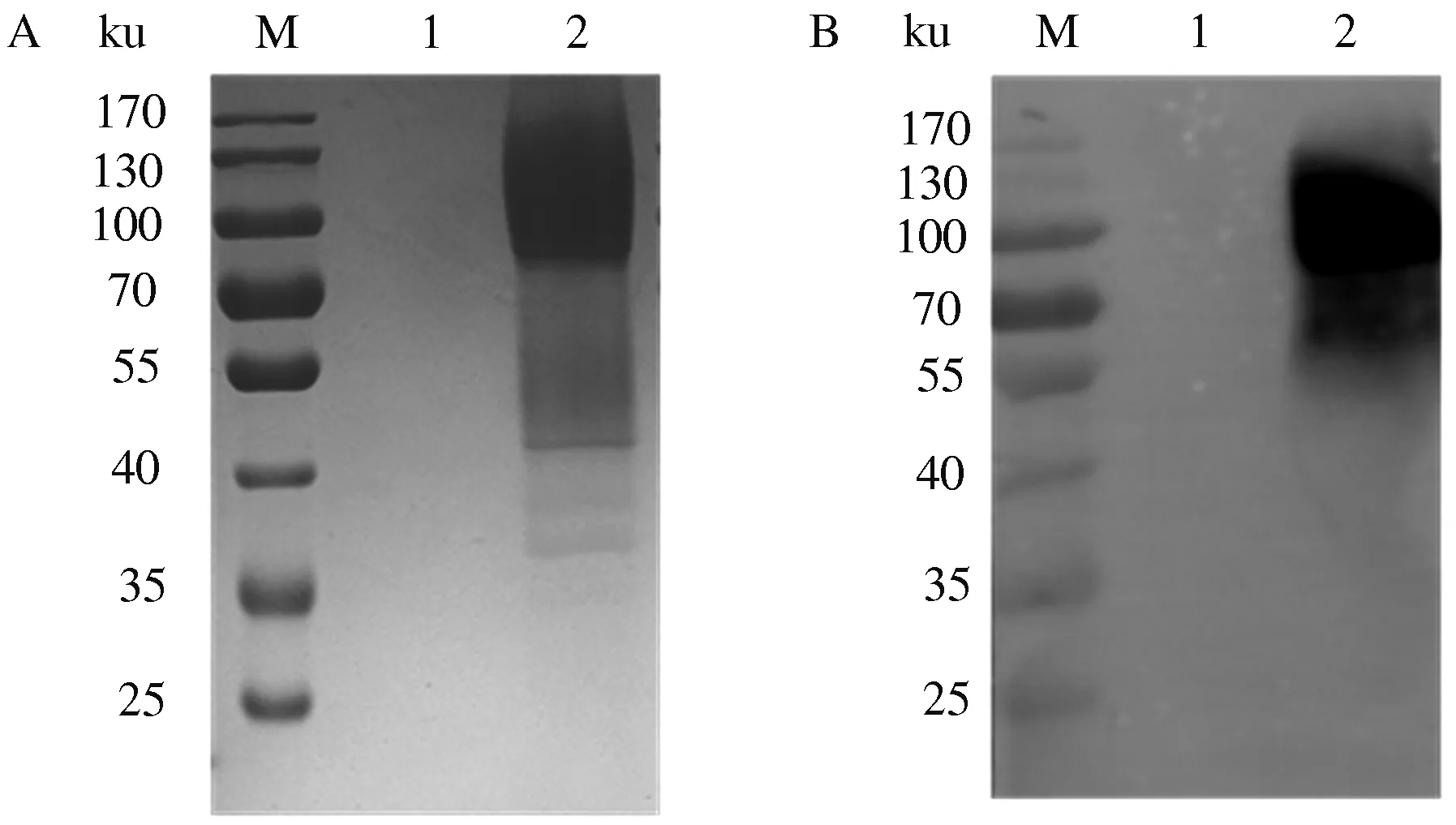
A:SDS-PAGE分析;B:Western blot分析;M:蛋白质Marker;1:流穿液;2:洗脱峰;A:SDS-PAGE analysis;B:Western blot analysis;M:Protein Marker;1:Flow-through fluid;2:Elution peak图9 重组HN蛋白SDS-PAGE和Western blot分析Fig.9 SDS-PAGE and Western blot analysis of purified recombinant HN protein
2.6 蛋白质活性分析
纯化的HN蛋白进行间接ELISA检测,结果表明,HN蛋白与NDV标准阳性血清反应性良好,当血清1∶12 800稀释时,与阴性对照依然存在差异(图10),表明纯化后HN蛋白活性良好。
2.7 蛋白质糖基化分析
Western blot检测结果显示(图11),目的蛋白经PNGase F处理后,蛋白质分子质量变小约为63 ku,说明表达的HN蛋白有N-糖基化修饰,证明重组HN蛋白分子质量偏大和拖带的原因为糖基化。

图10 重组HN蛋白间接ELISA检测Fig.10 Indirect ELISA detection of recombinant HN protein
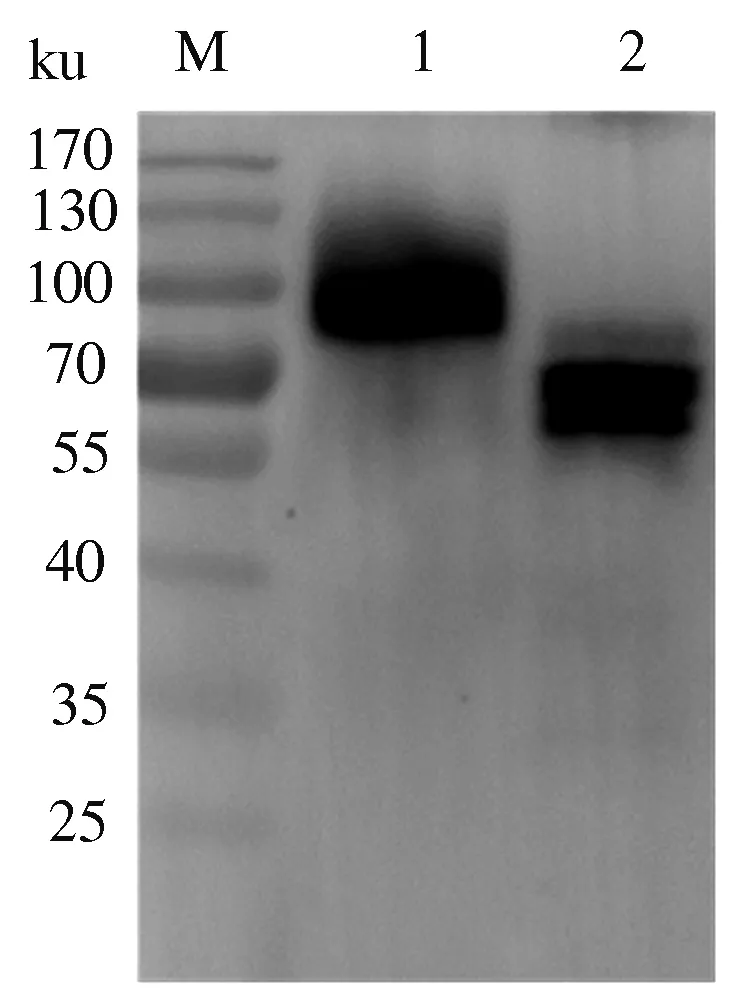
M:蛋白质Marker;1:未处理;2:PNGase F酶切处理M:Protein Marker;1:No treatment;2:PNGase F deglycosylation treatment图11 Western blot分析HN蛋白糖基化Fig.11 Analysis of the glycosylation of HN protein by Western blot
3 结论与讨论
HN蛋白作为NDV的重要结构蛋白,由于其良好的免疫原性,一直是ND亚单位疫苗研究的热点。MOHAN等[15]在大肠杆菌中成功表达了HN蛋白,但原核宿主不能进行蛋白质翻译后糖基化修饰,影响了HN蛋白活性。LEE 等[16]通过杆状病毒表达系统表达了HN蛋白,具有良好的免疫原性,但未能进行高密度培养。蛋白质在哺乳动物系统中的异源表达,形成了具有天然构象的重组蛋白,但价格昂贵,生产水平较低。相比之下,酵母表达体系具有真核生物翻译后修饰特点,且酵母细胞具有快速生长的能力,易于遗传操作[18],可进行发酵培养,成本较低。因此,酵母表达系统作为外源蛋白表达体系在亚单位疫苗研制中具有明显优势[19-20]。
本研究构建了pPICZαA-HN载体,转入毕赤酵母X-33后,成功表达了糖基化修饰的HN蛋白。利用Dot blot对诱导上清直接进行检测,优化了表达条件,最终结果显示,在28 ℃条件下,培养基初始pH值为7.0,用0.5%甲醇诱导5 d,蛋白质表达量较高,产量可达25 mg/L。同时,表达的HN蛋白带有His标签,经镍柱亲和层析一步纯化,即可得到纯度大于90%的HN蛋白。经间接ELISA检测,纯化蛋白能与NDV标准阳性血清特异性反应,表明其活性良好。HN蛋白是糖基化蛋白,试验中目的蛋白比预测分子质量偏大,推测是糖基化导致。为验证推测,使用PNGase F去糖基化酶切后,蛋白质分子质量与预测值相符,说明重组HN蛋白存在糖基化修饰。而糖基化修饰对HN蛋白的活性以及免疫原性的影响情况,还需进一步研究。
综上,HN蛋白在毕赤酵母中成功分泌表达,且活性良好具有糖基化修饰,经镍柱亲和层析一步纯化,即可获得高纯度的目的蛋白,表达条件经优化可显著提高目的蛋白的产量。
