沉淀溶解平衡图象的常见类型和分析方法
2020-04-13甘肃杨仕芳
◇ 甘肃 杨仕芳
沉淀溶解平衡图象以二维曲线形式呈现:包含“轴”(横纵坐标)“线”(图上的一条或几条直线、曲线)“点”(线上的点、线外的点)之间的关系,直观、形象、简洁地反映溶解规律,表达沉淀原理,是近几年高考考查的热点.本文以MnAm(S)nMm+(aq)+mAn-(aq)为依据,对图象的类型和特点加以分析.
1 离子浓度图象

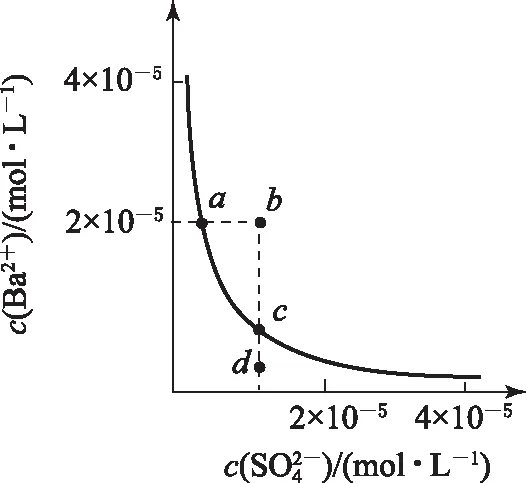
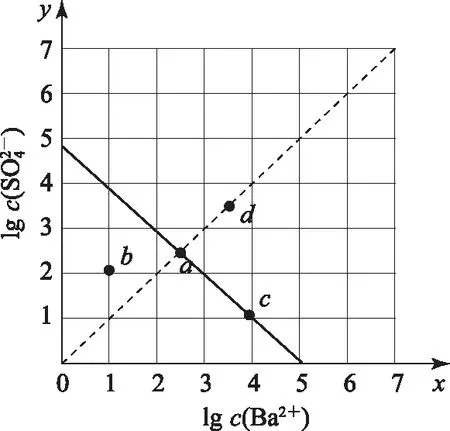
图1
2)由图中曲线上的任意一点的坐标均可计算Ksp(BaSO4).
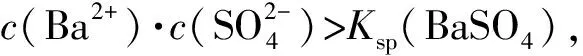

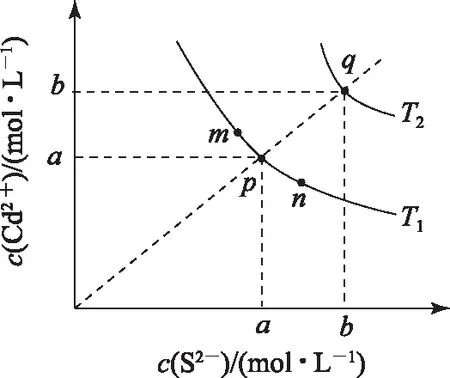
图2
A. 图中a和b分别为T1、T2温度下CdS在水中的溶解度
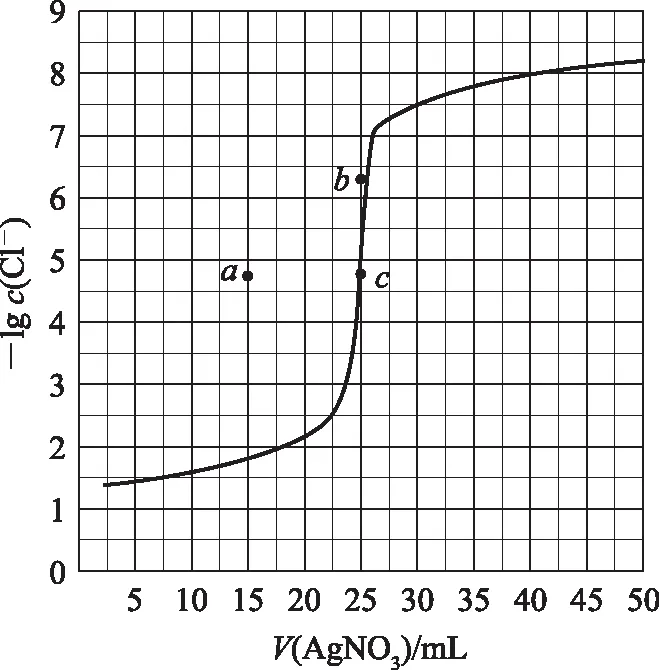
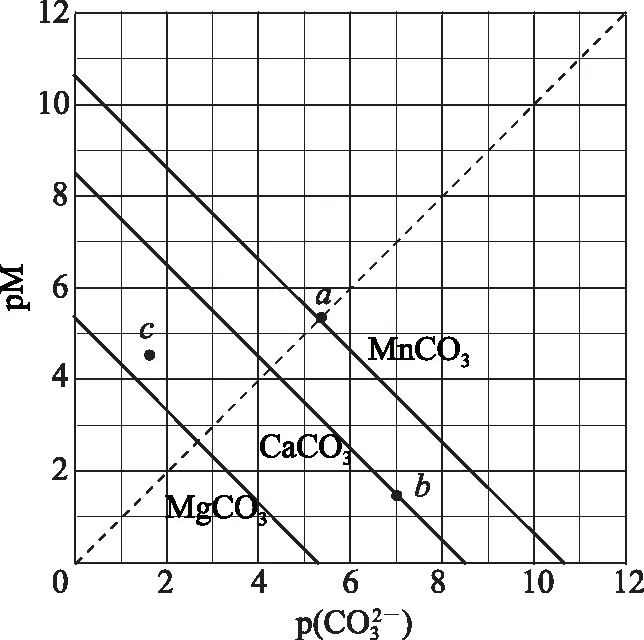
B. 图中各点对应的Ksp的关系为Ksp(m)=Ksp(n) C. 向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动 D. 温度降低时,q点饱和溶液的组成由q沿qp线向p方向移动 图3 2)由图中直线上任意一点的坐标均可计算lgKsp(BaSO4). 若将横、纵坐标变为离子浓度的负对数,同理推导-lgc(Mm+)与-lgc(An-)二者的关系也应是一条直线,但离子浓度的大小与图线中的数据成反比,即图中的数据越大、离子浓度越小. 图4 A. MgCO3、CaCO3、MnCO3的Ksp依次增大 如果图象反映的是难溶氢氧化物的溶解度或金属阳离子浓度与pH的关系,则平衡曲线中应是一条体现溶解度S或离子浓度c随着pH的增大而减小的曲线. 图5 A.Ksp[Fe(OH)3] B. 加适量NH4Cl固体可使溶液由a点变到b点 C.c、d两点代表的溶液中c(H+)与c(OH-)乘积相等 D. Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和 c(Fe3+)·c3(OH-)=Ksp[Fe(OH)3], 选项D说法正确.答案为B. 如果图象反映的是难溶物离子浓度负对数或对数与离子物质的量的关系,则平衡曲线应是与酸碱中和滴定曲线相似的一条曲线. 图6 A. 根据曲线数据计算可知Ksp(AgCl)的数量级为10-10 B. 曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=Ksp(AgCl) C. 相同实验条件下,若改为0.040 0 mol·L-1Cl-,反应终点c移到a D. 相同实验条件下,若改为0.050 0 mol·L-1Br-,反应终点c向b方向移动 沉淀溶解平衡图象是将难溶电解质溶解时的化学反应原理、数学关系与图象结合起来设置的一种数形结合题目,要求学生将抽象思维进行形象化表达.在近几年的高考化学试题中频繁出现,通过分析、识别、判断、推理等高阶思维进行解答,旨在考查学生的综合能力.
2 离子浓度对数或负对数图象
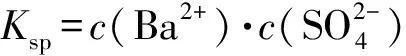
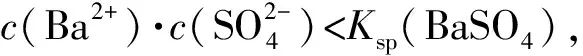

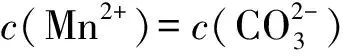
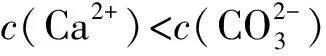
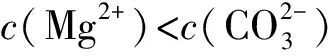

3 溶液pH与溶解度或金属阳离子浓度图象
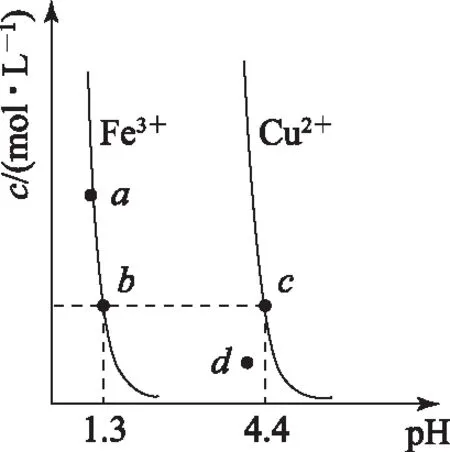


c(Cu2+)·c2(OH-)=Ksp[Cu(OH)2],4 离子物质的量与离子浓度负对数图象