浅谈全国卷涉及“NA”的基本题型及解题思路
2020-04-13安徽尉言勋
◇ 安徽 尉言勋 徐 楠
阿伏加德罗常数的相关知识充分体现了化学研究从定性到定量、从宏观到微观的学科特点,考查学生是否具有灵活运用基础知识解决实际问题的能力.题目以选择题的形式出现,以物质的量为中心结合阿伏加德罗定律、气体摩尔体积等知识进行考查,有时也涉及物质结构、电解质溶液、可逆反应以及气体混合物等相关知识内容.本文通过对近年高考典型试题的对比分析,归纳了阿伏加德罗常数的常见考查方式,希望对复习备考有一定的启发.
1 近年高考典型试题考试内容对比
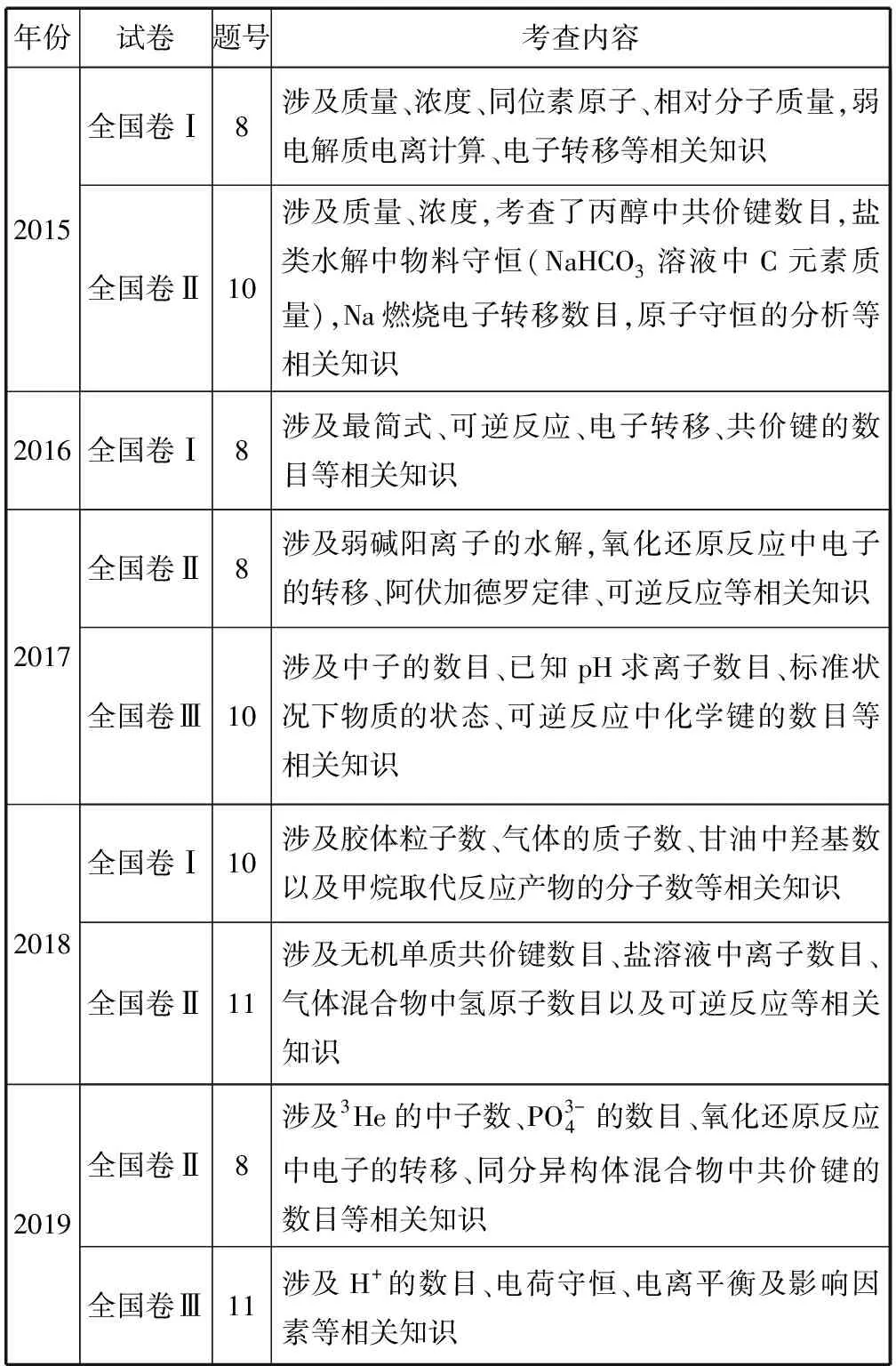
表1
2 关于阿伏加德罗常数的考查方式
通过对比近年高考理综全国卷试题,不难发现,围绕阿伏加德罗常数的命题,主要基于以下5种方式,有的考查基本概念,有的突出考查基础知识,更多的是对考生的解题能力、阅读能力、思维能力和应变能力的考查.
2.1 考查考生对气体摩尔体积概念的把握
1)关注气体的状况.
涉及与气体的体积有关量计算时,一定要注意题给的条件是不是标准状况(0 ℃,1.01×105Pa).同时,还要注意温度和压强影响气体的体积,但不影响气体的质量和物质的量,在考查物质的量、质量与微粒数目的关系时,与气体的状况无关.
2)关注物质状态.
与气体体积相关的运算,必须考虑到相应物质在给定条件下的状态.

表2

A. (2018年全国卷Ⅰ·10B)22.4 L(标准状况)氩气含有的质子数为18NA
B. (2016年全国卷Ⅰ·8D)标准状况下,2.24 L CCl4含有的共价键数为0.4NA
C. (2017年全国卷Ⅲ·10C)2.24 L(标准状况)苯在O2中完全燃烧,得到0.6NA个CO2分子
D. (2018年全国卷Ⅰ·10D)1.0 mol CH4与Cl2在光照下反应生成的CH3Cl分子数为1.0NA

2.2 考查考生的审题能力
关于“NA”的命题,在选择题的题干中往往会设下一些陷阱,以此考查考生的审题能力.在解题的过程中,需要注意以下几个方面.

2) 物质间发生反应引起的体系组成变化.物质间的变化具有一定的隐蔽性,有时需要借助方程式分析才能挖掘出隐含的变化情况.如“NO和O2的混合气”,不但要考虑2NO(g)+O2(g)=2NO2(g),还应考虑2NO2(g)N2O4(g)等.
3)计量条件不足而无法计算.如,题目中只给出物质的量浓度,没有给出体积,则无法计算出物质的量,粒子数则无法计量.

A. (2018年全国卷Ⅱ·8D)密闭容器中,2 mol SO2和1 mol O2催化反应后分子总数为2NA

C. (2018年全国卷Ⅰ·10A)16.25 g FeCl3水解形成的Fe(OH)3胶体粒子数为0.1NA
D. (2017年全国卷Ⅱ·8D)0.1 mol H2和0.1 mol I2于密闭容器中充分反应后,其分子总数为0.2NA

由于氢氧化铁胶体粒子是分子的集合体,多个Fe(OH)3聚合为一个胶体粒子,水解生成的Fe(OH)3胶体粒子数小于0.1NA,选项C不正确;
H2(g)+I2(g)2HI(g),
反应前后气体物质的量不变,选项D正确.答案为D.
2.3 考查考生的粒子观
粒子观是化学的最基本观点之一,粒子的组成、结构、粒子的区别、粒子的界定、粒子的存在形式等,都是考查的重点.当考查一定量的物质中含有的微粒数(分子、原子、离子、质子、中子、电子等)、电荷数之间的关系时,一定要明确物质的微观结构及组成,需注意以下问题.
1) 区别不同单质的分子组成.
气体单质的组成除常见的双原子分子(Cl2、O2、N2等)外,还有单原子分子(如稀有气体Ne)、三原子分子(如O3)、四原子分子(如P4)、五原子分子(如CH4)等.
2) 把握具有相同最简式物质分子的关系.
如NO2与N2O4、乙烯与丙烯、乙炔与苯、乙酸与葡萄糖、两种互为同分异构体的物质等,只要总质量一定,则其中所含原子数与两者比例无关.
3) 注意不同核素的摩尔质量不同.
要注意同位素原子中子数变化对质量数变化的影响,核电荷数和核外电子数未发生变化.比如,重水(D2O)和H218O的摩尔质量均为20 g·mol-1.
4) 掌握特殊物质的原子团结构.
常考的特殊物质有Na2O2(阳离子与阴离子数目之比为2∶1),CaC2、BaO2(阳离子与阴离子数目之比为1∶1).

A. (2019年全国卷Ⅱ·8A)3 g3He含有的中子数为1NA
B. (2015年全国卷Ⅰ·8A)18 g D2O和18 g H2O中含有的质子数均为10NA
C. (2018年全国卷Ⅱ·8C)标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA
D. (2018年浙江4月选考·20A)10 g2H216O含有的质子数与中子数均为5NA

0.5 mol×4×6.02×1023mol-1=2NA,
选项C说法正确;10 g2H216O的物质的量为0.5 mol,含有的质子数与中子数均为5NA,选项D说法正确.答案为B.
2.4 对特殊物质中化学键数的考查
1) 常考无机物中的共价键数目.
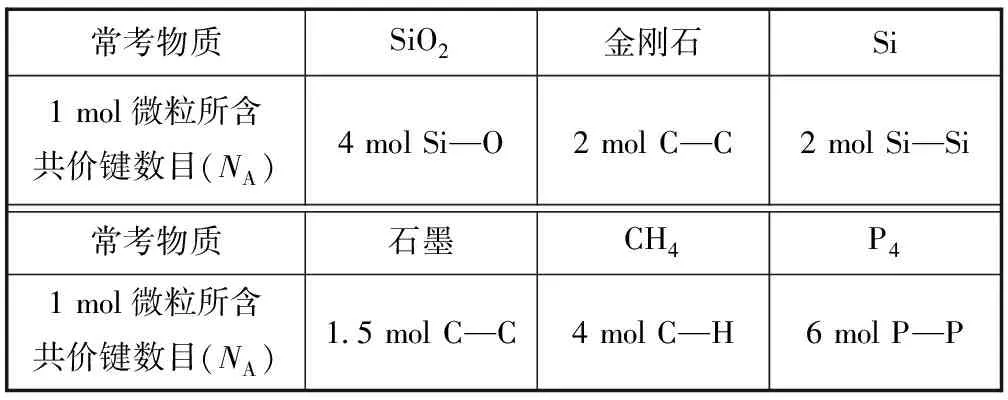
表3
2) 常考的有机物分子中的化学键.
a)烷烃(CnH2n+2)中, C—H键为2n+2(与H原子数相同),C—C键为n-1(比C原子数少1),总键数为3n+1;
b)烯烃或环烷烃(CnH2n)中,C—H 键为2n(与H原子数相同),C—C键(视双键为2条单键)为n,总键数为3n;
c)炔烃(CnH2n-2) 中,C—H 键为 2n-2(与H原子数相同),C—C(视三键为3条单键)为n+1,总键数为3n-1.

A. (2016年全国卷Ⅰ·8D)标准状况下,2.24 L CCl4含有的共价键数为0.4NA
B. (2015年全国卷Ⅱ·10A) 60 g丙醇中存在的共价键总数为10NA
C. (2018年全国卷Ⅱ·11A)常温常压下,124 g P4中所含P—P键数目为4NA
D. (2019年全国卷Ⅱ·8D)48 g正丁烷和10 g异丁烷的混合物中共价键数目为13NA

2.5 考查氧化还原反应中电子的转移数目
氧化还原反应及电极反应中,电子转移与反应物(生成物)之间存在定量关系.高频考点有歧化反应、归中反应、变价金属(Fe、Cu等)参与的反应等.常考反应转移的电子数如表4所示:
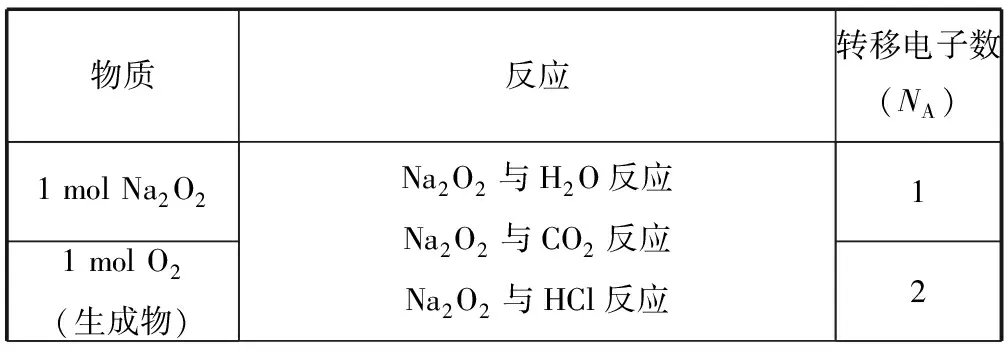
表4

续表

A. (2015年全国卷Ⅰ·8C) 过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA
B. (2017年全国卷Ⅱ·8B)2.4 g Mg与H2SO4完全反应,转移的电子数为0.1NA
C. (2019年全国卷Ⅱ·8C)1 mol K2Cr2O7被还原为Cr3+转移的电子数为6NA
D. (2016年全国卷Ⅰ·8C) 1 mol Fe溶于过量硝酸,电子转移数为2NA

总之,近年全国卷对阿伏加德罗常数的考查比较全面,涉及化学基本理论、元素化合物知识、物质结构以及简单化学计算,涉及的内容多、知识包容性强、涵盖范围广、能力要求高,要加强对基本知识的归纳总结,在练习中不断反思,在审题细节上下工夫,特别要注意试题中一些关键性的字眼,灵活运用解题思维方法,才能有效提高解答与NA有关问题的能力.
